FSH通过AKT/FOXO1通路调控绵羊卵泡颗粒细胞增殖的研究
刘春洁 王兆琛 杜 炜 赵勇超 张家新
(内蒙古农业大学 动物科学学院/内蒙古自治区动物遗传育种与繁殖重点实验室,呼和浩特 010018)
哺乳动物卵泡发育过程中,超过99%的卵泡会发生闭锁,卵泡闭锁是卵巢卵泡发育、成熟、排卵过程中重要的生理过程。如果这一过程不能正常进行,往往会导致雌性动物多囊卵巢综合征和卵巢早衰,甚至不孕不育[1-2]。已有研究表明卵泡闭锁与GCs凋亡密切相关,主要体现DNA碎片化和促凋亡基因表达显著上调[3]。卵泡发育是一个相对复杂的过程,主要受促性腺激素的调控[2,4]。其中促卵泡素(FSH)作为卵泡生长、发育和优势卵泡选择的一种重要的促性腺激素,同时还具有促进GCs增殖分化的功能[5-7]。这一过程是通过激活GCs的多个信号级联引起FSH生理机制应答,包括蛋白激酶A(PKA),蛋白激酶B(PKB/AKT),p38丝裂原活化蛋白激酶(p38-MAPK)和细胞外信号调节激酶1和2(ERK1/2)[8]。
在小鼠细胞研究中发现,通过减缓FOXO1转录抑制可以影响细胞中细胞周期蛋白(Ccnd-2)的表达[9]。研究发现敲除小鼠Ccnd-2基因后,细胞增殖被阻滞[9]。FOXO1的转录抑制也可以影响细胞核抗原(PCNA)基因的表达,PCNA是一种与增殖相关蛋白DNA合成有关的基因,起初表达于初级卵泡的GCs,在FSH作用下其表达量增加[10-11]。Bcl-2作为抗细胞凋亡家族蛋白,定位于线粒体膜,参与GCs的凋亡,其作用机制同样受到FOXO1转录调控[12]。FOXO1基因具有调节细胞凋亡,细胞周期停滞,细胞稳态等功能[9]。由于FOXO1结合DNA,抑制或激活靶基因特异性转录[13]。而FOXO1结合DNA能力主要受AKT磷酸化作用,当未发生磷酸化时,FOXO1定位于细胞核,通过与其靶基因结合到FOXO1识别元件(FRE)上,发挥生物学活性[13-14]。
FOXO1是FSH信号通路的靶分子,受FSH的负调控。FSH通过PKB/AKT通路引起FOXO1的磷酸化失活,从而失去对靶基因的转录调节作用[15]。因此,FSH维持卵泡生长发育的功能可能与FSH对FOXO1的抑制有关。其在GCs上发挥的潜在机制仍有待进一步探究。关于FSH通过AKT/FOXO1通路调控卵泡颗粒细胞增殖的研究大多数是针对小鼠等试验动物,在家畜上研究较少,因此,本试验拟用绵羊卵巢GCs,对绵羊GCs用不同浓度FSH处理后,利用CCK-8法检测细胞活性,AnnexinV-FITC测定细胞凋亡和细胞周期变化,Western-Blot检测p-AKT和p-FOXO1蛋白质表达;qPCR分析PCNA、CCnd-2和Bcl-2基因表达量变化,以期探究FSH通过AKT/FOXO1信号通路对绵羊GCs的调节作用,为提高母畜繁殖性能提供理论基础。
1 材料与方法
1.1 试验材料
本地屠宰场获得绵羊(24~36 月龄,体重平均83 kg)卵巢,去掉系膜等残余组织,使用37 ℃生理盐水洗涤3次,置含有预热37 ℃生理盐水保温杯内,并于2~3 h内送至实验室,然后再预热37 ℃,添加青链霉素合剂的生理盐水洗涤卵巢3遍,将卵巢放于预热的灭菌生理盐水,置37 ℃水浴锅,待用。
1.2 试验试剂
促卵泡激素FSH(Bioniche,加拿大); DMEM/F 12培养基(Gibco,美国);胎牛血清(HyClone,美国);电转液购自(Biosharp,中国);0.45 μm PVDF膜(Millipore,美国);AKT 磷酸化抗体、FOXO1磷酸化抗体、β-actin抗体、AKT抑制剂AT7867(MCE,美国);HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG、蛋白Marker、ECL底物液、Revert Aid First Strand cDNA Synthesis Kit(Thermo Scientific,美国);Annexin-FITC/PI(Vazyme,美国);CCK-8(Beyotime Biotechnology,中国)。
1.3 试验方法
1.3.1GCs收集
在超净台内用眼科剪将卵巢上的卵泡小心分离,用PBS尽可能将卵泡周围的组织清洗干净。收集直径4~6 mm大小卵泡。在盛有PBS的凹形皿内,用眼科剪将卵泡轻轻剪开,用刮刀沿卵泡内壁适度刮取细胞,置于含青霉素链霉素的PBS液中,并清洗3次,然后用添加0.3%牛血清白蛋白,3%胎牛血清,1 %青链霉素合剂的DMEM/F 12培养基重悬细胞,PI染色计数,调整细胞密度为5×105个/mL,转移到1.5 mL的离心管内,1 400 r/min 离心5 min后弃上清,立即将细胞投入液氮,后放入 -80 ℃ 冰箱保存,用于后续RNA提取。
1.3.2不同浓度FSH和抑制剂AT7867对GCs增殖影响
将分离纯化的绵羊颗粒细胞按相同浓度接种至96孔培养板中,每孔细胞进行随机分组进行后续试验。试验一将分组的每孔细胞分别添加0、5、10和20 ng/ mL FSH。培养24 h后,采用CCK-8法对不同时间检测细胞活性。观察FSH对绵羊卵巢GCs活性的影响。每组数据重复3 次以上。试验二将分组的每孔细胞分别添加0、5、10、20和40 μmol/L抑制剂AT7867,试验方法同试验一。观察抑制剂AT7867对卵巢GCs培养的影响。每组试验各重复3 次以上。
1.3.3GCs周期检测
培养24 h获得细胞,用不含EDTA的胰蛋白酶室温消化15~20 min,消化后经PBS清洗2~3次,1 400 r/min,离心5 min后,收集细胞沉淀后用70%预冷乙醇固定24 h左右。然后收集不同处理后固定的细胞样本,经PBS洗涤2~3次后,根据细胞周期试剂盒测定不同处理样本,每个样本添加100 μL Rnase酶吹打均匀后,37 ℃处理30 min,然后各孔添加400 μL PI染液,4 ℃避光孵育30 min,使用流式仪细胞检测细胞周期。
1.3.4GCs凋亡检测
将待检测细胞从培养箱取出,然后用预冷PBS清洗细胞2~3次;各孔加500 μL不含EDTA的胰蛋白酶,室温消化,待细胞完全脱落,用移液枪轻轻吹打使细胞分散;将所吸出EP管中培养液加到对应各孔细胞内,终止胰蛋白酶消化;然后将细胞悬液转入5 mL EP管内,1 400 r/min,离心5 min,弃上清,用1 mL PBS轻轻吹起沉淀细胞,洗涤2~3次,1 400 r/min,离心5 min后弃上清;按照细胞凋亡检测试剂盒说明书,每个样本加入500 μL结合缓冲液重悬细胞,然后加入5 μL AnnexinV-FITC和5 μL PI,轻轻混匀,室温避光(锡箔纸)孵育10~30 min,流式细胞仪检测细胞凋亡。
1.3.5qPCR检测GCs中基因表达
采用TRNzol法提取组织样品总RNA,使用NanoDropTMND-2000测定RNA浓度和纯度。要求A260/280介于1.8~2.1, 28S:18S)≥1.8∶1.0,浓度≥200 ng/uL。采用qRT-PCR技术定量分析PCNA、CCnd-2和Bcl-2基因在不同培养条件下获得颗粒细胞中的表达水平。采用Oligo 6.0软件设计qPCR并合成引物(表1)。分别采用Prime ScriptTMRT试剂盒和SYBY Premix ExTaqTM试剂盒(TaKaRa,日本)进行cDNA逆转录和qPCR反应,所有操作严格按照试剂盒说明书于IQ-5荧光定量PCR仪(Bio-Rad,美国)上进行。qPCR反应体系为25 μL,包括12.5 μL SYBR Premix Ex Taq TM(2a)、1 μL上游引物、1 μL下游引物、2.0 μL cDNA模板和8.5 μL ddH2O。反应程序:预变性95 ℃ 5 min;变性95 ℃ 5 s,退火60 ℃ 20 s,延伸72 ℃ 15 s,45个循环,延伸阶段收集荧光信号,70~95 ℃绘制溶解曲线。采用β-actin作为内参基因,每组数据重复3次以上。

表1 qPCR引物Table 1 Primers of qPCR
1.3.6Western blotting 法检测蛋白表达
准备进行SDS-PAGE的5%浓缩胶和12%分离胶。样品经缓冲液变性处理,上样,每孔20 μg。湿转膜法完成后经染色剂对膜进行染色并鉴定转膜效果。将转膜良好的膜完全浸没5%脱脂奶粉-TBST液中,室温轻摇封闭30 min,后用5%脱脂奶粉-TBST按1∶1 000稀释p-AKT和p-FOXO1抗体,室温震摇10 min,充分混匀抗体,置摇床震摇过夜。第2天使用TBST洗膜5次,每次5 min,用5%脱脂奶粉-TBST按1∶1 000 稀释二抗IgG,室温轻摇40 min,TBST洗膜6次,每次5 min,ECL孵育,最后化学发光成像仪成像。
1.3.7数据分析
采用2-ΔΔCT公式计算qRT-PCR结果,利用SPASS统计软件T-test进行差异显著性检验,数据以平均值±标准差(Mean±SEM)表示。每组试验数据重复至少3次。
2 结果与分析
2.1 FSH对GCs活性影响
在绵羊GCs培养基中添加浓度分别为0、5、10、20和40 ng/mL的FSH进行培养。每间隔1 d记录GCs增殖情况,接种当天记录0 d,及接种后1~6 d,结果见图1。10 ng/mL FSH培养GCs活性极显著高于其他处理组(P<0.01)。进一步证明FSH能显著提高GCs的增殖能力。
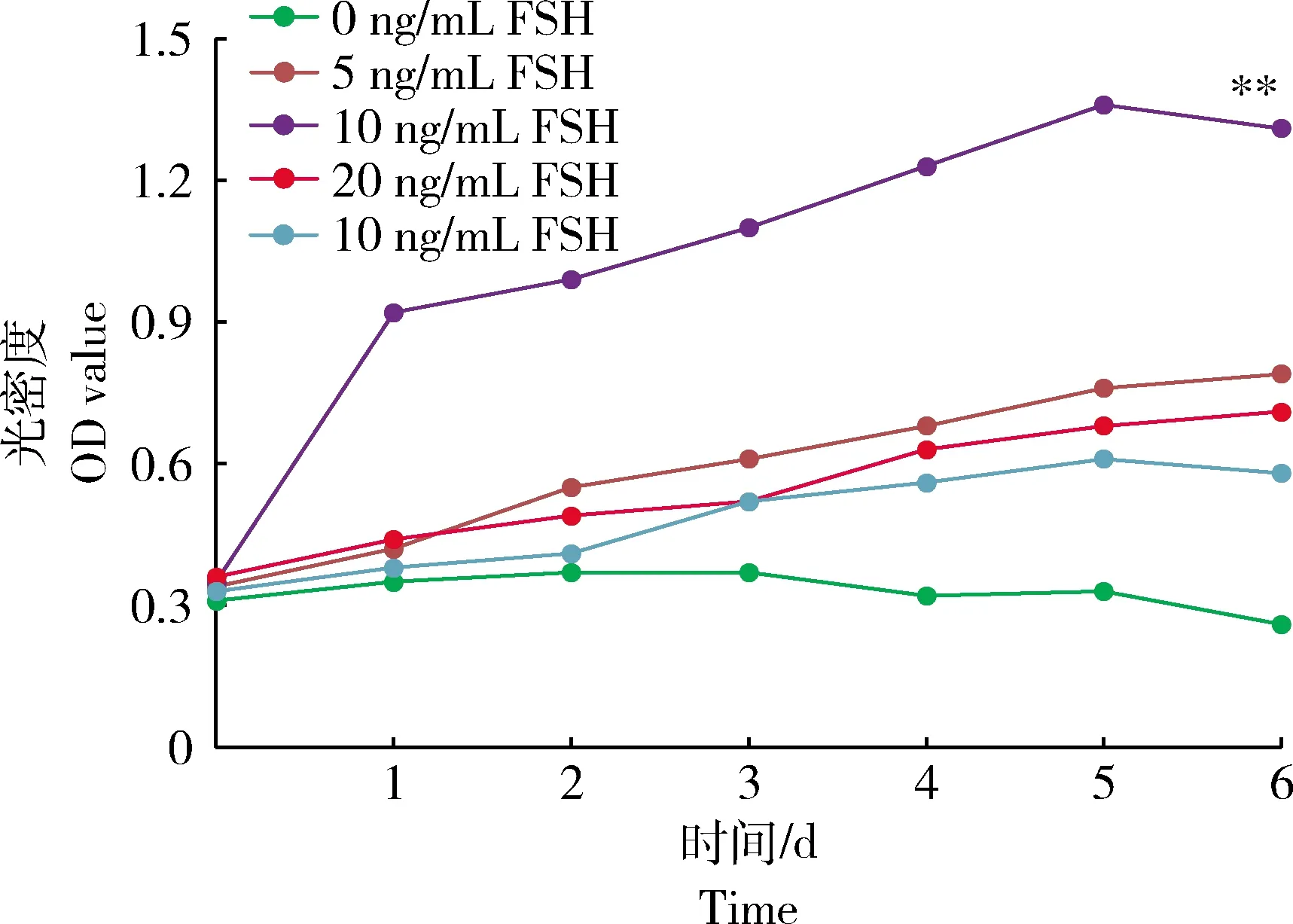
**表示差异极显著P<0.01。**indicates extremely significant difference (P<0.01).图1 不同浓度促卵泡素对体外颗粒细胞活性影响Fig.1 Effect of different concentrations of FSH on the GCs viability in vitro
2.2 FSH对GCs凋亡影响
将GCs接种6孔板培养24 h后,利用Annexin V-FITC/PI荧光染色。采用流式细胞仪检测细胞凋亡情况,结果见图2:在10 ng/mL FSH培养下,GCs凋亡率极显著低于其他浓度FSH培养的GCs(P<0.01)。这一结果说明10 ng/mL FSH对绵羊GCs增殖有明显地促进作用,同时能显著抑制绵羊GCs凋亡。
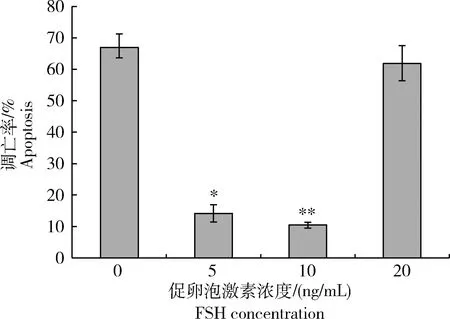
*表示差异显著P<0.05;**表示差异极显著P<0.01。*indicates significant difference (P<0.05). **indicates extremely significant difference(P<0.01).图2 不同浓度促卵泡素对体外颗粒细胞凋亡影响Fig.2 Effect of different concentrations FSH on the apoptosis of the GCs in vitro
2.3 FSH对GCs周期的影响
分别将不同浓度FSH添加培养基中培养GCs 24 h后,使用PI染色检测细胞周期。由图3可见:添加10 ng/mL FSH后,细胞从 G1期到 S期过渡时期,细胞增殖数量出现显著提高(P<0.05)。由于GCs增殖速度和数量发生变化主要发生于细胞周期G1到S阶段过渡中。这一过程主要受卵巢内分泌因子与调节因子之间的相互作用,用以调节卵泡颗粒细胞增殖和分化。
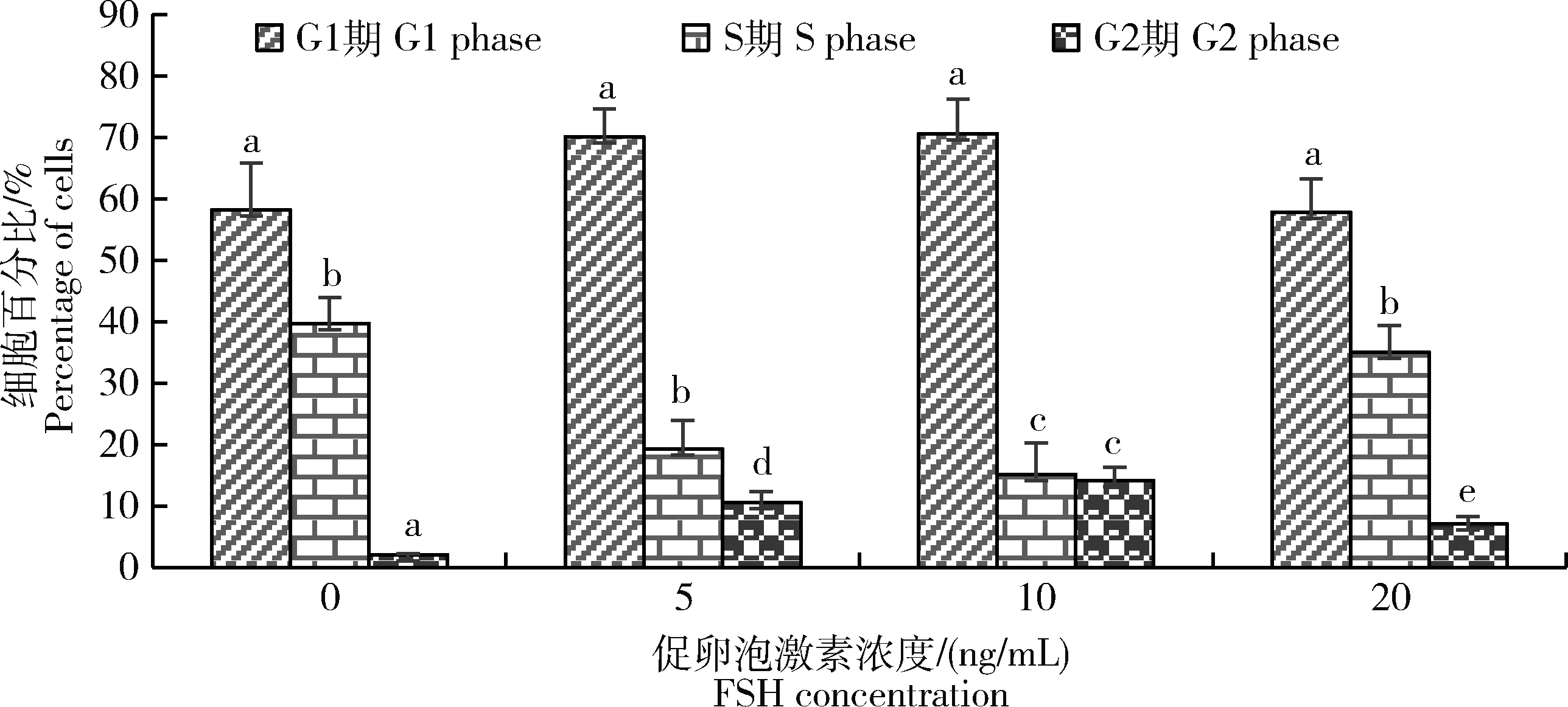
不同字母表示差异显著P<0.05。Different letters indicate significant differences between groups (P<0.05).图3 不同浓度促卵泡素对体外绵羊颗粒细胞周期影响Fig.3 Effect of different concentrations FSH on the GCs cell cycle in vitro
2.4 抑制剂AT7867对GCs活性影响
使用AKT/FOXO1通路的抑制剂AT7867预处理GCs,根据抑制剂的不同浓度(0、 5、10、20和40 μmol/L)和不同时间(0、4、8、12、16、18、24、26 和28 h)测定GCs活性。结果表明10 μmol/L AT7867抑制剂孵育24 h,GCs活性极显著低于其他处理组(P<0.01)(图4)。抑制剂AT7867可阻断AKT发生磷酸化,进一步影响AKT信号通路下游靶基因FOXO1的转录水平,最终阻滞GCs增殖分化功能。
2.5 FSH通过AKT/FOXO1信号通路上调PCNA、Ccnd-2和Bcl-2
组1是GCs仅用培养基DMEM/F 12为对照组,组2为添加10 ng/mL FSH,组别3为添加10 μmol/L AT7867抑制剂,组别4是同时10 ng/mL FSH和10 μmol/L AT7867抑制剂,孵育24 h后,通过Wester-Blot检测,如图5(a)~(b)所示,与其他处理组相比,10 ng/mL FSH(4(a2))显著提高p-AKT(S473)蛋白的表达,降低p-FOXO1蛋白水平(4(b2)),同时上调绵羊GCs中PCNA、Ccnd-2和Bcl-2基因。如图5(c)~(e)。PCNA、Ccnd-2和Bcl-2是通过AKT/FOXO1信号通路参与细胞增殖,抑制细胞发生凋亡的生物学过程。
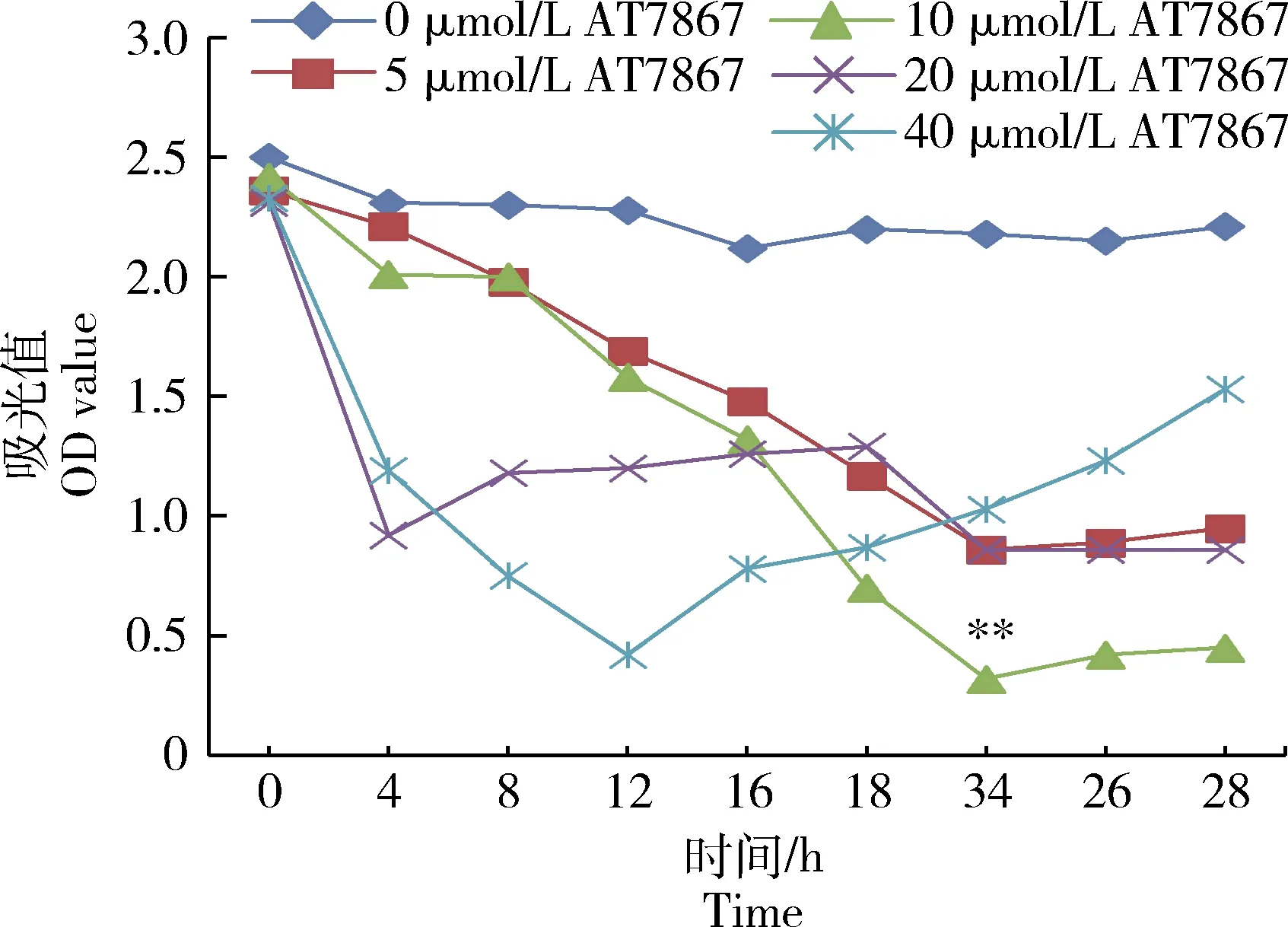
图4 不同浓度抑制剂AT7867对体外颗粒细胞活性影响Fig.4 Effect of different concentrations inhibitor AT7867 on the GCs viability in vitro
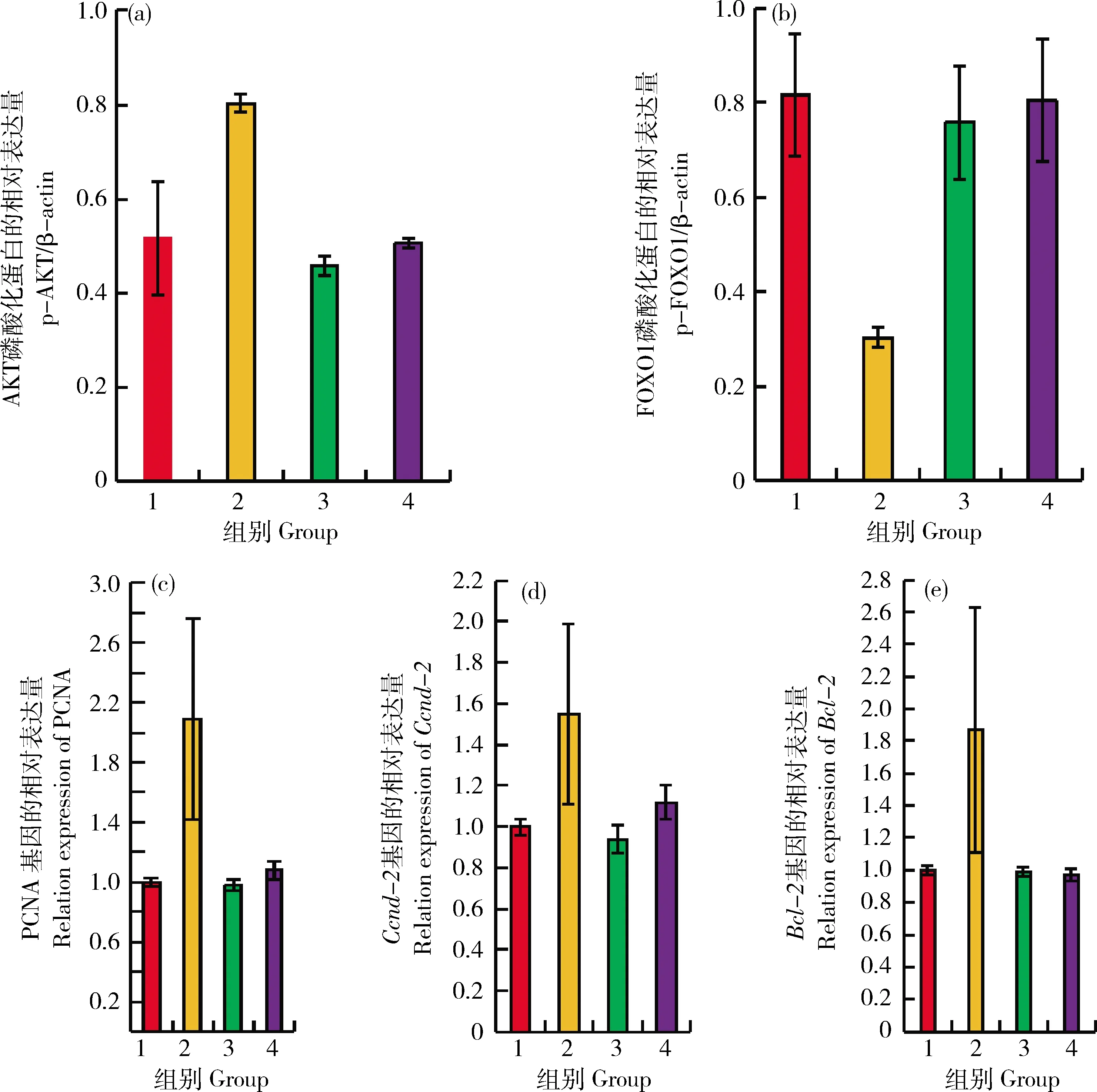
1:对照组;2:促卵泡素;3抑制剂AT7867;4:促卵泡素加抑制剂. **表示差异极显著P<0.01。1:Control; 2:FSH; 3:Inhibitor AT7867; 4:FSH+AT7867.**indicates extremely significant difference (P<0.01).图5 FSH通过AKT/FOXO1通路上调靶基因Fig.5 FSH up-regulate targeted genes by AKT/FOXO1 pathway
3 讨论与结论
哺乳动物卵巢卵泡的发育主要受垂体分泌的促性腺素调控。其中FSH是卵泡发育过程中形成优势卵泡的主导激素[16]。FSH通过靶器官细胞膜上的特异性受体FSHR介导,影响卵泡发育的成熟和卵泡数量。FSHR主要表达卵巢卵泡GCs,其表达水平与GCs存活、卵泡闭锁和卵母细胞成熟密切相关[17]。本试验通过添加不同浓度FSH对绵羊GCs进行24 h培养后,检测其细胞活性和凋亡,发现10 ng/mL FSH对绵羊GCs增殖有明显的促进作用,同时能显著减少绵羊GCs凋亡(图1和图2)。已有研究表明卵泡发育和闭锁调节是一个复杂的过程,涉及内分泌因子与卵巢调节因子之间的相互作用,从而控制卵泡细胞的命运(细胞增殖、分化和细胞程序性死亡)[18]。本试验中添加10 ng/mL FSH处理24 h后,检测到细胞从 G1期到 S期,发现细胞增殖数量出现显著提高。这与已有研究报道GCs增殖速度和数量发生变化主要发生于细胞周期G1到S阶段过渡中的结果一致[19-20]。
已有研究表明FSH下游的转录因子PCNA、Ccnd-2和BCl-2的特异性表达水平,主要受FOXO1调控[15-18];而FOXO1主要受AKT磷酸化调控,由PI3K途径激活,调节细胞周期、代谢或存活[21-22]。其中:PCNA是真核细胞DNA合成时所必需的一种细胞核蛋白,在细胞核内合成,并储存核内。PCNA在细胞分裂期出现,其表达量的变化与DNA合成一致,与多种细胞周期调节因子和细胞增殖密切相关[16]。而Ccnd-2是参与调控细胞周期中G1期向S期过渡的重要蛋白[17]。Bcl-2作为G1/S期过渡阶段的重要的调控蛋白,一方面能够促进细胞增殖,抑制细胞发生凋亡;另一方面可以调节细胞氧化还原状态(非蛋白巯基、谷胱甘肽),增强细胞抗氧化能力,减轻由氧化应激引起的细胞早期凋亡[23]。
在大鼠GCs的试验中证实,抑制FOXO1磷酸化水平,能增强细胞中PCNA和Ccnd-2基因的特异性表达水平,进而阻滞细胞发生凋亡[15]。进一步在大鼠肾小球系膜细胞的研究发现,FOXO1过表达会促使抗凋亡因子Bcl-2下调,导致细胞周期停滞,降低细胞增殖能力[24]。阻断AKT下游的FOXO1蛋白质的磷酸化水平,则导致下游靶基因的功能发生改变[25]
本研究结果表明: 10 ng/mLFSH处理能显著升高GCs中p-AKT蛋白水平和显著降低p-FOXO1的表达量,显著上调PCNA、CCnd-2和Bcl-2的转录水平;并能显著增强绵羊GCs活性和显著减少绵羊GCs凋亡。FSH通过AKT/FOXO1信号通路调控靶基因PCNA、CCnd-2和Bcl-2转录水平,本研究可为进一步探明绵羊GCs功能的分子机制研究奠定基础。

