磁共振DWI参数ADC值与子宫内膜癌病理特征的相关性分析
陈淑超,滕陈迪
(温州市中心医院放射影像科,浙江 温州 325000)
子宫内膜癌是女性生殖系统第二大恶性肿瘤,发病率逐年升高并呈年轻化趋势[1],其发病率在上海等地区已超过宫颈癌,严重威胁女性生命健康。手术治疗是子宫内膜癌的主要治疗手段[2],术前准确评估子宫内膜癌患者的病理特征、制定合理的治疗方案,对改善患者的预后尤为重要[3]。影像学是评估子宫内膜癌病理特征的重要手段之一,临床常用的影像学方法包括计算机断层扫描(computed tomography,CT)、经阴道超声、磁共振成像(magnetic Resonance imaging,MRI)等,其中MRI具有无创、无辐射、软组织分辨率良好等优点,性能优于经阴道超声、CT等,被广泛用于临床[4]。常规MRI扫描对子宫内膜癌病理鉴别灵敏度较低,在鉴别组织浸润程度等方面价值有限[5]。弥散加权成像(diffusion weighted imaging,DWI)是MRI的功能性成像技术,可对活体组织中水分子运动进行无创成像,通过测量组织水分子的表观扩散系数(apparent diffusion coefficient,ADC)来反映反应先于形态学改变的病变情况,可弥补常规MRI的不足[6]。本研究回顾性收集经我院病理学确诊并收治的子宫内膜癌患者的临床病案资料,分析磁共振DWI参数ADC值与子宫内膜癌患者病理特征的相关性,以期为临床子宫内膜癌的诊治提供参考。
1 资料与方法
1.1 一般资料
回顾性收集2017年1月至2019年1月于温州市中心医院经病理学诊断确诊并收治的90例子宫内膜癌患者的病案资料,包括患者年龄、体重指数、国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)手术-病理分期[7]、肿瘤分化程度、ADC值等。该研究获得本院医学伦理学会的批准。
1.2 入组与排除标准
纳入标准:①患者经病理学诊断并确诊为子宫内膜癌,符合《子宫内膜癌诊断与治疗指南(第四版)》标准[1];②年龄≥30岁;③术前行磁共振常规扫描及DWI检查;排除标准:①术前已进行肿瘤相关化疗、放疗者;②合并其他恶性肿瘤者;③临床病案资料不完整者;④MRI及DWI图像质量不清晰,有严重伪影者。
1.3 方法
1.3.1检查方法
检查器械采用Siemens MAGNETOM Spectra 3.0T磁共振成像系统,并配有多通道腹部表面线圈。所有患者检查前需严格禁食6-8h,并进行屏气训练。检查时患者取仰卧位,分别进行MRI常规扫描及DWI成像。
常规扫描:扫描范围为耻骨联合下缘至主动脉分叉水平处,尽量囊括所有病变。包含轴位T1WI:层厚为6mm,TR为600ms,层间距1mm,矩阵224×320,TE 7.4ms,FOV 36cm×36cm;T2WI:层厚为6 mm,TR为3800ms,层间距1mm,矩阵224×320,TE 87ms,FOV 36cm×36cm。
DWI检查:患者采取胸式呼吸并维持均匀、平稳呼吸。选取单次激发快速自旋回波序列,DWI参数设置为层厚5mm,层间距0.5mm,TE 69ms,矩阵192×140,FOV 254cm×420cm,扫描时间1.75min。扫描范围为耻骨联合下缘至髂嵴水平,覆盖全子宫及阴道,并分别在X、Y、Z轴三个方向上增加弥散敏感梯度。
1.3.2数据处理
将上述检查所得图像资料传输至配套的AW 4.5工作站中进行图像处理,在工作站上获得特定B值下的DWI图像、ADC图及参数值,最终以ADC均值作为最终测量值。
1.4 统计学方法
2结果
2.1基本情况分析
研究对象共90例,年龄范围33~68岁,平均年龄(60.25±5.47)岁;体重指数范围19~28kg/m2,平均体重指数(22.15±1.04)kg/m2。病理特征:以FIGO分期对研究对象进行分组:Ⅰ期患者21例,Ⅱ期患者35例,Ⅲ期患者20例,Ⅳ期患者14例。同时依据病理检查的分化程度对研究对象进行分组:高分化24例,中分化38例,低分化28例。详情见表1。


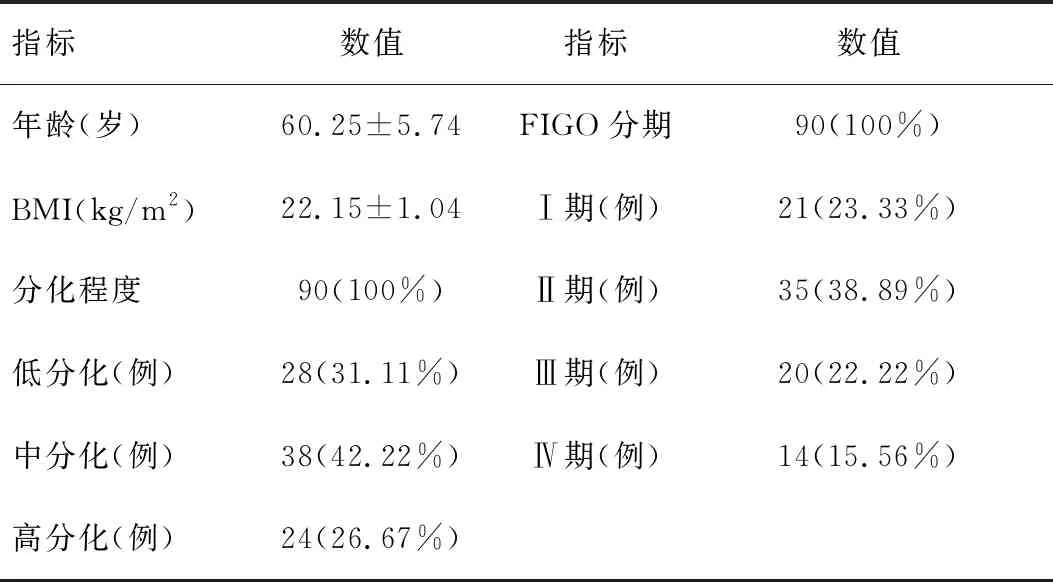
指标数值指标数值年龄(岁)60.25±5.74FIGO分期90(100%)BMI(kg/m2)22.15±1.04Ⅰ期(例)21(23.33%)分化程度90(100%)Ⅱ期(例)35(38.89%)低分化(例)28(31.11%)Ⅲ期(例)20(22.22%)中分化(例)38(42.22%)Ⅳ期(例)14(15.56%)高分化(例)24(26.67%)
2.2 ADC值与子宫内膜癌病理特征的Spearman相关性分析
在相关性分析中,ADC值与子宫内膜癌患者的FIGO分期呈负相关(r=-0.76,P<0.05),与分化程度呈正相关(r=0.82,P<0.05)。详情见表2。

表2 ADC值与子宫内膜癌FIGO分期、分化程度的相关性分析
2.3 ADC值与子宫内膜癌病理特征的关联
分析结果显示:不同FIGO分期子宫内膜癌的磁共振DWI参数ADC值具有显著差异(F=16.03,P<0.05)。病理分期越差,ADC值越小,组间差异均具有统计学意义(均P<0.05),详情见表3。
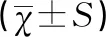


FIGO分期ADC值(103s/mm2)分化程度①Ⅰ期Ⅱ期Ⅲ期统计值②FPⅠ期1.04±0.26///16.03<0.05Ⅱ期0.91±0.172.85*//Ⅲ期0.79±0.133.63*2.98*/Ⅳ期0.64±0.085.38*4.63*3.71*
注:“/”表示该项无结果;①不同FIGO分期ADC值的双变量方差分析,显示数据为t值;②不同FIGO分期ADC值的F检验;* 表示差异具有统计学意义,P<0.05。
子宫内膜癌肿瘤细胞不同分化程度的ADC值具有显著差异(F=23.34,P<0.05),分化程度越低,ADC值越小,各分组间比较差异均有统计学意义(均P<0.05)。见表4。
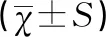
表4 ADC值与子宫内膜癌分化程度的关系
注:“/”表示该项无结果;①不同FIGO分期ADC值的双变量方差分析,显示数据为t值;②不同FIGO分期ADC值的F检验;*表示差异具有统计学意义,P<0.05。
3.讨论
3.1子宫内膜癌的评估方法
子宫内膜癌是女性生殖系统第二大恶性肿瘤,发病率逐年上升,严重威胁女性生命健康[2]。临床治疗上,子宫内膜癌常采取以手术治疗为主的综合方案,其诊疗方案的制定与肿瘤的病灶大小、病理特征、浸润转移程度等密切关联。同时,子宫内膜癌病理分期与组织病理分化程度等是影响患者预后的最重要因素[8]。因此早期判断子宫内膜癌的病理特征并制定合理的治疗方案,对患者的预后尤为重要[9]。子宫内膜组织活检是确诊子宫内膜癌的金标准,但无论是诊断性刮宫还是宫腔镜下活检在病变整体的取材上均存在劣势,难以进行全面、综合的评估。随着影像学技术的发展,经阴道超声、CT、MRI等多种方法可用于病变的评估,但经阴道超声的视野受限多,CT组织分辨率低,而PTE/CT检查易受女性生理水平变化的影响,在评估子宫内膜癌患者的病理特征中价值均有限[10]。MRI具有无辐射、无创伤且软组织分辨率高的特点,是目前临床公认的评估子宫内膜癌最优的影像学手段。而DWI作为MRI的一种功能性成像技术,与常规MRI检查相比,在诊断和鉴别子宫内膜癌、评估病理特征等方面具有独特的价值[11-12]。
3.2 MRIDWI的成像原理与DWI参数ADC值在子宫内膜癌检查中的应用
评估子宫内膜癌情况时,结合带尤为重要。结合带是子宫在MRI上显示的结构,位于子宫内膜与肌层之间,是区分子宫内膜癌分期的重要标志。常规的MRI在评估子宫内膜癌的浸润、转移等方面具有一定的局限性,这是因为MRI常规扫描很难区分萎缩的子宫内膜、肌层与结合带。DWI是目前唯一可在活体组织中测量水分子扩散情况的检查方法,通过检测机体组织内水分子扩散运动的受限程度及其受限方向,可反应组织细胞的结构变化。当水分子在机体中扩散未明显受限时,表现为低信号,水分子的扩散受限时则表现为高信号,水分子受限的程度决定信号强度,受限程度越大,则信号越强[13],最终以ADC进行呈现。不管是机体正常组织还是癌组织的均以水分子的自由扩散为主。与正常细胞组织相比,肿瘤细胞增殖快、结构多且乱、细胞外间隙缩小,水分子自由运动被限制,MRI检查时信号变强,则ADC值降低[14]。
在本研究中,子宫内膜癌患者T2WI显示子宫内膜、基层增厚呈现稍长T2信号,结合带中段或连续,肌层的信号欠均匀,T1WI则显示延迟期病灶出现相对低信号,显著低于正常子宫肌层,可清晰显现病灶的轮廓,两者用于病灶的定位。当MRI常规扫描结合带显示不清时,通过DWI后肿瘤病灶呈弥散受限高信号,可清晰显示肌层与肿瘤的强化差异,从而鉴别肿瘤浸润情况[4]。
3.3研究结果与分析
本研究分析显示,ADC值与子宫内膜癌的分化程度呈正相关、与FIGO分期呈负相关(r=0.82、-0.76,均P<0.01)。分化程度越低、病理分期越差的患者,ADC值越低。相关研究表明,子宫内膜癌组织分化程度越低,细胞越不成熟,细胞体积大,细胞器增多,细胞核、胞浆比大,细胞排列紧凑,组织细胞内水分子扩散运动受限制,则ADC值变低。而肿瘤分期越差,肿瘤转移、浸润程度越严重,组织内水分子扩散更易受限,则ADC值也相应减低[15]。此外,在我们的进一步分析中显示:不同分化程度、不同病理分期的子宫内膜癌患者,磁共振ADC值存在显著差异(F=16.03、23.34,均P<0.05),并且各组间的差异均具有统计学意义,ADC值与子宫内膜癌的病理特征密切相关。
综上所述,磁共振DWI参数ADC值与子宫内膜癌患者病理分期呈负相关,与组织分化程度呈正相关,ADC值能较好地反应子宫内膜癌的病理特征。可为临床早期、准确、全面地评估子宫内膜癌患者的病变情况,为子宫内膜癌患者诊疗方案的制定与预后的评估提供参考。

