壳聚糖-柠檬酸/聚丙烯酰胺双网络水凝胶的构筑与性能研究
刘瑞雪 李迎博 李义梦 周腾

摘要:以壳聚糖(CS)、柠檬酸(CA)、丙烯酰胺(AAm)为原料,采用两步法制备壳聚糖-柠檬酸/聚丙酰胺(CS\|CA/PAAm)双网络水凝胶,并对不同PAAm含量下其流变性能、力学性能、微观形貌等进行分析与表征.结果表明:当PAAm含量为34.6%时,该凝胶的储能模量最大,为50kPa,由脆性凝胶变为断裂伸长率高达110%、压缩形变能力为90%的柔韧性凝胶,且在应变为60%的条件下循环压缩3次而几乎没有滞后圈,表现出良好的流变性能和力学性能.该水凝胶具有更加致密多孔的微观结构,随着PAAm的引入(0~34.6%),水凝胶的溶胀率从644%降低到84%,溶胀平衡时间由54h缩短至25h,且溶血率均小于5%,符合国标要求,安全性良好.
Abstract:Usingchitosan(CS),citrate(CA),andacrylamide(AAm)asrawmaterials,atwo\|stepmethodwasusedtopreparethechitosan\|citrate/polyacrylamide(CS\|CA/PAAm)double\|networkhydrogel,andtherheologicalproperties,mechanicalpropertiesandmicro\|morphologyofthehydrogelwithdifferentPAAmcontentswereanalyzedandcharacterized.TheresultsshowedthatwhenthePAAmcontentwas34.6%,thestoragemodulusofthehydrogelwasupto50kPa,andthebrittlehydrogelbecameaflexiblehydrogelwithanelongationatbreakofupto110%andacompressivedeformationcapacityof90%.Andundertheconditionof60%strain,therewerealmostnohysteresisloopsaftercycliccompression3times,showinggoodrheologicalandmechanicalproperties.Thehydrogelhadamoredenseandporousmicrostructure.WiththeintroductionofPAAm(0~34.6%),theswellingrateofthehydrogelwasreducedfrom644%to84%,andtheswellingequilibriumtimewasshortenedfrom54hto25h.Thehemolysisratewaslessthan5%,whichmetthenationalstandardrequirementsandhadgoodsafety.
關键词:壳聚糖;双网络水凝胶;流变性能;力学性能;抗溶血
Keywords:chitosan;double\|networkhydrogel;rheologicalproperty;mechanicalproperty;anti\|hemolytic
0引言
水凝胶作为一种富含水且具有三维孔洞结构的聚合物软材料,具有某些与生物组织相似的性质,因此被广泛应用于生物组织工程等领域[1-2].壳聚糖(CS)是一类多糖,由β-(1-4)-2-氨基-脱氧-β-D-葡聚糖重复结构单元组成,具有亲水性、抗菌性、
无毒性和良好的生物相容性,常用于制备生物医学材料[3].CS基水凝胶作为一种潜在的仿生物材料,因其具有与生物组织相似的特性,有望应用于隐形眼镜[4]、伤口敷料[5]、组织工程[6]等领域而被广泛关注.Z.Shariatinia等[7]系统地讨论了CS基水凝胶的合成方法及其应用,特别是对CS基水凝胶在组织工程、药物缓释、伤口敷料中的应用做了详细阐述.J.Li等[8]制备了较为复杂的纳米纤维结构的CS,并使其与聚(丙烯酸-丙烯酰胺)的聚电解质链形成动态交联网络,用该方法制备的凝胶拉伸强度达120kPa.E.S.Dragan等[9]制备了一种CS/聚丙烯酰胺(PAAm)互穿网络的水凝胶,但是该水凝胶的制备过程对体系pH值和温度的要求较高.M.Zeng等[10]使用两步连续自由基聚合的方法也制备过CS/PAAm互穿网络的水凝胶,其方法是,首先将CS在60℃条件下接枝丙烯酸,发生自由基聚合反应形成第一网络,随后用第一网络浸泡丙烯酰胺(AAm)溶液,再次经自由基聚合反应形成机械性能显著提高的互穿网络水凝胶.受此启发,可采用经典的两步法[11]制备双网络水凝胶,并且设想在第一网络中采用1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐/
N-羟基丁二酰亚胺
,即EDC/NHS催化方法[12]活化体系中的羧基与氨基,进而制备生物相容性更好的双网络水凝胶.
本文拟以柠檬酸(CA)为交联剂,EDC/NHS为催化剂,于室温下制备性能可调的CS第一网络,然后用CS第一网络浸泡AAm溶液,经自由基聚合反应引入PAAm的柔性链,从而获得性能可调的双网络水凝胶CS\|CA/PAAm,并对该水凝胶的流变性能、力学性能、溶胀性能、溶血性能等进行研究,以期拓宽CS\|CA/PAAm在生物医用方面的应用范围.
1材料与方法
1.1试剂与仪器
主要试剂:CS,无水柠檬酸,NHS,EDC,过硫酸铵(APS),N,N′-亚甲基双丙烯酰胺(MBA),阿拉丁试剂上海股份有限公司产;AAm,上海麦克林生化科技有限公司产.以上试剂均为分析纯.抗凝兔血,武汉纯度生物科技有限公司产.
主要仪器:DHG-9140A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司产;DZF-6030型真空干燥箱,上海新苗医疗器械制造有限公司产;AK-1140型电子天平,梅特勒-托利多仪器有限公司产;HAKEMARSⅢ型哈克旋转流变仪,美国ThemoFisher公司产;HY型微机控制万能材料试验机,深圳三思纵横科技股份有限公司产;JSM-7001E型扫描电镜,日本JEOL公司产;DF-101S型集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司产;EFZUV-4802H型紫外可见分光光度计,尤尼科(上海)仪器有限公司产.
1.2CS\|CA/PAAm双网络水凝胶的制备
1.2.1制备方法
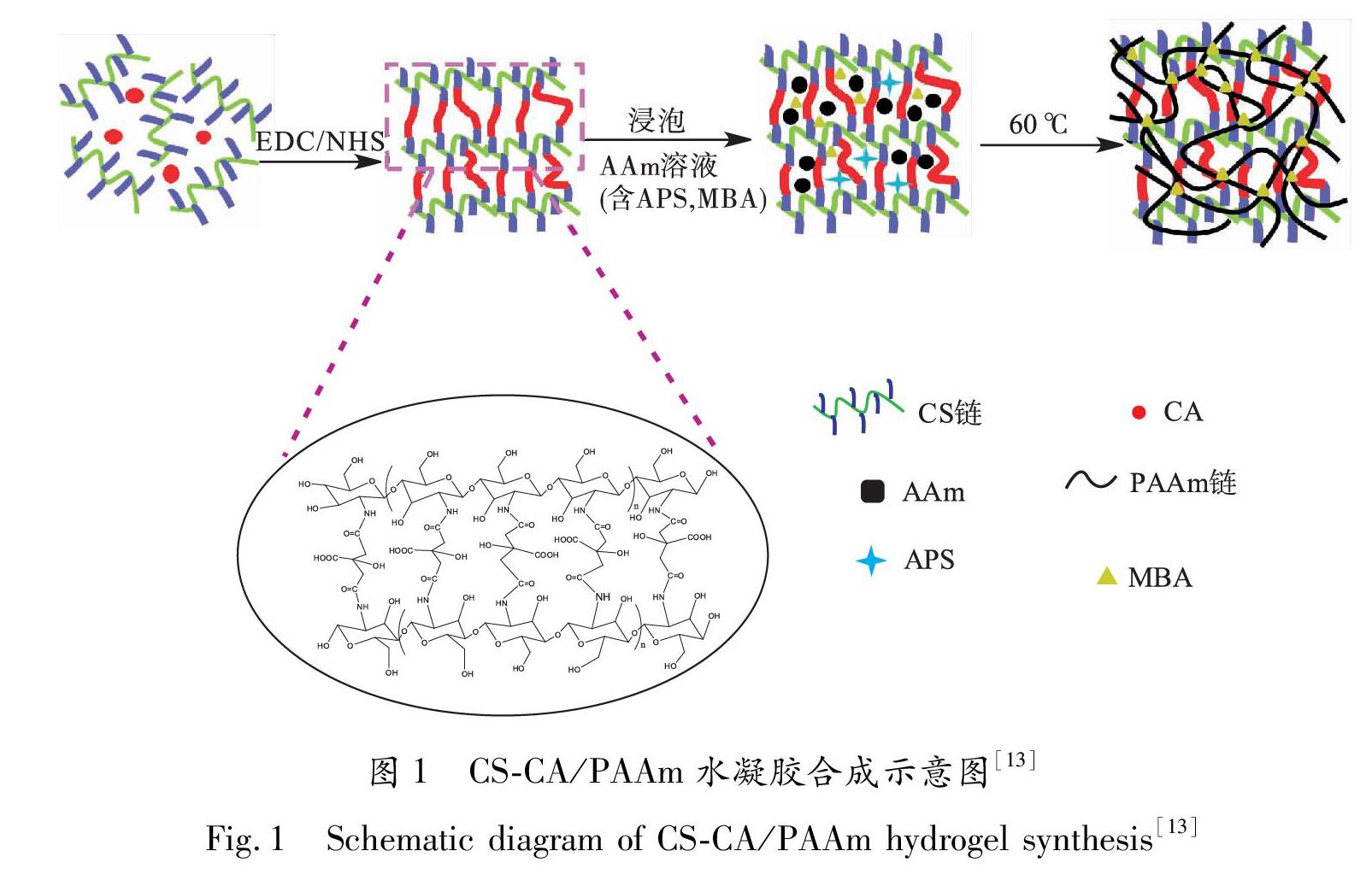
CS\|CA单网络水凝胶的制备:称取一定量的CS溶液(将CS溶于质量分数为2%的醋酸),加入一定量的CA溶液,搅拌至固体完全溶解后,加入不同质量分数的NHS溶液,混合均匀,再加入一定量的EDC溶液,快速搅拌均匀后,静置,形成CS\|CA单网络水凝胶,备用.
CS\|CA/PAAm双网络水凝胶的制备:将上述CS\|CA单网络水凝胶浸泡在配制好的不同质量分数的AAm溶液(含有APS,MBA)中,待其充分溶胀12h后,再于60℃条件下恒温反应12h,形成CS\|CA/PAAm双网络水凝胶,备用.
1.2.2催化体系用量的确定
CS与CA在EDC和NHS的催化作用下,形成单网络水凝胶.在该体系中,EDC/NHS催化CS中的氨基与柠檬酸中的羧基反应,形成酰胺键,从而形成有效交联,合成示意图见图1[13].根据文献[14]报道,当m(EDC)GA6FAm(NHS)=2GA6FA1时,具有最佳的催化效率.因此,在制备CS\|CA单网络水凝胶的过程中,以m(EDC)GA6FAm(NHS)=2GA6FA1为依据,通过改变EDC和NHS的用量,得到不同催化剂用量的CS\|CA单网络水凝胶,分别测定其储能模量,即可确定最优的EDC用量.
1.2.3PAAm含量的确定
本文采用浸泡法制备第二网络,而PAAm的含量对CS\|CA/PAAm双网络水凝胶的性能会产生较大影响.水凝胶中PAAm含量的测定方法如下.
1)称取两个CS\|CA单网络水凝胶样品,质量分别标记为x和x′,一个直接用于干燥,称重,记为y,凝胶中固态物质固含量e=y/x;另一个放入透析袋中用去离子水充分透析后干燥,称重,记为z,在水中非扩散性物质的固含量r=z/x′,通过探索性实验对比e值和r值,得到e>r,这可能是因为EDC/NHS在透析过程中会溶于水而导致部分流失.因此,采用r值计算水凝胶中各组分之比例更为合适.
2)另称取CS\|CA单网络水凝胶样品,质量记为x″,按照1.2.1的方法制备双网络水凝胶,称重,记为m.将获得的双网络水凝胶放入透析袋中,用去离子水充分透析后,干燥,称重,记为n,非扩散性物质在双网络水凝胶中所占比例q=n/m.
3)假定CS\|CA单网络水凝胶、CS\|CA/PAAm双网络水凝胶的干态质量为称取样品总量,则水凝胶中CS和CA的交联网络的含量为(x″×r)÷m×100%,PAAm网络的含量为[n-(x″×r)]÷m×100%.重复3次,取平均值.
1.3测试与分析方法
流变性能测试:采用旋转流变仪对水凝胶样品进行流变测试,测试温度25℃,应变的扫描范围0.1%~100%,频率1Hz;水凝胶样品直径20mm,厚度1.2mm.
力学性能测试:采用万能试验机对水凝胶样品进行力学性能测试,压缩样品直径20mm,厚度18mm,负载10kN,压缩速度2mm/min,循环压缩将样品压缩至原高的60%,重复压缩实验3次,中间无停留时间;拉伸样品长50mm,宽10mm,厚度5mm,负载1kN,拉伸速度20mm/min,每个样品进行3次平行拉伸实验,得到应力-应变曲线.
微观形貌分析:采用扫描电子显微镜对水凝胶样品的内部结构进行表征,将水凝胶样品放入加热型冷冻干燥机中冷冻干燥,去除水分后,切片,进行喷金处理,在25kV的加速电压下进行观察.
溶胀性能分析:将水凝胶进行自然干燥,待其水分全部去除后,称量其干重,然后将样品放入去离子水中,按照规定时间间隔取出称重,待其溶胀平衡后结束.
其中,SR为溶胀率,Ws为溶胀时的质量/g,Wd为干燥后的质量/g.
溶血性能分析:参照文献[15]中的溶血实验方法,取4mL新鲜抗凝兔血红细胞置于离心管中,于2000r/min条件下离心5min,取0.2mL离心后的红细胞加入到试管中,缓慢滴加10mL生理盐水,随后将0.2g水凝胶样品加入到试管中,轻微摇动,待其混匀后置于37℃恒温水浴保温并振荡60min.向另外的试管中加入10mL去离子水作为阳性对照组,加入10mL生理盐水作为阴性对照组.取出上述各试管中的溶液,于2000r/min条件下离心5min,取上清液,并通过紫外分光光度计测量545nm处的吸光度值(OD),记录实验数据.样品的溶血率HR(hemolysisrate)计算公式为
2结果与讨论
2.1CS\|CA单网络水凝胶催化剂体系用量的选择结果
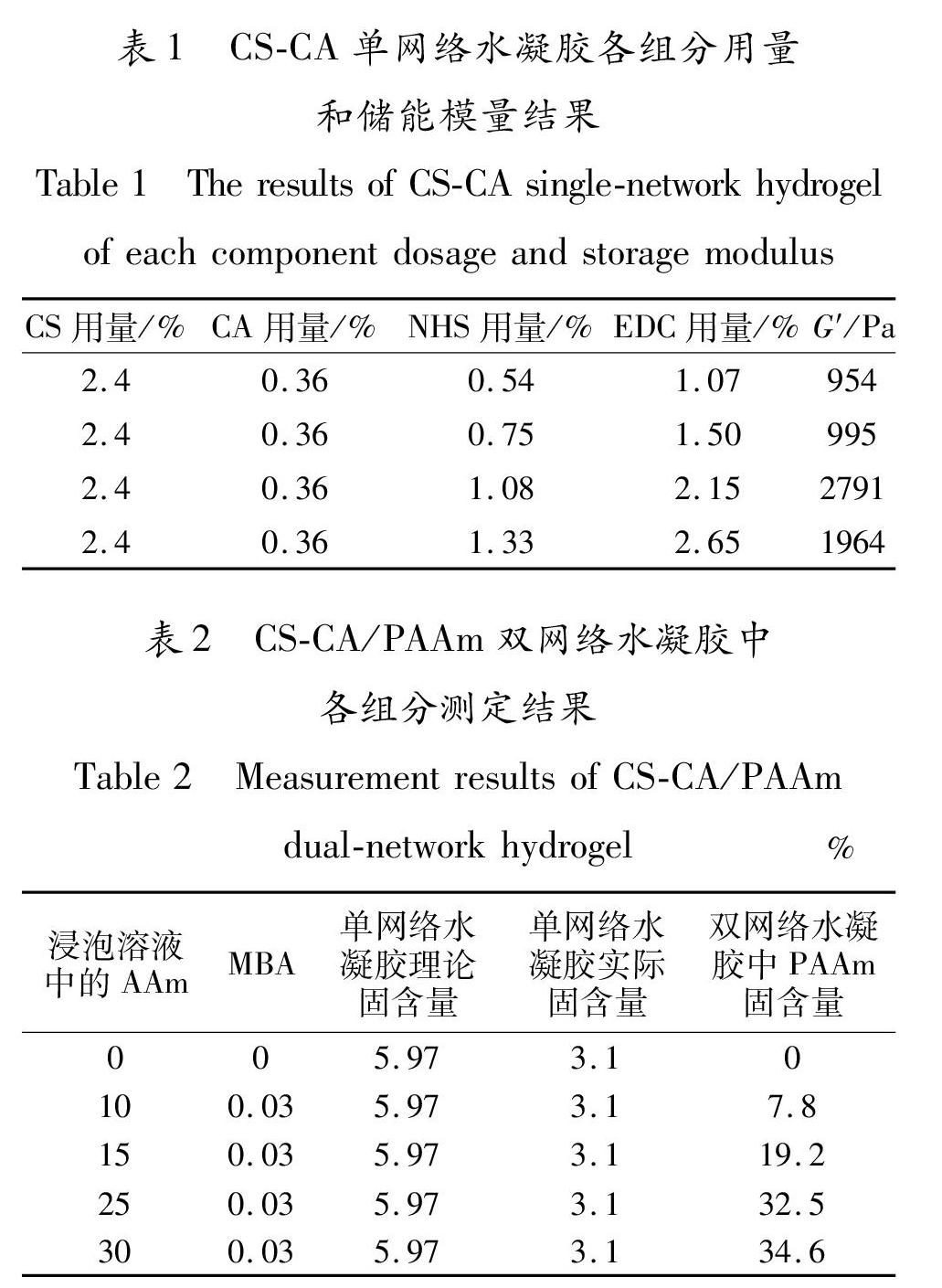
CS\|CA单网络水凝胶各组分的用量和储能模量(G′)结果见表1.由表1可知,EDC/NHS催化酰胺键形成的过程非常迅速,随着EDC/NHS用量的增加,反应速度急剧上升,超过一定比例后,即使在较低的反应温度下依然难以控制,导致形成的水凝胶网络结构不均匀.当EDC催化剂用量为2.15%时,CS\|CA单网络水凝胶的储能模量最高,为2791Pa.因此,在制备CS\|CA/PAAm双网络水凝胶时,选用EDC用量为2.15%时所得的CS\|CA单网络水凝胶为第一网络.
2.2CS\|CA/PAAm双网络水凝胶中PAAm含量测定结果
CS\|CA/PAAm双网络水凝胶中各组分测定结果见表2.由表2可知,随着浸泡溶液中
AAm含量的增加,CS\|CA/PAAm双网络水凝胶中PAAm的固含量也有所增加;當浸泡溶液中AAm含量超过25%时,CS\|CA/PAAm双网络水凝胶中PAAm的固含量变化不大.这可能是因为,此时水凝胶吸入的AAm已经基本达到饱和,因而CS\|CA/PAAm双网络水凝胶中的PAAm固含量也趋于稳定.
2.3CS\|CA/PAAm雙网络水凝胶的流变性能分析
不同PAAm含量对CS\|CA/PAAm双网络水凝胶流变性能的影响见图2.由图2可以看出,在扫描应变为0.1%~100%的测量范围内,该水凝胶的储能模量G′,损耗模量G″和代表凝胶黏弹性的参数损耗因子tanδ(tanδ=G″/G′)均随PAAm含量的增加而升高.其中,所有测试样品的tanδ值均小于1,表示在测试范围内,CS\|CA/PAAm双网络水凝胶均能有效保持其化学交联结构.对比图2中的a),b),c)3张图,所有水凝胶样品的性能曲线都较为平滑,几乎没有跳点现象,这也表明水凝胶内部结构稳定.当PAAm含量为34.6%时,CS\|CA/PAAm双网络水凝胶的储能模量最大,可达50kPa,远远大于CS\|CA单网络水凝胶的2.8kPa.
2.4CS\|CA/PAAm双网络水凝胶的力学性能分析
为了系统地评价PAAm含量对水凝胶力学性能的影响,使用表2中所得CS\|CA/PAAm双网络水凝胶进行拉伸和压缩实验,力学性能测试结果见图3.由图3可以看出,随着PAAm含量的增加,水凝胶的拉伸应变和拉伸强度均有所增加,水凝胶由原来的几乎不可拉伸到拉伸应力达270kPa,拉伸应变达110%,这说明PAAm的引入对水凝胶具有良好的增强、增韧作用.另外,体系中PAAm的含量极大地影响了水凝胶的压缩性能,其压缩应变和压缩强度均随PAAm含量的增加而增加,这与水凝胶的拉伸性能一致.当水凝胶中PAAm含量为34.6%时,在接近90%的压缩应变条件下,水凝胶仍能保持完整形态.因此,以PAAm含量为34.6%的水凝胶为例,设置压缩应变为60%,考察水凝胶的循环压缩性能.由图3c)可以看出,3次循环压缩所得峰值应力基本相同,且3次循环的滞后基本一致,几乎没有产生能量损耗,说明水凝胶具有良好的抗疲劳性[16].拉伸性能测试和压缩性能测试结果均表明,引入PAAm的确改善了第一网络的刚性,赋予凝胶韧性,并且凝胶柔性的大小与PAAm含量有关.
2.5CS\|CA/PAAm双网络水凝胶的微观形貌分析
图4为不同PAAm含量的CS\|CA/PAAm双网络水凝胶的SEM图.由图4可以看出,当PAAm含量为0%时,水凝胶孔洞较大,略微稀疏,孔径在50μm左右;当PAAm含量为7.8%时,其孔洞大小与单网络凝胶十分相似,但是大孔洞周围开始出现较为致密的小孔洞;当PAAm含量增加到34.6%时,水凝胶内部孔洞更加均匀、致密,孔洞较小,孔径约5μm.PAAm的引入对水凝胶内部结构有较大影响,使水凝胶结构更为紧密.另外,这种致密的三维网状结构使双网络水凝胶可以承受比单网络水凝胶更强的力,同时,均匀致密的网络也有利于水凝胶在组织工程的应用中提供适宜周围细胞生长的湿润环境,进而有利于水凝胶包载并释放药物[17].从微观结构的角度也说明,PAAm的引入达到了提升CS水凝胶性能的目的.
2.6CS\|CA/PAAm双网络水凝胶的溶胀性能分析
表3为不同PAAm含量的CS\|CA/PAAm双网络水凝胶的溶胀率与溶胀平衡时间表.由表3可知,随着PAAm的引入,凝胶溶胀率急剧降低,从644%降低到84%,溶胀平衡时间也由54h缩短至25h.这可能是因为随着PAAm的引入,水凝胶的固含量有所增加,从而使凝胶内部结构更加紧密;另一方面,可能是因为体系中的羧基与氨基发生了更为紧密的离子键和,从而导致双网络水凝胶的溶胀率与溶胀平衡时间远远小于单网络水凝胶[12].但是,双网络水凝胶的溶胀率与溶胀平衡时间几乎不随PAAm含量的变化而变化,其相关溶胀机理需要进一步探讨.
2.7CS\|CA/PAAm双网络水凝胶的溶血性能分析
不同PAAm含量的CS\|CA/PAAm双网络水凝胶的溶血率如图5所示.由图5可以看出,水凝胶的溶血率均低于5%,符合文献[18]中生物材料溶血率小于5%的国际标准.这说明CS\|CA/PAAm双网络水凝胶几乎不引起体外溶血反应,基本可保持血液中红细胞的完整性,具有良好的血液相容性.在本文研究范围内,溶血率随着PAAm含量的增加而增加,但仍然在安全范围之内,可认为本材料在该范围内不会发生急性溶血,无体外溶血反应,安全性良好.
3结论
本文以CS,CA,AAm为原料,采用两步法制备了性能良好的CS\|CA/PAAm双网络水凝胶,并对不同PAAm含量水凝胶的流变性能、力学性能、微观形貌等进行了研究.结果表明,当PAAm含量为34.6%时,储能模量从原来单网络水凝胶的2.8kPa增加到50kPa,由原来的脆性凝胶变为断裂伸长率高达110%和压缩形变能力为90%的柔韧性凝胶,且具有良好的压缩性能,在60%的应变下循环压缩3次,几乎没有滞后圈.此外,该水凝胶的内部孔洞更加均匀、致密,孔径约为5μm,由于具有更加致密多孔的微观结构,随着PAAm的引入(含量为0~34.6%),其溶胀率从644%降低到84%,溶胀平衡时间由54h缩短至25h,且溶血率均小于5%,良好的抗溶血性质没有改变,为该水凝胶在软骨修复、伤口敷料等生物医学领域的应用提供了可能.
参考文献:
[1]OSADAY,GONGJP.Softandwetmaterials:Polymergels[J].AdvancedMaterials,1998,10(11):827.
[2]ZHANGYS,KHADEMHOSSEINIA.Advancesinengineeringhydrogels[J].Science,2017,356(6337):eaaf3627.
[3]DUTTAPK,DUTTAJ,TRIPATHIVS.Chitinandchitosan:Chemistry,propertiesandapplications[J].JournalofScientific&IndustrialResearch,2004,63(1):20.
[4]鲁红,崔英德,黎新明,等.丙烯酰胺在水凝胶角膜接触镜材料制备中的应用研究[J].化学推进剂与高分子材料,2007,5(3):33.
[5]ISHIHARAM,OBARAK,NAKAMURAS,etal.Chitosanhydrogelasadrugdeliverycarriertocontrolangiogenesis[J].JournalofArtificialOrgans,2006,9(1):8.
[6]WANGQ,CHENS,CHEND.Preparationandcharacterizationofchitosanbasedinjectablehydrogelsenhancedbychitinnano\|whiskers[J].JournaloftheMechanicalBehaviorofBiomedicalMaterials,2017(65):466.
[7]SHARIATINIAZ,JALALIAM.Chitosan\|basedhydrogels:Preparation,propertiesandapplications[J].Internationaljournalofbiologicalmacromolecules,2018,115:194.
[8]LIJ,SUZ,MAX,etal.Insitupolymerizationinducedsupramolecularhydrogelsofchitosanandpoly(acrylicacid\|acrylamide)withhightoughness[J].MaterialsChemistryFrontiers,2017,1(2):310.
[9]DRAGANES,PERJUMM,DINUMV.PreparationandcharacterizationofIPNcompositehydrogelsbasedonpolyacrylamideandchitosanandtheirinteractionwithionicdyes[J].CarbohydratePolymers,2012,88(1):270.
[10]ZENGM,FENGZ,HUANGY,etal.Chemicalstructureandremarkablyenhancedmechanicalpropertiesofchitosan\|graft\|poly(acrylicacid)/polyacrylamidedouble\|networkhydrogels[J].PolymerBulletin,2016,74(1):1.
[11]GONGJP.Materialsbothtoughandsoft[J].Science,2014,344(6180):161.
[12]田廷璀,李露,解从霞,等.壳聚糖透明质酸复合水凝胶的制备及性能[J].高分子材料科学与工程,2017(8):134.
[13]GOODARZIH,JADIDIK,POURMOTABEDS,etal.Preparationandinvitrocharacterizationofcross\|linkedcollagen\|gelatinhydrogelusingEDC/NHSforcornealtissueengineeringapplications[J].InternationalJournalofBiologicalMacromolecules,2019,126:620.
[14]NAMK,KIMURAT,KISHIDAA.ControllingcouplingreactionofEDCandNHSforpreparationofcollagengelsusingethanol/waterco\|solvents[J].MacromolecularBioscience,2008,8(1):32.
[15]劉玲秀,胡帼颖,刘欣,等.温敏型可注射水凝胶的制备研究[J].中国生物医学工程学报,2010,29(6):901.
[16]HEQ,HUANGY,WANGS.Hofmeistereffect\|assistedonestepfabricationofductileandstronggelatinhydrogels[J].AdvancedFunctionalMaterials,2018,28(5):1705059.
[17]ANDERSENT,MELVIKJE,GASEREDO,etal.Ionicallygelledalginatefoams:Physicalpropertiescontrolledbyoperationalandmacromolecularparameters[J].Biomacromolecules,2012,13(11):3703.
[18]LICP,MUCD,LINW,etal.Gelatineffectsonthephysicochemicalandhemocompatiblepropertiesofgelatin/PAAm/laponitenanocompositehydrogels[J].ACSAppliedMaterials&Interfaces,2015,7(33):18732.

