银耳多糖对植物乳杆菌增殖作用的研究*
郑守晶,王玉贝,郑明锋
(1.福建农林大学 金山学院,福建 福州 350002;2.福建农林大学 食品科学学院,福建 福州 350002)
据国内外学者研究表明,银耳多糖具有提高机体免疫力、降低血糖和血脂、消炎消肿、润滑肠道、抗肿瘤及癌症等功效,且用小鼠进行毒性试验,试验表明银耳多糖对小鼠无毒性,对小鼠的生理功能均无毒副作用[3]。由此可见,银耳多糖安全性高、生理活性好。
近年来,随着科技及经济的发展,人们生活在一个快节奏的环境中,人类的亚健康问题也变得屡见不鲜,特别是胃肠道健康问题。因此,我们不断研究及生产保护胃肠道的食品、保健品或药物,如益生菌饮料等[4]。益生菌主要有3种即乳酸菌、芽孢杆菌和酵母菌[5],而乳酸菌是我国最早公布,功效较好且应用广[5]的菌种,也是作为添加在保护胃肠道食品和保健品中最常用的菌种之一[6]。
应用于人体的乳杆菌主要有植物乳杆菌、罗伊氏乳杆菌、嗜酸乳杆菌等[7]。植物乳杆菌,是重要的益生菌之一[8],是乳酸菌的一种,菌种呈直或弯的杆状,单个、成对或成链状,兼性厌氧或厌氧,是一种无芽孢的革兰氏阳性菌[9]。植物乳杆菌的生理功能丰富[10],目前逐渐被人们认识和了解,并在食品发酵、乳制品工业和功能性食品得到广泛应用[11]。
银耳多糖对乳杆菌的益生作用虽有报道,但报道仍较少。银耳多糖和植物乳杆菌都对胃肠道有一定保健作用,而银耳多糖对植物乳杆菌的益生作用还未有过研究。因此本课题分别以葡萄糖、银耳多糖为唯一碳源,测定植物乳杆菌在葡萄糖和银耳多糖为唯一碳源培养下的生长曲线、电导率、细胞表面完整性及活菌数,探究银耳多糖对植物乳杆菌的增殖效应,期望为银耳多糖在植物乳杆菌的增殖应用提供一定的理论依据,为研制具有较高保健功能和市场潜力的维护胃肠道健康功能食品提供理论基础,有利于提升银耳及银耳多糖的附加值、增加经济效益及社会效益。
1 试验材料
1.1 试验菌种与材料
植物乳杆菌,购买于西安千叶草生物科技有限公司;
银耳多糖,由福建农大食品安全科技有限公司提供。
1.2 试验原料
试验用MRS液体培养基:MRS培养基中,将浓度为20 g/L(2%)的葡萄糖分别依次换成0.20%、0.40%、0.60%、0.80%、1.0%的银耳多糖,其他成分不变,121 ℃条件下灭菌20 min。
试验用MRS固体培养基:在试验用液体培养基调节pH后加入琼脂粉18 g,加热煮沸,灭菌条件同上。
2 试验方法
2.1 菌种的分离纯化与活化
2.1.1 植物乳杆菌纯化培养
洁净工作台无菌操作中,挑取穿刺植物乳杆菌一环,接种到装有50 mL无菌MRS液体培养基的锥形瓶中,将接种好的锥形瓶及厌氧产气袋同时放入立式厌氧培养袋中,密封培养袋,在37 ℃恒温培养箱中培养12~48 h。将培养好稀释后的1 mL培养液进行平板涂布,待平板凝固后,将其与厌氧产气袋放入圆底立式厌氧培养袋中,置于37 ℃恒温培养箱倒置培养36 h[5]。培养结束之后,选取长势较好的单菌落进行纯化培养。再将纯化后的菌悬液与灭菌后的50%甘油(菌悬液∶50%甘油=1∶1)混合后保存到菌种保藏管中,-20 ℃条件下保存。
2.1.2 菌种的活化
取纯化培养后的植物乳杆菌接种至MRS液体培养基的锥形瓶,置于厌氧袋中,在37 ℃条件下恒温培养箱培养约12~48 h。
2.2 植物乳杆菌生长曲线的测定
使用比色管浊度法[5,12]进行植物乳杆菌生长曲线测定。取2.1.2活化之后的植物乳杆菌,以5%的接种量分别转接至银耳多糖为唯一碳源的不同银耳多糖浓度的MRS培养基中,银耳多糖的含量分别为0.20%、0.40%、0.60%、0.80%、1.00%。接种后,在37 ℃恒温培养箱中培养,每4 h取5 mL发酵液,测定发酵液的OD600值。绘制植物乳杆菌的生长曲线,观察植物乳杆菌利用不同浓度银耳多糖的生长状况。
2.3 植物乳杆菌发酵液电导率的测定
电导率是生态学中以数字表示溶液传导电流的能力,是该种溶液离子含量的表现[13]。本试验中,将葡萄糖为唯一碳源进行培养的植物乳杆菌发酵液作为空白对照组,以不同浓度的银耳多糖为唯一碳源培养的植物乳杆菌发酵液作为试验组,利用测量植物乳杆菌发酵液的电导率,来观察银耳多糖培养的植物乳杆菌的细胞完整性是否遭到破坏。
以5%的接种量取2.1.2活化后的植物乳杆菌培养液分别接种到以葡萄糖和不同浓度的银耳多糖作为单一碳源的MRS培养基中,在37 ℃恒温培养箱中培养至对数期。采用电导率仪测定分别测定不同碳源的植物乳杆菌发酵液的电导率。通过观察植物乳杆菌在利用葡萄糖以及不同浓度银耳多糖作为单一碳源的MRS培养基后的电导率的不同,来判断植物乳杆菌利用不同碳源后的细胞完整性。
2.4 植物乳杆菌活菌数的测定
以5%的接种量取2.1.2活化之后的植物乳杆菌培养液分别接种至含有0.20%、0.40%、0.60%、0.80%、1.00%的银耳多糖作为单一碳源MRS培养基上培养48 h。将培养后的植物乳杆菌发酵液用灭菌的生理盐水进行梯度稀释,分别为10-1、10-2、10-3、10-4、10-5、10-6、10-7的7个梯度,取后3个梯度,采用平板倾注法制备不同浓度的银耳多糖作为单一碳源的MRS培养基平板,37 ℃培养72 h后统计菌落总数,测定植物乳杆菌活菌数。
2.5 植物乳杆菌细胞结构的观察
分别以5%的接种量取2.1.2活化之后植物乳杆菌培养液,接种到以葡萄糖和不同浓度银耳多糖作为单一碳源MRS液体培养基,在37 ℃恒温培养箱中培养24 h。取培养后发酵液,8600 r/min离心后,收集菌体,用普通制片法(涂片→干燥→固定→石炭酸复红液染色→水洗→干燥),制片后用光学显微镜进行菌体利用不同葡萄糖和不同浓度多糖后表面形态差异的观察。
2.6 数据处理与分析
本试验所得的数据采用DPS软件进行试验统计。植物乳杆菌的生长曲线采用多因素无重复试验统计进行方差分析处理,植物乳杆菌的电导率及活菌数采用单因素试验统计进行方差分析处理,方差分析处理后采用Duncan新复极差法进行比较。
3 结果与分析
3.1 银耳多糖对植物乳杆菌生长的影响
据前人研究发现,发酵液的吸光度值(OD值大小)能体现发酵液中的菌体含量高低,待测悬液中的菌体数目越多,菌体浓度越大,菌悬液的吸光度值就会越大,测定发酵液OD值时,可见光分光光度计波长通常设置为600 nm[5]。因此,本试验中植物乳杆菌在600 nm处的OD值变化可间接反映出随着培养时间的延长,在不同浓度的银耳多糖培养条件下植物乳杆菌发酵液的含菌量的变化,即生长状况。不同浓度的银耳多糖为碳源随着培养时间的变化对植物乳杆菌的生长曲线影响见图1。
由图1可知,活化的植物乳杆菌转接至不同浓度的银耳多糖MRS培养基中的生长比较缓慢。在转接后4~8 h内,植物乳杆菌的生长比较快速,其中利用0.20%和0.40%的银耳多糖的菌体量较高于利用0.60%、0.80%和1.00%的银耳多糖;8~16 h内,植物乳杆菌的生长仍呈上升趋势,但0.60%、0.80%和1.00%的银耳多糖浓度下,增殖速度较4~8 h内缓慢。因此,考虑植物乳杆菌生长受银耳多糖浓度及培养时间的影响,采用DPS中二因素无重复试验统计进行方差分析及用Duncan新复极差法进行多重比较。方差分析表及多重比较表分别如表1、表2和表3所示。
通过表1方差分析可知,植物乳杆菌在银耳多糖浓度间和培养时间间的生长情况差异极显著;由表2多重比较后可得,随着培养时间的延长,在5%显著水平和1%显著水平下,植物乳杆菌在0.20%、0.40%和其他浓度下的银耳多糖中均有差异,且根据图1,可以观察出植物乳杆菌在0.20%的银耳多糖生长速度最快,发酵液含菌量最多,所以选择银耳多糖浓度为0.20%。

表1 植物乳杆菌生长曲线方差分析表

表2 银耳多糖浓度间的多重比较(Duncan多重比较)
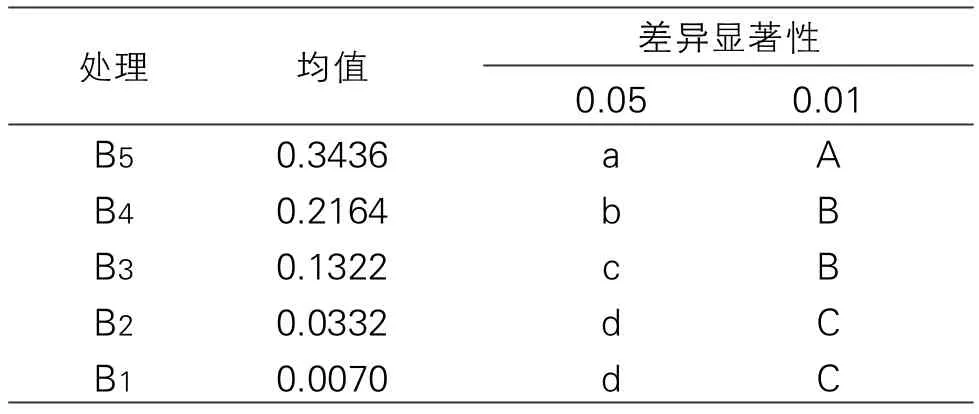
表3 培养时间间的多重比较(Duncan多重比较)
由表3多重比较后可得,随着银耳多糖浓度的增加,在5%和1%显著性水平下每隔4h植物乳杆菌生长情况均有差异,且由图1可知,16 h后植物乳杆菌在0.20%银耳多糖浓度下的生长仍处于对数上升趋势。因此,选择0.20%的银耳多糖和0.20%的葡萄糖为唯一碳源进行对比,每隔4 h测定一次OD值来观察植物乳杆菌的后续生长情况,生长曲线如图2所示。
如图2所示,转接后4 h内,植物乳杆菌长势较慢。在转接4~16 h内,利用葡萄糖的植物乳杆菌开始快速生长,菌体浓度也较利用银耳多糖的高,利用银耳多糖的植物乳杆菌则较利用葡萄糖的生长趋势缓慢。转接16 h后,利用葡萄糖的植物乳杆菌生基本上不再增长,且菌体浓度趋于平稳,进入稳定期的菌液OD600 nm为2.57;利用银耳多糖的植物乳杆菌呈快速增长趋势,菌体浓度也不断升高。转接28 h后,利用银耳多糖的菌体浓度已明显高于利用葡萄糖的菌体浓度,且到36 h后,利用银耳多糖的植物乳杆菌才基本上不再增殖并开始趋于稳定,稳定期的OD 600 nm为3.95。因此,银耳多糖相对于葡萄糖能够提高植物乳杆菌的体量,说明银耳多糖对植物乳杆菌的增殖起到促进作用。
3.2 银耳多糖对植物乳杆菌发酵液电导率的影响
植物乳杆菌利用不同碳源对其发酵液电导率的影响如表4所示,可知植物乳杆菌利用各不同浓度的银耳多糖和葡萄糖为碳源进行增殖后,发酵液电导率几乎相同。对表4中的数据进行方差分析,结果如表5所示,表明植物乳杆菌利用葡萄糖和不同浓度银耳多糖作为碳源后,其发酵液电导率无显著差异(p>0.05)。由此可知植物乳杆菌在利用葡萄糖和银耳多糖后细胞的完整性没有发生变化,因此银耳多糖可以作为植物乳杆菌的碳源。

表4 植物乳杆菌利用不同碳源后发酵液的电导率
3.3 不同银耳多糖浓度下的植物乳杆菌活菌数
植物乳杆菌在不同浓度的银耳多糖下活菌数量如表8所示。不同银耳多糖浓度间菌落总数的方差分析如表7所示,可得植物乳杆菌利用不同浓度的银耳多糖的菌落总数差异极显著(p<0.01);银耳多糖浓度间菌落总数的多重比较如表8所示,在5%和1%显著水平下,植物乳杆菌利用0.20%的银耳多糖与0.40%、0.60%、0.80%和1.00%的活菌数均存在显著差异,且可以得出植物乳杆菌利用0.20%银耳多糖的活菌数最多。
3.4 银耳多糖对植物乳杆菌细胞形态的影响
如图3为光学显微镜观察到的植物乳杆菌利用不同浓度的银耳多糖和葡萄糖为唯一碳源进行培养的菌体形态图,可以观察到植物乳杆菌利用不同浓度的银耳多糖和葡萄糖的菌体表面形态几乎没有区别,说明银耳多糖对植物乳杆菌的菌体无毒害作用,可作为植物乳杆菌的益生元。

表5 植物乳杆菌利用不同碳源后发酵液电导率的方差分析表

表6 植物乳杆菌利用不同银耳多糖浓度的菌落总数统计表

表8 银耳多糖浓度间菌落总数的多重比较(Duncan多重比较)

表7 不同银耳多糖浓度间菌落总数的方差分析表
4 结论
通过对植物乳杆菌生长曲线的测定,可知植物乳杆菌利用不同浓度的银耳多糖的菌体含量有显著差异,其中利用0.20%银耳多糖的生长速度比利用其它浓度快,菌体量也较高。植物乳杆菌利用相同浓度的银耳多糖和葡萄糖为唯一碳源对比下,在转接16 h内,利用葡萄糖的植物乳杆菌开始快速生长,菌体浓度也较利用银耳多糖的高,利用银耳多糖的植物乳杆菌则较利用葡萄糖的生长趋势缓慢。转接16 h后,利用葡萄糖的植物乳杆菌生基本上不再增长,且菌体的浓度基本不变,已经进入稳定期的OD 600 nm为2.57;利用银耳多糖的植物乳杆菌呈快速增长趋势,菌体浓度也不断提高。接种28 h后,利用银耳多糖的植物乳杆菌的菌体浓度已高于利用葡萄糖的菌体浓度,且到36 h后,利用银耳多糖的植物乳杆菌才基本上不再增殖并开始趋于稳定,稳定期的OD 600 nm为3.951。因此,银耳多糖能促进植物乳杆菌的增殖。
通过测定植物乳杆菌利用银耳多糖和葡萄糖的发酵液电导率,发现植物乳杆菌在利用两种不同碳源的情况下,电导率几乎不变,且不同浓度的同一碳源(银耳多糖)中的电导率不存在显著差异,说明植物乳杆菌在利用银耳多糖后,其细胞完整性并未遭到破坏,因此银耳多糖对植物乳杆菌无损害作用。
通过统计植物乳杆菌利用不同浓度的银耳多糖的活菌数,可知植物乳杆菌在0.20%银耳多糖培养中,活菌数最多,且较其他浓度差异较显著。通过光学显微镜观察植物乳杆菌利用不同碳源后的菌体表面形态,可以发现利用不同浓度的银耳多糖后,其菌体表面形态与利用葡萄糖的并无差异,进一步证实了银耳多糖对植物乳杆菌无毒害作用,可以作为植物乳杆菌的益生元。
结合植物乳杆菌的生长曲线、电导率、活菌数统计及菌落形态变化的结果,可以得出本次试验银耳多糖可以作为植物乳杆菌的益生元,且植物乳杆菌利用银耳多糖的最适浓度为0.20%。

