牦牛、犏牛TB-RBP基因克隆及在睾丸组织中的表达
柴志欣,王 会,王吉坤,王嘉博,钟金城
(西南民族大学,青藏高原动物遗传资源保护与利用四川省、教育部重点实验室,四川 成都 610041)
牦牛(Bosgrunniens)是中亚帕米尔高原的特有家畜,是高原地区主要的畜种资源和牧业经济的重要基础。然而牦牛的生长速度慢,成熟期晚,产乳、产肉等生产性能较低。为提高牦牛的经济效益,将牦牛与普通牛进行种间杂交改良,杂种F1犏牛产肉量、产奶量均有提高,杂种优势显著。但F1公犏牛因生精机能紊乱表现为不育,而母犏牛可育,使其杂种优势的利用和牦牛优良遗传资源的研究受到限制。而犏牛雄性不育的最终表现是精子发生受阻[1-3]。犏牛雄性不育是物种间生殖隔离的表现之一,其形成机制应与精子发生、物种生殖隔离和分化相关,而基因或基因网络结构的差异导致基因功能的异常应该是产生这一生殖隔离的主要原因。
睾丸、脑RNA结合蛋白(Testis brain RNA-binding protein,TB-RBP)是一类特异性靶向结合蛋白,可与睾丸、脑组织中的鱼精蛋白1(Prm1)、鱼精蛋白2(Prm2)、激酶A 锚定蛋白4等靶基因mRNA特异结合。在精子发育过程中,TB-RBP主要对减数分裂后部分靶基因进行转录后调控,是调节精子活力,维持精子正常形态的主要转录因子之一。TB-RBP可与mRNA非翻译区保守元件特异性结合来保持mRNA稳定,且在多数靶基因mRNA-3′(UTR)包含TB-RBP的保守结合序列。精子发生是一个复杂的调控过程,基因的表达水平、基因的网络互作对精子发育成形,形成成熟、正常有生育能力的精子具有重要作用。而减数分裂阶段是精子发生的重要过程,靶基因Akap4可引导蛋白激酶A与磷酸化位点靶向结合,同时参与由cAMP介导的信号传导途径,调节精子活力,该基因作为精子纤维鞘组成部分维持其固有形态[4-5]。
自20世纪50年代以来,国内外学者进行了许多研究,利用现代生物技术方法探讨牦牛与普通牛远缘杂交后代雄性不育与渐进可育的遗传机理及其规律,对最终解决种间杂交雄性不育这一牦牛改良的关键技术难题具有十分重要的意义。本研究通过对精子发生过程关键基因TB-RBP进行克隆,分析其在牦牛和犏牛睾丸组织中的表达情况,进一步从分子水平开展犏牛雄性不育的相关研究奠定基础并提供理论依据。
1 材料和方法
1.1 主要试剂
TRIzol RNA提取试剂盒(Thermo)、反转录试剂盒(Thermo)、pMD19-T载体(TaKaRa);DH5α大肠杆菌感受态细胞(TIANGEN),质粒DNA提取试剂盒、DEPC 原液及Taq Master Mix(2×)(Thermo),其他常用化学试剂均为国产分析纯。
1.2 样品采集及总RNA提取
在青海省大通种牛场选取6头健康犏牛(1岁1头,2岁3头,3岁2头),在四川省九龙县选取3头健康成年牦牛(7岁);去势后采集睾丸组织,DEPC水冲洗后迅速放入液氮保存备用。
采用TRIzol法提取牦牛和犏牛睾丸组织总RNA,置-80 ℃保存或立即进行反转录,用紫外分光光度计和全自动电泳检测RNA浓度和纯度。
1.3 cDNA第一链的合成
以提取睾丸组织总RNA为模板,采用RNA PCR Kit9(AMV)Ver.3.0试剂盒,Oligo-dT为引物,合成cDNA第一条链。反应条件:45 ℃,45 min;99 ℃,5 min;5 ℃保存。反应体系为:MgCl22 μL,10×RT Buffer,dNTP Mixture 1 μL,AMV Reverse Transcriptase 0.5 μL,OligodT-Adaptor Primer 0.5 μL,总RNA 1 μL,RNase Free ddH2O 3.75 μL。
1.4 引物设计与合成
根据文献资料及NCBI已发表TB-RBP基因(NM_001076006和XM_001250367)核苷酸序列,采用Primer 5.0 设计特异性引物,送英潍捷基(上海)生物科技有限公司合成,基因克隆及荧光定量引物序列见表1。

表1 引物序列
1.5 PCR扩增及RT-PCR反应
TB-RBP基因克隆反应体系为:MasterMix 25 μL,上下游引物(20 nmoL/μL)各1 μL,cDNA模板4 μL,加去离子水至50 μL。PCR扩增程序,具体见表2。
采用SYBR Green Ⅰ染料法在BIO-RADC10000荧光定量仪上进行。以cDNA为模板,反应采用25 μL体系:SYBR®Premix Ex Taq(2×)12.5 μL、上下游引物各0.5 μL(10 μmol/L)、cDNA 2 μL、ROX Reference Dye 0.5 μL、ddH2O 9 μL。反应程序见表2。

表2 PCR 扩增程序
1.6 质粒提取及酶切鉴定
将已提取的质粒DNA用限制性内切酶EcoRⅠ和HindⅢ进行双酶切,反应体系为:HindⅢ 1 μL,EcoRⅠ 1 μL,1×mol/L Buffer 4 μL,质粒DNA 5 μL,去离子水7 μL。37 ℃酶切1 h左右,1.5%琼脂糖凝胶电泳检验酶切结果。
2 结果与分析
2.1 RNA纯度检测
采用分光光度法测定所提总RNA,OD260/280≈2.0,并采用全自动电泳仪(BIO-RED)检测到明显的18S、28S和5S条带及波峰,且18S、28S波峰区域比值、片段区域比值、18S与28S的比较结果及总RNA区域值和浓度值,都说明RNA质量较高,满足后续试验要求,检测结果见图1。
2.2 RT-PCR扩增产物的检测
经反转录检测获得TB-RBP基因引物1扩增片段为587 bp,引物2扩增片段713 bp,条带清晰明亮,与预期片段大小一致(图2),纯化回收后,送公司测序。
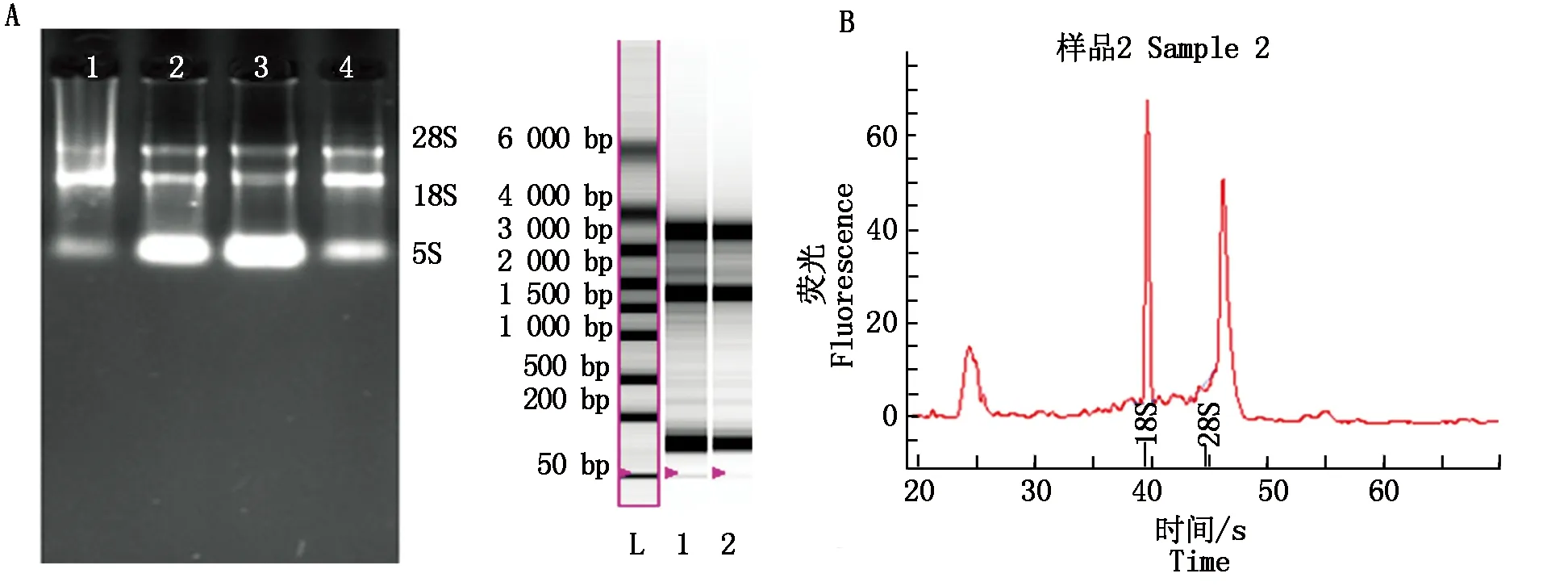
图1 总RNA电泳图
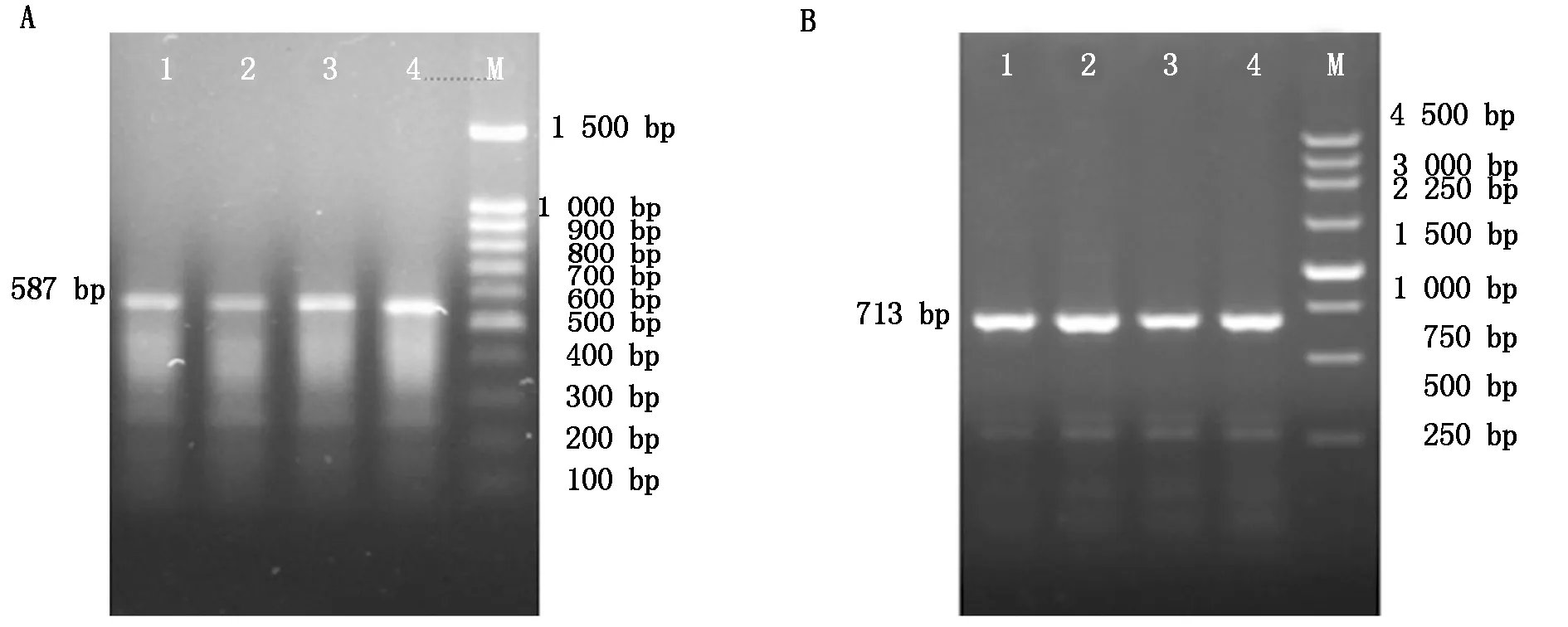
A.1引物;B.2引物。1-2.犏牛;3-4.牦牛。
2.3 重组子质粒PCR及酶切鉴定
利用蓝白斑遗传学筛选法挑取白色单一菌落,置于含Ampr/LB液体培养基培养,对重组子菌液提取质粒后进行PCR鉴定,经琼脂糖电泳检测,TB-RBP基因的质粒均扩增出目的条带(图3-A)。初步证明目的基因片段已重组到载体上。
将所提重组质粒用限制性内切酶EcoRⅠ和Hind Ⅲ进行酶切消化,经琼脂糖电泳检测显示得到2条片段,分别为2 692 bp的载体序列和目的片段(图3-B),证明目的片段已成功克隆,并且可以确定目的片段为正向插入。在图3中,1、3泳道分别为犏牛TB-RBP引物1、2质粒及酶切PCR产物,2、4泳道分别为牦牛TB-RBP引物1、2质粒及酶切PCR产物。
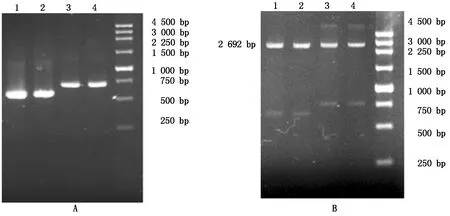
图3 质粒PCR(A)及酶切(B)鉴定图
2.4 TB-RBP基因序列分析
克隆所得牦牛(GenBank上传序列号 No.:EF432559)TB-RBP基因CDS全序列873 bp,获得犏牛(GenBank上传序列号 No.: EF432558)TB-RBP基因部分CDS区序列587 bp。犏牛同牦牛和GenBank中海福特牛(No.: BC120296)部分CDS序列进行比对(图4),结果表明:牦牛与犏牛序列相比,存在8处碱基突变,一致性为98.6%;牦牛与普通牛序列相比,共有6处发生碱基变异,一致性为98.4%;犏牛与普通牛序列相比,共有3处发生碱基变异,一致性为99.2%。
2.5 进化树分析
从NCBI数据库搜集13个物种TB-RBP基因CDS序列,利用MEGA 5.2.2软件对牦牛、黄牛、水牛等13个物种TB-RBP基因CDS区核苷酸序列构建NJ系统进化树。共聚为两大类,其中九龙牦牛与野牦牛、美洲野牛、犏牛遗传距离较近,并与普通牛聚为一类,印度水牛与其他物种聚为另一大类(图5),说明不同物种TB-RBP基因编码区序列高度保守,遗传相似性较高。
2.6 氨基酸序列理化特性预测与分析
利用ExPASy在线分析软件ProtParam程序对牦牛TB-RBP蛋白编码氨基酸的理化性质进行预测,其氨基酸组成见表3。牦牛TB-RBP基因共编码290个氨基酸,相对分子量为33.179 ku,理论等电点pI=7.72,带负电荷残基(Asp + Glu)总数为41个,正电荷残基(Arg + Lys)总数为42个,其中丝氨酸(Ser)、亮氨酸(Leu)、谷氨酸(Glu)数量较多,分别为25,24,22个。不稳定指数为45.06,表明此类蛋白为不稳定蛋白。脂肪系数为79.28,亲水性指数(GRAVY)为-5.550,应用ExPASy-ProtScale程序计算TB-RBP疏水性,蛋白质中存在4个明显的疏水区,分别是33-40位,127-145位,184-205位,271-280位,此蛋白为亲水性蛋白。而犏牛TB-RBP基因部分CDS区序列587 bp,编码193个氨基酸,相对分子量为47.521 ku,理论等电点PI=5.20,其中氨基酸组成仅包含Ala(A)34.9%,Cys(C)17.9%,Gly(G)22.8%,The(T)24.4%;不稳定指数41.44,犏牛该蛋白属于不稳定蛋白,与牦牛TB-RBP蛋白性质一致;脂肪系数34.92,GRAVY为0.814,犏牛TB-RBP属亲水性蛋白。

图4 牦牛、犏牛、普通牛TB-RBP基因核苷酸序列比较
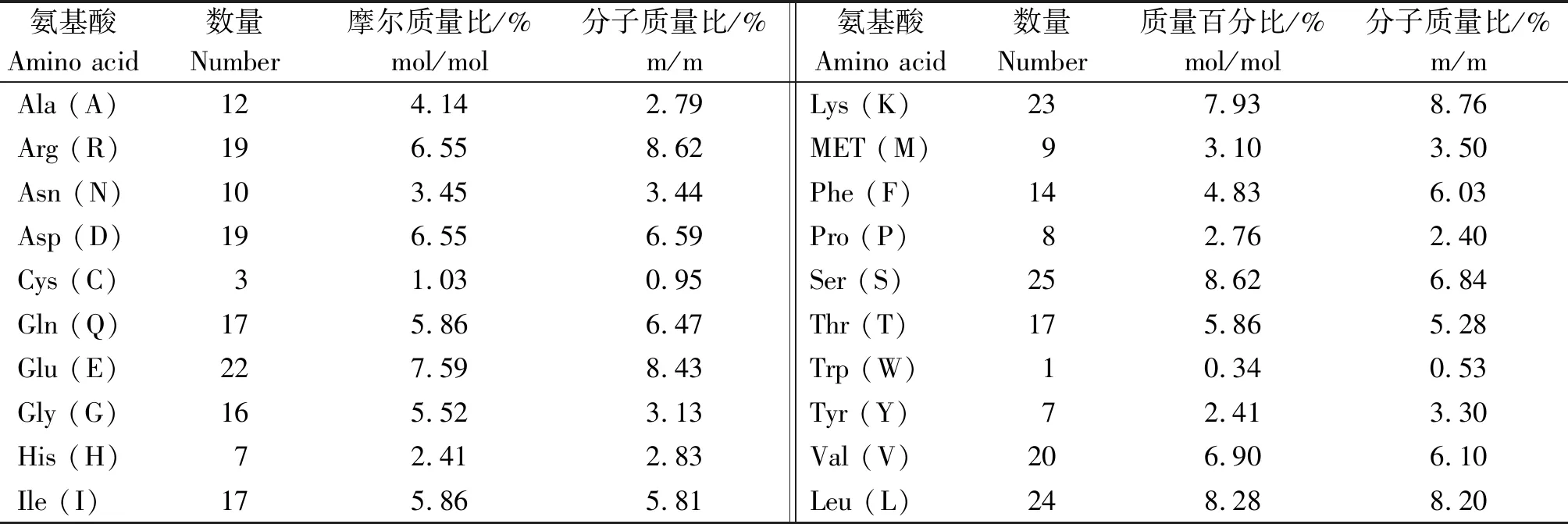
表3 牦牛TB-RBP基因cDNA推测编码蛋白质的氨基酸组成
2.7 蛋白结构与功能预测
2.7.1 蛋白质结构预测与分析 通过HNN http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl在线对TB-RBP氨基酸序列进行二级结构预测(图6)。

h.α螺旋;c.无规则卷曲;e.β折叠。
结果显示,在牦牛TB-RBP分子中,存在7个较为明显的α螺旋(Hh)富集区域,共有160处,α螺旋(Hh)含量达到55.17%;无规则卷曲(Cc)105处,占二级结构的36.21%;β折叠(Ee)25处,占二级结构的8.62%。犏牛TB-RBP蛋白α螺旋(Hh)46.11%,无规则卷曲(Cc)41.45%,α螺旋和无规则卷曲为主要组成结构。
利用SWISS-MODEL查找与TB-RBP氨基酸序列相似性较高的序列预测其蛋白三级结构,下载相应的PDB模型,利用RasMol软件对预测三级结构进行观测分析(图7)。结果表明,牦牛TB-RBP蛋白含有7个α-螺旋,为全α型,其结构为平行的α-螺旋/7螺旋束;犏牛TB-RBP蛋白包含5个α-螺旋,2个无规则卷曲,其结构为环绕结构束。
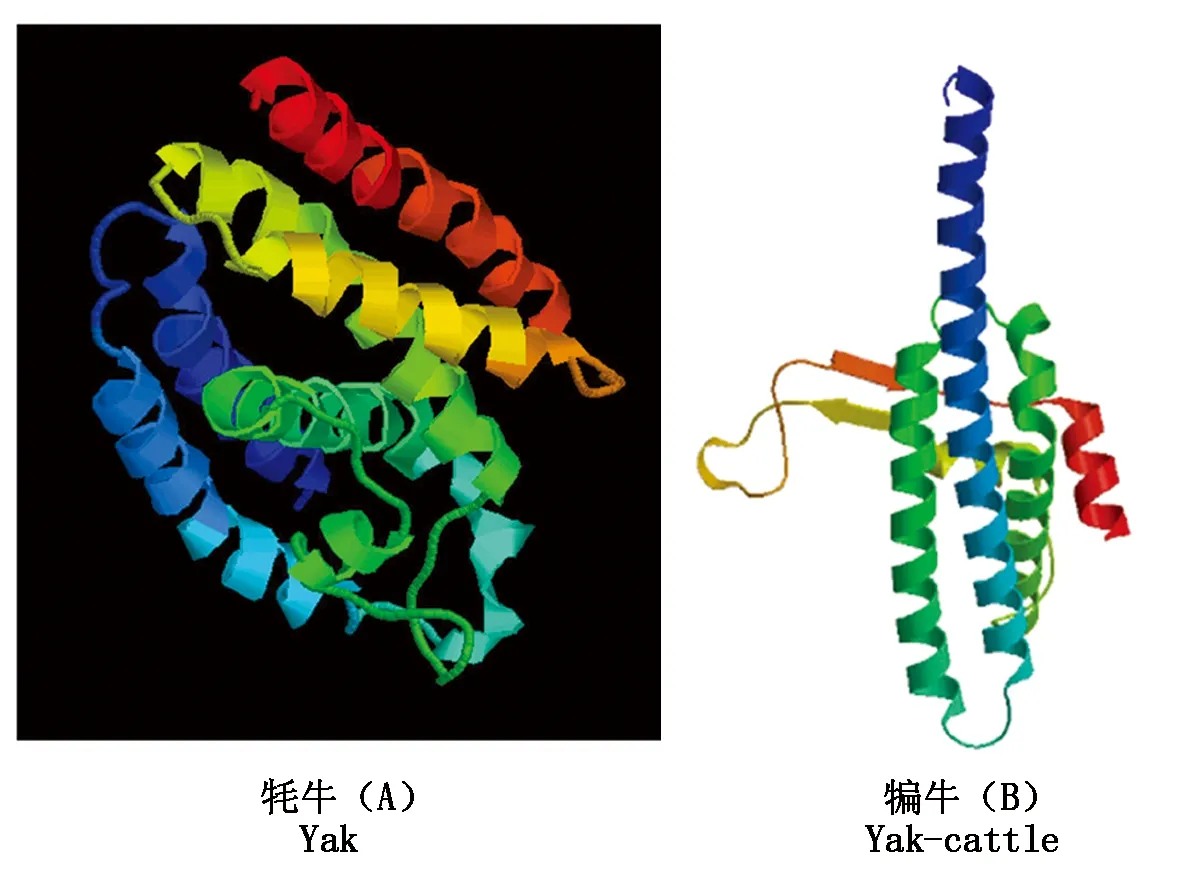
图7 牦牛和犏牛TB-RBP蛋白三级结构预测图
2.7.2 功能结构预测与分析 利用TMHMM预测发现牦牛TB-RBP无跨膜结构。用TMPRED软件分析发现牦牛TB-RBP包含2个具有较高可能性的跨膜区,但只是明显的TM片段,不存在跨膜蛋白,无跨膜结构域;犏牛该蛋白也不存在跨膜区,仅在17-33位包含一个TM跨膜螺旋。在线工具SignalP 4.1 Server预测TB-RBP蛋白信号肽,结果表明,TB-RBP蛋白无信号肽序列,该蛋白为非分泌型蛋白。利用NetOGlyc 1.0、NetPhos 2.0分别对TB-RBP蛋白进行糖基化位点和磷酸化位点预测,发现TB-RBP蛋白存在6个赖氨酸ε氨基糖基化位点(10,80,103,106,183,221),15个磷酸化位点,分别为10个丝氨酸位点(9,21,51,83,86,97,109,110,147,207)、3个苏氨酸位点(64,125,155)、2个酪氨酸位点(179,186)。
利用NCBI 中Conserved Domain Search Service(CD Search)预测TB-RBP蛋白保守结构域(图8)。结果表明,TB-RBP蛋白属于Translin结合蛋白家族,其中Translin(TB-RBP)及其结合蛋白TRAX是一对旁系同源保守蛋白,TRAX和Translin的寡聚蛋白复合物形成C3PO(也称RNA诱导沉默复合物RISC),Translin-Trax复合物可增强RNAi中错义链的去除和活性RISC的形成。除RNAi之外,Translin和Trax还参与多种核酸代谢途径,并涉及广泛的生物活性,包括mRNA加工、细胞生长调节、精子发生、神经元发育、基因组稳定性调节和致癌作用等。

图8 TB-RBP蛋白质的结构功能域分析结果
2.7.3 蛋白质功能分析 PSORT Ⅱ Prediction分析发现,TB-RBP基因编码的蛋白分布于细胞核、细胞质、线粒体、分泌系统的囊泡和细胞骨架,其中在细胞核中分布最多,达到60.9%,具有核定位信号的功能。
2.8 牦牛TB-RBP mRNA组织表达
2.8.1 标准曲线及线性范围 将标准品10倍梯度稀释的5个浓度(10-3~10-12)作为模板,每个浓度做至少3个重复,进行Real-time PCR反应,由扩增曲线得到Ct值,由软件拟合出标准曲线。通过SYBR GREEN 荧光定量PCR建立标准曲线和扩增曲线(图9),TB-RBP基因相关系数为0.993,说明建立的标准曲线的直线性很好。标准曲线Ct值线性图横坐标代表拷贝数,纵坐标代表循环数,TB-RBP标准曲线及其扩增曲线,在10-2~10-6范围内具有较好的线性关系,标准曲线方程为:y=-3.224x+42.160。
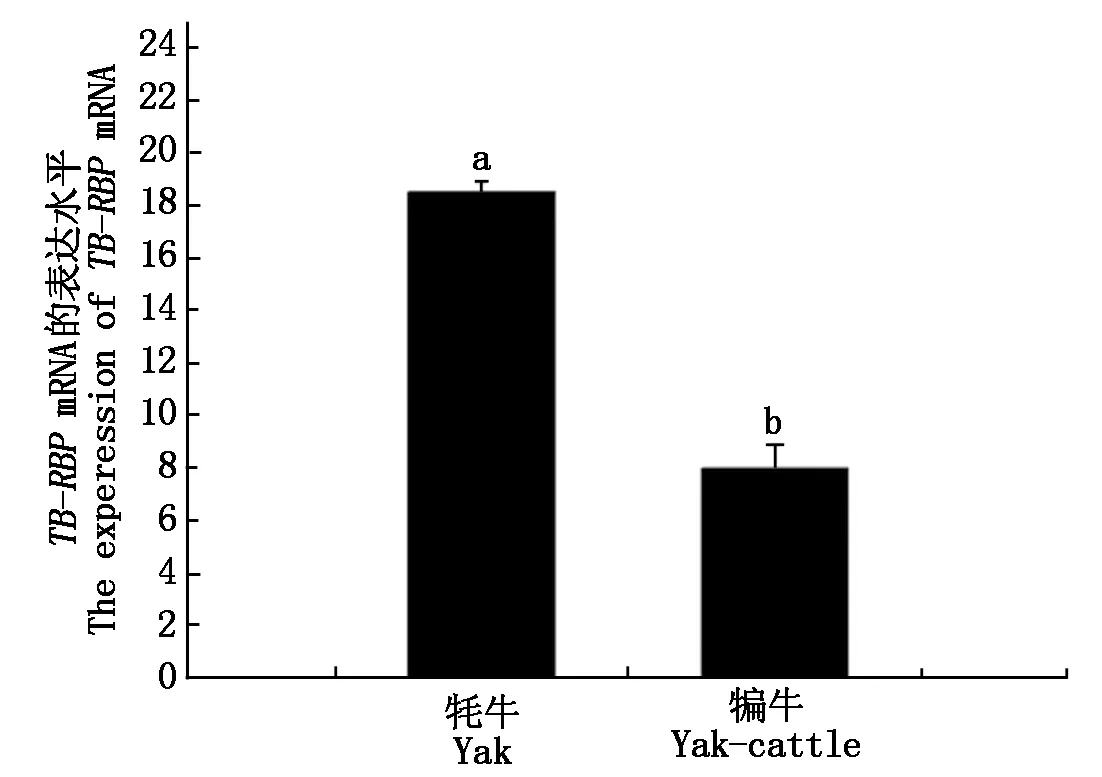
2.8.2 荧光定量RT-PCR结果 根据标准曲线和Ct值,可对每一样品初始拷贝数绝对定量。牦牛和犏牛睾丸组织每100 ng总RNA中,TB-RBP基因的拷贝数为4.95×105~7.75×108,TB-RBP基因在犏牛和牦牛的睾丸组织中均有表达;t检验表明,TB-RBP基因的表达量在牦牛与犏牛组间差异显著(0.01 Ct值与模板量拷贝数的对数值作图标准曲线(A);以模板在不同循环扩增时的荧光强度作图扩增曲线(B)。 图中标有不同字母者为差异显著(小写字母表示P<0.05)。 目前,Translin蛋白在非洲爪蟾、小鼠、果蝇、人类等物种中均有发现[6],是一种进化保守且高度同源的蛋白,而TB-RBP是在小鼠睾丸和脑组织中发现的一种translin蛋白,TB-RBP蛋白在机体中的调控作用主要通过与DNA/RNA的结合来实现。在睾丸中,TB-RBP可调控减数分裂产生的生殖细胞mRNA的表达,同时对非编码RNA转录也发挥重要作用[7]。目前,雄性生殖细胞中TB-RBP对miRNA也起到稳定作用,而其作用机制尚不清楚[8]。犏牛作为牦牛和普通牛的杂交后代,其在役用性、抗病力及适应性等方面均优于亲本个体,产肉量和产奶量较亲本牦牛高,表现出明显的杂种优势,但犏牛雄性不育和杂种优势是目前限制和影响牦牛远缘杂交改良工作深入开展的关键问题,因此如何利用现代分子技术破解动物种间杂种雄性不育机理,也成为目前生命科学领域最富有挑战意义的重大课题之一。本研究通过对与牦牛和犏牛精子发生相关基因的研究,初步验证候选基因在牦牛和犏牛睾丸组织中的表达情况。 通过对牦牛、犏牛TB-RBP基因编码蛋白理化性质分析发现,丝氨酸、亮氨酸、谷氨酸占比最大,且在15个磷酸化位点中包含10个丝氨酸位点。谷氨酸可参与动、植物及微生物代谢过程中多种重要化学反应,同时也是一种重要的鲜味剂,相关研究显示,犏牛在生长性状及屠宰性状均优于牦牛,且具有高蛋白、低脂肪等特点,氨基酸及风味物质含量丰富,杂种优势明显[9-10],这与其富含谷氨酸存在一定关联。段鹏杰[11]研究发现,阉牛肉中谷氨酸和必需氨基酸含量均显著高于对照组,说明在日粮中添加谷氨酸渣可以促进肉牛生长。而精氨酸也可在一定程度上改善家畜胴体组成及肉质性状指标,牦牛睾丸组织中丝氨酸和精氨酸含量较高,其中丝氨酸/精氨酸蛋白特异激酶2能够磷酸化富含丝氨酸和精氨酸的剪接因子,可能参与小鼠精子发育成形过程中mRNA前体分子的剪接,是维持睾丸正常发育成形所必须[12-13]。丝氨酸作为肌肉和脂肪的重要组成成分,在其代谢及生长等过程均发挥重要作用[14-15],且丝氨酸有助于机体中抗体和免疫血球素的产生,使免疫系统免受侵害维持其健康的免疫环境,本研究中牦牛和犏牛丝氨酸含量均较多,也从侧面验证了牦牛及犏牛对高原恶劣生态环境的极强适应性。TB-RBP属不稳定蛋白,作为转位蛋白参与染色体易位等生物过程,容易与特异性mRNA结合导致结构发生变化介导不同的代谢过程。本试验中,该蛋白二级结构存在多个α螺旋富集区,三级结构为平行的α-螺旋/7螺旋束,说明α螺旋富集结构对该蛋白发挥功能所必需。 TB-RBP基因的表达量牦牛显著高于犏牛(0.01 生殖隔离表现为两方面:A种和B种的杂交繁殖变成困难或者不可能,而A种个体和B种个体在其种内,则各自都能充分地进行繁殖。在任何物种改变行为或生育器官结构的突变都是可能发生的,但这种突变并不能产生有用的RI机制。造成RI的遗传改变,不仅一定要避免突变类型和原始类型之间的繁殖,还要保证突变类型的正常繁殖。要是隔离包含着杂种不活性或杂种不育性,则这些效果必须限制在杂合体方面,而纯合体不受影响。符合上述要求的突变,包括多基因突变系,染色体倍数变异、倒位、易位和细胞质与核基因系的关系等。在有性和杂交受精的物种中要由单个突变步骤建立起热核繁殖隔离机制是有很大困难的。因为突变体第一次在群体中以杂合体而出现,不能生活和不育的杂合体总被消除掉,不论其相应的纯合体可能有多好的适应性。产生隔离的突变型在起初的不利性,可因自体受精、单性生殖或无性生殖而得以减少。在成对的有性生殖和杂交受精的物种之间,RI一般是由有关物种所携带的互补基因复合体所造成的,要形成一个能够起作用的隔离机制最少的基因数是2个,杂种不活和不育性是由互补基因或由呈显性作用的遗传条件所造成的,因而在杂合体就表现出来。Dobzhansky[18]认为物种的基因型是一个适应于该物种所生活的那个生态小境的完整系统,在种间杂种的后裔中,基因的重组合可能导致了不协调基因类型的形成,这就降低了2个杂交繁殖生物种的繁殖力。 犏牛雄性不育是种间生殖隔离的一种表现,是由长期自然选择和基因突变不断积累的结果,生物体任何性状的改变均不是由单一基因位点突变决定的,而犏牛的生殖隔离也必定是多基因的产物。TB-RBP基因研究结果一定程度上支持钟金城提出的犏牛雄性不育多基因假说[19]。同时,对精子发生相关基因的克隆,有助于揭示精子发生过程中相关基因表达的表观遗传调控机制,有助于对牦牛、普通牛及其杂种犏牛在睾丸和大脑组织中的基因组、特异基因的遗传变异规律的研究,进而从基因表达水平上阐明犏牛雄性不育的机理。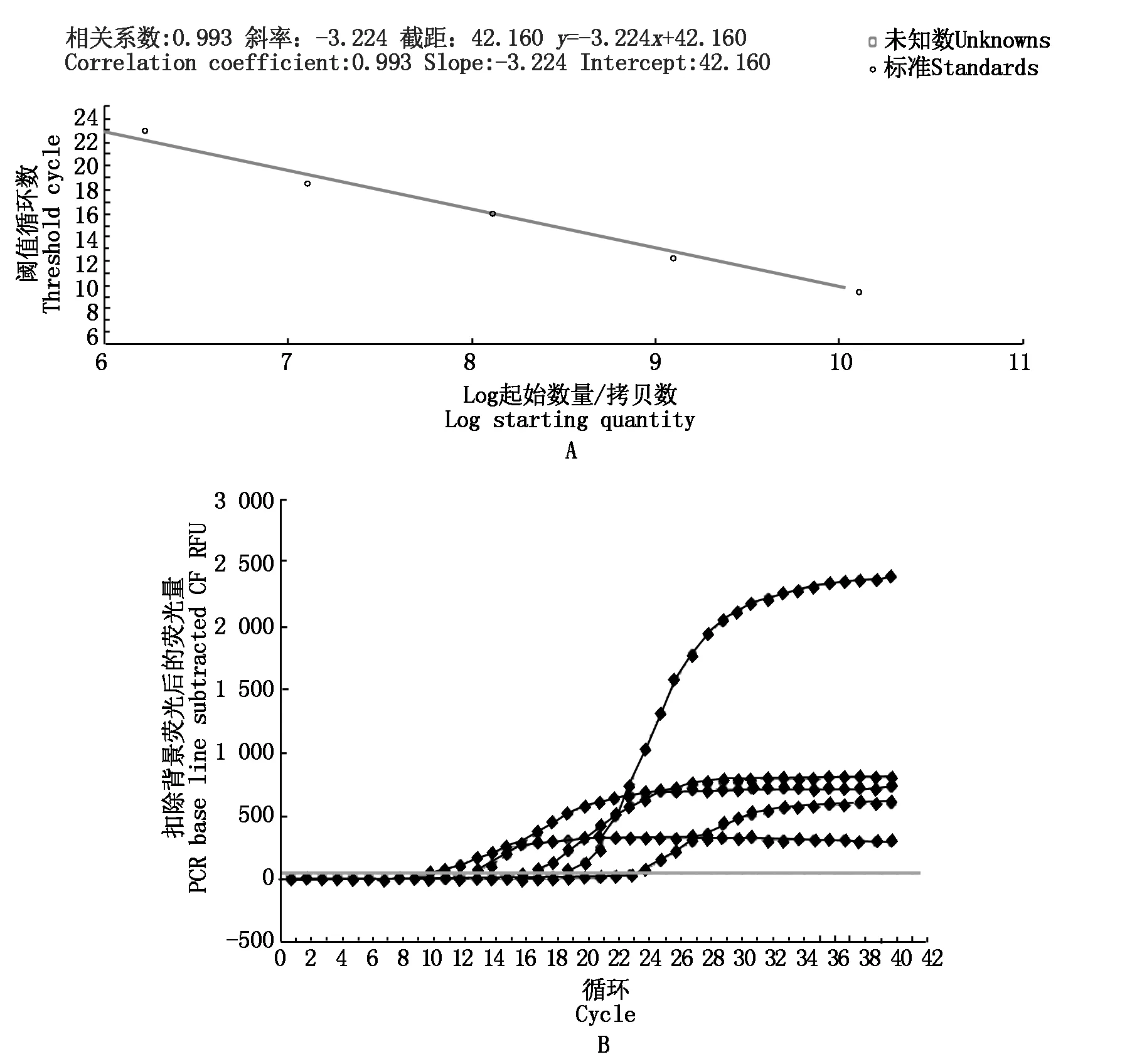
3 结论与讨论
3.1 TB-RBP基因生物学功能分析
3.2 犏牛、牦牛TB-RBP基因的表达水平
3.3 犏牛雄性不育机理

