松萝酸抗感染作用及机理研究进展
熊楠 徐剑 黄敏 高承贤
(浙江中医药大学,浙江杭州 310000)
松萝酸(usnic acid, UA)是一种具有独特二苯并呋喃骨架的次生代谢产物,常见于松萝(Usnea)、树华(Rama-lina)和石蕊(Cladonia)等属的地衣真菌中[1-2]。自1844 年被首次分离以来,UA 已成为研究最广泛的地衣代谢物。这种天然化合物表现出多样的生物和生理学活性,包括抗菌、抗病毒、促进皮肤创伤愈合、抗炎、抗肿瘤、抗氧化以及解热镇痛等一系列功效[1-3]。
随着耐药性问题的日益严重,近些年UA 在抗感染方面的应用受到越来越多的关注,相关作用机理研究也逐步深入,本研究拟对这方面的进展作一简要综述。需要指出是,UA 具有两种光学异构体,包括(+)-和(-)-UA (图1),两者均可从许多不同地衣中分离获得[3]。但是目前有关UA的生物活性研究绝大多数集中在右旋(+)-对映体,因此本综述主要围绕(+)-UA 展开。
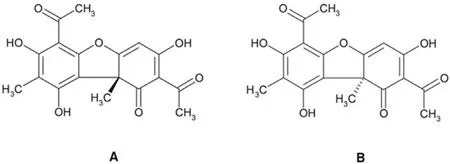
图1 (+)-(A)和(-)-(B)松萝酸
1.松萝酸的抗感染活性
1.1 抗细菌活性
UA 具有良好的抗菌生物活性,其抗菌谱以革兰氏阳性菌为主,包括葡萄球菌、链球菌、肠球菌、芽孢杆菌、痤疮丙酸杆菌、李斯特菌、产气荚膜梭菌及分支杆菌等[3]。UA 对这些微生物的最低抑菌浓度(MIC)大多为1-64μg/ml。一些革兰氏阴性菌对UA 也比较敏感[3],包括部分拟杆菌(MIC=2-8μg/ml)、普通变形杆菌(MIC=36μM)以及小肠结肠炎耶尔森菌(MIC=18μM)。值得重视的是,UA 对革兰氏阴性细菌幽门螺杆菌具有强抗菌作用(MIC50=0.064, MIC90=4μg/ml)[4]。除此之外,UA 和部分抗生素联用还具有协同抗菌效果。最近研究[5]表明,UA 和诺氟沙星联用可协同抑制临床耐药菌株耐甲氧西林金黄色葡萄球菌(MRSA)的生长。二者联用不仅诱导细菌体内产生氧化应激反应,从而损伤细胞膜,而且还干扰细菌代谢及肽聚糖和脂肪酸的生物合成;在感染金黄色葡萄球菌的小鼠模型中,联合使用UA 和诺氟沙星可显著降低细菌负荷,且不会引起任何可检测的相关毒性。
除直接抑制细菌生长外,UA 还能干扰细菌生物膜的形成。一项研究[6]表明UA 可抑制四种血清型化脓性链球菌生物膜的形成。该天然产物不仅使这些细菌生物膜生物量减少,而且使构成生物膜形成的蛋白质和脂肪酸组分也减少。此外,UA 还能抑制多种革兰氏阳性和阴性细菌生物膜的形成[3]。利用该特性,在小型医疗器械中加入UA可预防细菌附着和生物膜形成。在另一项研究中,将UA加入聚甲基丙烯酸甲酯(PMMA)中能够抑制MRSA 生物膜的形成;由此,SiK 等人开发了一种由氧化锌、硬脂酸钠和UA 组成的纳米结构生物活性膜,与不加UA 的活性膜相比,前者有效抑制食物病原体肠沙门氏菌的粘附和生物膜形成[7]。
1.2 抗真菌活性
UA 对许多致病性和非致病性的真菌和酵母具有较弱的抗真菌作用,其MIC 值通常高于100μg/ml[3]。不过,UA 对不同真菌生物膜的形成具有较强的抑制作用。一项研究[3]表明,UA 不仅可抑制白色念珠菌生物膜的形成从而防止进一步粘附,而且还能降低成熟生物膜的厚度。在另一项研究中,浓度为4μg/ml 的UA 显着抑制了生物膜形成,其中对耐唑类白色念珠菌菌膜的抑制率为71.08%,而对唑类敏感白色念珠菌菌膜的抑制率为87.84%[8]。此外,Pires[9]等人测试了UA 对Candida orthopsilosis 和C.parapsilosis 两种念珠菌的抗菌膜作用,发现UA 抑制这两种菌50%菌膜形成的浓度均为3.9μg/ml,但是UA 抑制C. parapsilosis 80%菌膜形成的浓度高出其它菌两倍,达到62.5μg/ml。不过,Kvasnickova 等人[10]的研究表明,UA 浓度即使高达300μg/ml,对C. parapsilosis 和C. krusei 两种念珠菌的菌膜形成也没有任何抑制作用。
1.3 抗病毒活性
UA 具有一定的抗病毒活性[11]。研究表明UA 能抑制单纯疱疹病毒1 型的细胞病变效应;用复合制剂Zn-UA 治疗乳头瘤病毒,6 个月内表现出抑制病毒生长的效果。另外,1.0μg/ml 的(+)-UA 显 示 出 对Epstein-Barr 病 毒 复制的抑制作用,而(-)-UA 活性相对较低,其有效浓度为5.0μg/ml。另一项研究表明,浓度为100μg/ml 的UA 对MDCK 细胞和甲型流感病毒感染的A549 细胞(如H5N1,H3N2 等)具有一定的抗流感病毒作用;并且发现UA 不能抑制病毒入侵,但能抑制病毒复制,提示其抗病毒作用的模式与阳性对照药金刚烷胺不同。此外,由于UA 同时对由流感病毒和抗真菌活性诱导的炎症反应具有抑制作用,因此它可以用作其他抗流感病毒药物的辅助疗法。
1.4 抗虫活性
Fournet 等人测试了UA 对巴西利什曼原虫、亚马逊酵母和杜氏利什曼原虫的抑制效果,结果发现原虫与25 μg/ml 的UA 一起孵育48h 后,UA 会导致寄生虫裂解,这和相同浓度的阳性对照药物(pentamidine)的效果相同。在另一项研究中[12],考察了UA 以25mg/kg 的剂量对亚马逊利什曼原虫感染的BALB/c 小鼠的保护作用,分别采用口服、在受感染足垫中皮下注射、或通过病灶内注射等途径给药。结果发现,与未经药物处理的动物相比,通过皮下注射和口服UA 没有产生任何保护效果;但是通过病灶内给药效果显著,小鼠足垫中感染的寄生虫负荷下降了72.28%,而且除了注射后脚垫上的轻微炎症外,没有观察到其它毒性作用。在同一研究中,作者考察了剂量为5、10、20mg/kg 的UA 以及配制在脂质体中10mg/kg 剂量的UA,通过灌胃给药对感染了弓形虫速殖子的Swiss Webster 小鼠保护实验。结果发现UA 以时间和剂量依赖的方式抑制速殖子的存活,并抑制细胞生长;值得一提的是20mg/kg 的(+)-UA 和配制在脂质体中10mg/kg 剂量的UA 均显著延长感染了寄生虫小鼠的存活时间,且UA 的疗效优于对照药物乙酰螺旋霉素[12]。
2.松萝酸的作用机理
随着对UA 兴趣的增加,有关其作用机理方面的研究报道也逐渐增多。在一项使用金黄色葡萄球菌MRSA 的研究中,作者认为该化合物可能通过破坏细菌细胞膜来发挥其抗菌作用[13]。另一项研究表明,UA 对枯草芽孢杆菌和金黄色葡萄球菌RNA 和DNA 的合成具有强烈抑制作用,并且还影响细菌mRNA 翻译从而抑制蛋白质合成[14]。最近,Yuri 等人利用脂双层膜及小鼠肝线粒体模型证明UA是一种H+载体[15];添加Ca2+可显著促进UA 诱导的质子转运活性,UA 中的三个羟基都参与质子和Ca2+的结合,修饰UA 中任何一个羟基不仅降低对钙离子的螯合能力及解偶联活性,而且还降低其对枯草芽孢杆菌生长抑制作用;此外,UA 还能快速耗散肝线粒体及枯草芽孢杆菌的膜电势。这些结果均表明UA 是一种钙离子依赖的质子解偶联剂。H+载体能够使细胞膜氧化磷酸化解偶联,在破坏H+浓度梯度的同时抑制ATP 合成;由于RNA、DNA和蛋白质等生物大分子的合成均需要大量的能量(ATP)参与,因此,质子梯度的紊乱以及由此导致的ATP 合成抑制作用被认为是UA 具有抗菌、抗虫的主要作用机制。
3.松萝酸的毒性作用
将小鼠原代肝细胞用5μM UA 处理,16h 后98%细胞发生死亡。UA 的毒性可能和该分子的“三酮”部分有关,其能够导致线粒体膜电位的丧失;且由于该片段的酸性,分子可以通过线粒体膜扩散从而导致质子泄漏[11]。此外,UA 还导致细胞周期失调、DNA 损伤和氧化应激反应,并且Nrf2 信号通路在UA 诱导的细胞毒性中被激活。在发达国家,UA 曾被作为减肥用膳食补充品而大量销售。然而,多个报道发现松萝酸具有一定的肝脏毒性[2]。它能引发肝细胞线粒体功能障碍和氧化应激反应,并摧毁肝细胞的正常代谢过程,进而在病人体内引起肝中毒和急性肝衰竭。但是,另有报道[11],UA 在细胞实验中观察到的毒性在体内试验中不太明显,中毒需要长期食用大量UA。14d 的急性毒性研究表明,UA 对通过饲料(100 或200 mg/kg/d)喂养的大鼠和小鼠均具有肝毒性,但较低剂量的耐受性良好。除肝毒性外,UA 还可能导致接触性过敏。
4.展望
松萝酸是一种结构独特的化合物,以两种对映体的形式存在,具有重要的生物活性。克服细菌感染的耐药性和抗虫是UA 及其衍生物最有前途的应用领域,然而UA对人体具有肝毒性、接触性过敏反应及炎症反应,加之其生物利用度较差,限制了其在临床上的应用。因此如何提高UA 生物利用度以及增效减毒成了该化合物后续的研究重点。

