Musashi1基因调控结肠癌HCT116细胞恶性生物学行为的机制研究
高 超,田彦明,丁博月,张 翼
1.河北医科大学第四医院放疗科,河北 石家庄 050011;2.河北医科大学生理教研室,河北 石家庄 050017
Musashi1(Msi1)属于RNA结合蛋白家族的一员,是RNA转录后表达的关键调控者,通常在肠道、中枢神经系统祖细胞和干细胞上高表达,对于维持自我更新与分化之间的平衡具有重要作用,因此其功能或表达异常能够以多种方式影响细胞的生理过程[1]。目前已在乳腺癌、胃癌等多种肿瘤中发现Msi1高表达,是肿瘤发生、发展的关键调节因子[2-6],但至今Msi1在结肠癌中的确切作用及机制仍不明确。最新研究表明,Msi1主要通过与靶基因mRNA 3’-非编码区(3’-untranslated region,3’-UTR)特异性地结合调控其下游基因表达,进而参与细胞增殖、细胞周期、细胞分化和细胞凋亡[7]。据报道p27 mRNA的3’-UTR区存在Msi1的潜在结合位点[8]。因此推测Msi1可能通过调节p27进而参与结肠癌的演进过程,本研究通过慢病毒沉默Msi1基因,明确Msi1对结肠癌HCT116细胞增殖、克隆形成能力及细胞周期的影响,并利用荧光素酶报告载体证实Msi1通过靶向调节p27发挥调控作用,阐明Msi1作用的分子机制,完善结肠癌中Msi1的信号通路,为结肠癌精准治疗提供理论支持。
1 材料和方法
1.1 慢病毒载体构建
由上海吉凯基因化学技术有限公司构建Msi1基因沉默重组慢病毒载体GV248-Msi1-shRNA和阴性对照慢病毒载体GV248-NCshRNA,共设计2条Msi1目标序列,最终选取干扰序列:5’-TGTTACATGGTGTTTCGAA-3’,同时设计一条阴性对照序列:5’-TTCTCCGAACGTGTCACGT-3’。
1.2 细胞培养及分组转染
将购自美国ATCC公司的人结肠癌细胞HCT116用10%胎牛血清的DMEM完全培养液(美国Gibco公司)常规培养。每孔5×104个目的细胞接种于6孔板中,按病毒感染复数值为20,分别加入适量的阴性对照病毒载体和沉默Msi1病毒载体的病毒液,感染72 h后观察荧光表达情况评估感染效率,通过嘌呤霉素(美国Sigma公司)加压筛选构建稳定表达的细胞系。实验将结肠癌HCT116细胞系分为未做任何处理的空白组(Blank组)、转染GV248-Msi1-shRNA的沉默组(Msi1-shRNA组)和转染GV248-NC-shRNA的阴性对照组(NC组)
1.3 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测mRNA表达
利用TRIzol裂解液[宝生物工程(大连)有限公司]提取各组细胞总RNA,使用反转录试剂盒(日本Takara公司)合成cDNA。由生工生物工程(上海)股份有限公司设计的Msi1、p27和GAPDH引物见表1。反应体系为20 μL:10 μL SYBR Premix、cDNA模板1 μL,上下游引物各0.5 μL及RNase-Free H2O 8 μL。采用7500型RTFQ-PCR(美国ABI公司)进行RTFQ-PCR实验。mRNA的相对表达量采用2-ΔΔCt分析法。

表1 RTFQ-PCR引物列表Tab.1 Primer list of RTFQ-PCR
1.4 细胞计数试剂盒(cell counting kit-8,CCK-8)检测细胞增殖活性
取对数生长期的各组细胞,以4×103个/孔接种于96孔板中,设5个复孔,培养24、48、72 h后,分别向每孔加入10 μL CCK-8溶液(日本Dojindo公司),37 ℃培养箱继续培养2 h酶标仪检测各孔450 nm处的吸光度(D)值,细胞活性%=(D实验组/D空白组)×100%。
1.5 克隆形成实验检测细胞克隆形成能力
取对数生长期的各组细胞,以1 000个/孔接种于6孔板中,培养箱中继续培养10~14 d,当出现肉眼可见的克隆时则终止培养;每孔加入1 mL甲醇室温下固定细胞20 min;然后每孔加入0.2%结晶紫染色液染色30 min。显微镜下计数多于50个细胞的克隆数。
1.6 流式细胞术(flow cytometry,FCM)检测细胞周期分布
取对数生长期的3组细胞,各组细胞培养48 h后收集细胞,加入70%的乙醇于4 ℃固定过夜;上机前每管加入2.5 μL的RNase A(美国BD公司)室温温育20 min,再加入25 μL碘化丙啶(propidium iodide,PI)染液(美国BD公司),室温避光保存15 min,用FACSAria Ⅱ FCM(美国BD公司)检测,数据由Modfit软件分析。
1.7 裸小鼠移植瘤实验检测体内成瘤能力
用注射器将各组细胞接种于BALB/c裸小鼠(中国医学科学院实验动物研究所,动物生产许可证号为SCXK京2009-0008)右上肢外侧皮下(5×106个细胞/只),每周观察裸小鼠的一般状态及肿瘤形态,并记录裸小鼠的移植瘤体积,V(cm3)=长×宽2/2。于接种后第8周处死裸小鼠,剥离瘤块后称其质量,抑瘤率(%)=[(对照组平均瘤质量-沉默组平均瘤质量)/对照组平均瘤质量]×100%。
1.8 蛋白质印迹法(Western blot)检测蛋白水平
按照蛋白提取试剂盒(北京索莱宝科技有限公司)操作说明,分别提取各组细胞总蛋白。采用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白质,随后于恒压100 V转膜2 h,转印后的PVDF膜使用5%的脱脂奶粉封闭2.5 h,加一抗(英国Abcam公司)、β-actin(英国Abcam公司),4 ℃冰箱过夜。之后加入对应辣根过氧化物酶标记二抗IgG(英国Abcam公司);采用ECL检测,GenoSens凝胶成像系统(上海勤翔科学仪器有限公司)分析条带灰度值。
1.9 双荧光素酶报告基因实验
PubMed检索显示,p27 mRNA的3’-UTR区可能存在Msi1的潜在结合位[(G/A)UnAGU,n=1~3][8]。用Primer 5软件设计p27引物,详见表2,扩增出p27的3’-UTR野生型(wild type,WT)和突变型(mutant,MU)片段,将p27 mRNA3’-UTR中Msi1的两个结合位点由WT1(ATAGT)和WT2(GTAGT)突变为MU1(CGCAG)和MU2(AGCAG),再把野生型(WT1和WT2)和突变型(MU1和MU2)分别克隆进入双荧光素酶真核表达载体pMIR-Report(美国Ambion公司)中。检测报告基因质粒与海肾质粒共转染目的细胞,按照LipofectamineTM2000脂质体(美国Invitrogen公司)转染说明操作。转染48 h后加入荧光素酶检测试剂,测定萤火虫荧光素酶的活性,随后加入Stop&Glo试剂测定海肾荧光素酶的活性,相对荧光素酶活性以萤火虫荧光素酶与海肾荧光素酶活性之比表示。

表2 p27引物列表Tab.2 Primer list of p27
1.10 统计学处理
2 结果
2.1 慢病毒感染HCT116细胞
慢病毒感染人结肠癌HCT116细胞株72 h后,荧光显微镜观察感染细胞绿色荧光蛋白(green fluorescent protein,GFP)的表达情况,100倍视野计数各组荧光细胞数(NC组:538.33±11.06,Msi1-shRNA组:553.33±15.04)和总细胞数(NC组:581.67±21.20,Msi1-shRNA组:597.33±28.02),荧光细胞占比即为感染效率,在荧光显微镜下观察到细胞感染效率在90%以上(图1A)。RTFQ-PCR结果显示,慢病毒转染后Blank组、NC组和Msi1-shRNA组mRNA相对表达量分别为1.079±0.099、1.002±0.078和0.262±0.053,慢病毒成功干扰Msi1-shRNA组细胞Msi1表达,相对于阴性对照组沉默效率为73.85%(P<0.001,图1B)。
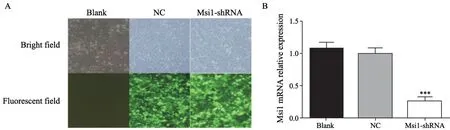
图1 慢病毒抑制Msi1表达水平Fig.1 Lentiviral-mediated RNAi suppressed expression of Msi1
2.2 沉默Msi1基因对HCT116细胞增殖活性的影响
慢病毒感染HCT116细胞后,采用CCK-8检测各组细胞的生长情况,酶标仪检测3组细胞24、48、72 h的450 nm处的D值,根据D值绘制细胞增殖曲线。结果显示,Msi1-shRNA组细胞在各时间点的增殖速度均明显低于Blank组及NC组,差异有统计学意义(P<0.05)。Msi1-shRNA组24、48、72 h细胞活性相对于Blank组分别为85.81%±2.26%、83.13%±2.03%、74.48%±3.08%,而Blank组与NC组之间差异无统计学意义(P>0.05),提示沉默Msi1基因表达后,结肠癌HCT116细胞的增殖能力明显降低(图2)。
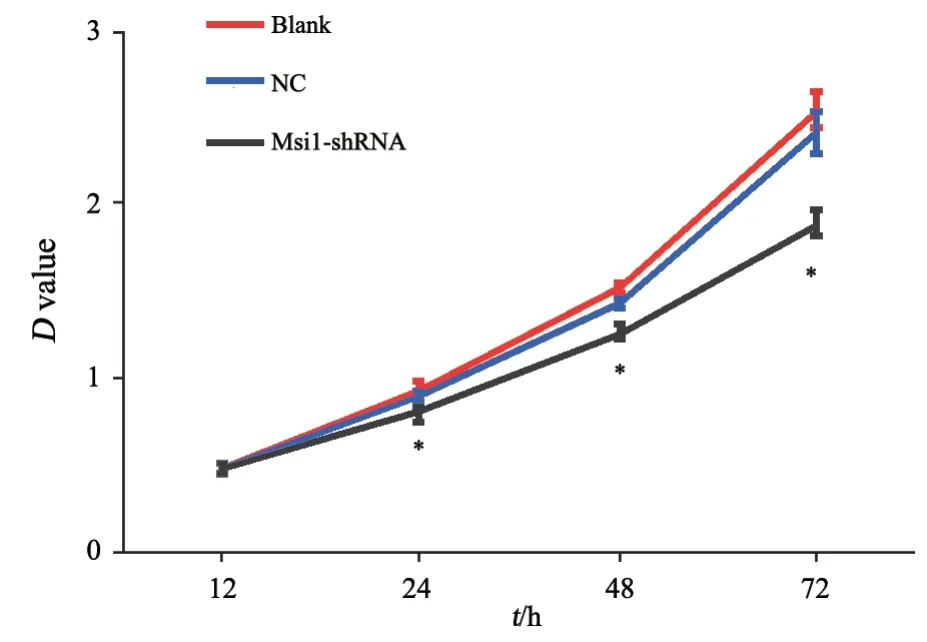
图2 CCK-8实验检测沉默Msi1基因后HCT116细胞生长曲线Fig.2 Growth curve of HCT116 cells after Msi1 gene silencing detected by CCK-8 assay
2.3 沉默Msi1基因对HCT116细胞克隆形成能力的影响
通过平板克隆实验检测慢病毒沉默HCT116细胞Msi1表达后对克隆形成能力的影响。3组细胞以1 000个/孔接种于6孔板中,培养箱中继续培养10~14 d,当出现肉眼可见的克隆时则终止培养,显微镜下计数多于50个细胞的克隆数。结果显示,Msi1-shRNA组细胞形成集落数(267.67±39.81)明显低于Blank组(474.00±79.30)和NC组(457.33±53.58),差异有统计学意义(P<0.01),而Blank组与NC组之间差异无统计学意义(P>0.05),提示沉默Msi1基因表达能够显著降低结肠癌HCT116细胞克隆形成能力(图3)。
2.4 沉默Msi1基因对HCT116细胞周期的影响
通过FCM检测慢病毒沉默HCT116细胞Msi1表达后对细胞周期的影响。慢病毒感染HCT116细胞后,取对数生长期的3组细胞培养48 h后收集,加入70%的乙醇于4 ℃固定过夜,使用FCM PI染色法上机检测各组细胞周期变化,结果显示,与Blank组(42.67±3.37)和NC组(44.20±4.60)相比较,Msi1-shRNA组G0/G1期细胞百分比(54.83%±4.09%)显著增加(P<0.05);Msi1-shRNA组S期细胞百分比(8.14%±1.81%)与Blank组(13.13%±1.45%)、NC组(13.70%±2.13%)相比明显减少(P<0.05);而Msi1-shRNA组、Blank组和NC组的G2/M期细胞百分比分别为37.03%±5.28%、44.17%±4.35%和42.03%±2.61%,Msi1-shRNA组G2/M期细胞有减少趋势(P>0.05),Blank组与NC组之间差异无统计学意义,提示沉默Msi1基因使结肠癌HCT116细胞周期阻滞于G0/G1期,S期细胞明显减少,细胞分裂显著减缓(图4)。
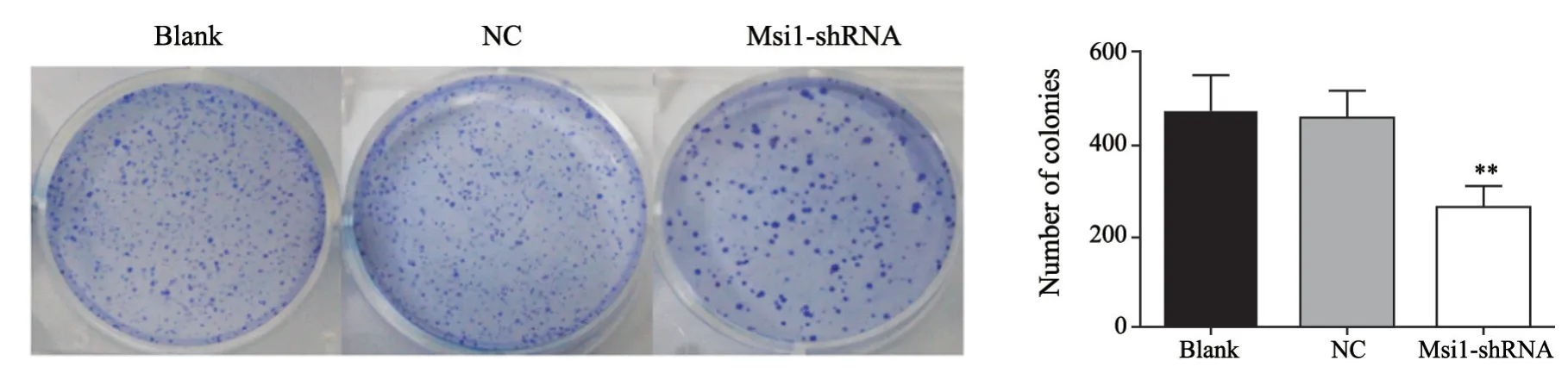
图3 克隆形成实验检测沉默Msi1基因对HCT116细胞克隆形成能力的影响Fig.3 Effect of Msi1 gene silencing on colony forming ability of HCT116 cells detected by clone formation assay

图4 FCM检测沉默Msi1基因对HCT116细胞周期的影响Fig.4 Effect of Msi1 gene silencing on cell cycle of HCT116 cells detected by FCM
2.5 沉默Msi1基因对HCT116细胞裸小鼠移植瘤的影响
通过裸小鼠移植瘤实验检测慢病毒沉默Msi1基因对HCT116细胞体内成瘤性的影响。用注射器将3组细胞分别接种于BALB/c裸小鼠右上肢外侧皮下,每周观察裸小鼠的的移植瘤体积,V(cm3)=长×宽2/2。于接种后第8周处死裸小鼠,剥离瘤块后称重。根据测量得到的移植瘤体积绘制其生长曲线。与Blank组和NC组相比,Msi1-shRNA组成瘤时间较晚且生长缓慢(P<0.05,图5),并且Msi1-shRNA组肿瘤质量[(0.39±0.14)g]明显小于Blank组[(0.93±0.23)g]及NC组[(0.84±0.18)g](P<0.01),抑瘤率为58.06%,Blank组及NC组之间差异无统计学意义(P>0.05),提示沉默Msi1基因可显著抑制结肠癌HCT116细胞在体内的生长(图6)。
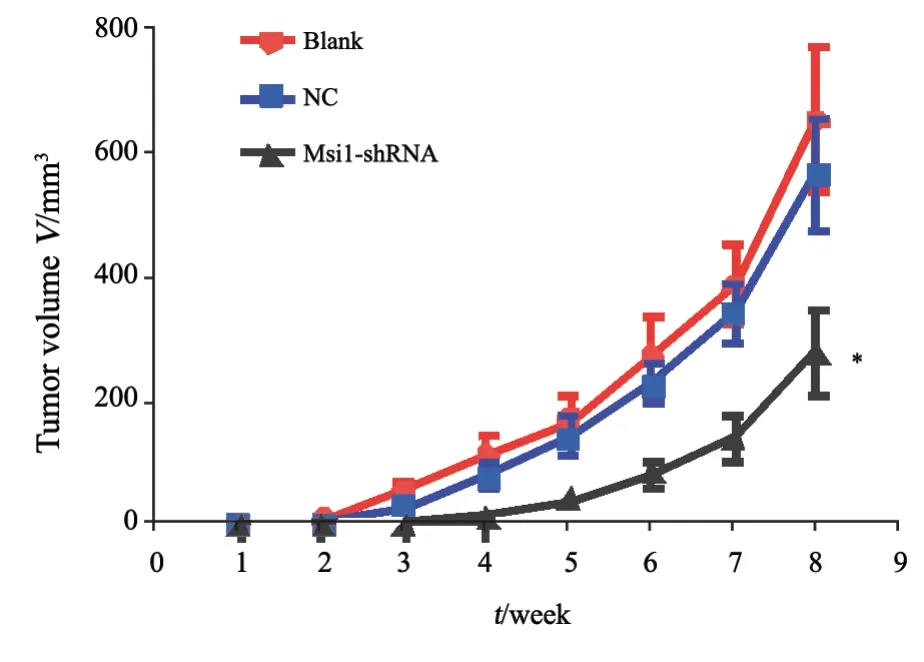
图5 沉默Msi1基因对HCT116细胞移植瘤生长的影响Fig.5 Effect of Msi1 gene silencing on xenograft tumor growth of HCT116 cells

图6 沉默Msi1基因对HCT116细胞移植瘤重量的影响Fig.6 Effect of Msi1 gene silencing on xenograft tumor weight of HCT116 cells
2.6 沉默Msi1基因对HCT116细胞p27 mRNA表达的影响
采用RTFQ-PCR检测慢病毒沉默HCT116细胞Msi1基因后对p27mRNA表达的影响,mRNA的相对表达量采用2-ΔΔCt分析法。结果显示,Blank组、NC组与Msi1-shRNA组p27 mRNA表达量分别为0.992±0.111、1.006±0.142和0.968±0.121,3组之间差异无统计学意义(P>0.05),提示沉默Msi1基因并不影响p27 mRNA表达(图7)。
2.7 沉默Msi1对HCT116细胞p27蛋白水平的影响
采用Western blot检测慢病毒沉默HCT116细胞Msi1后对p27蛋白水平的影响。Msi1-shRNA组p27蛋白相对水平(0.602±0.105)明显高于Blank组(0.187±0.049)及NC组(0.228±0.072)(P<0.01),而Blank组及NC组之间差异无统计学意义(P>0.05),提示降低Msi1表达可以上调p27蛋白水平(图8)。
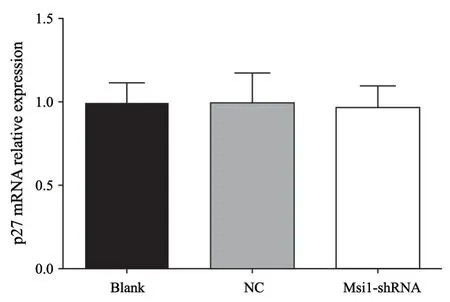
图7 RTFQ-PCR检测各组细胞p27 mRNA相对表达水平Fig.7 The p27 mRNA expression of each group detected by RTFQ-PCR
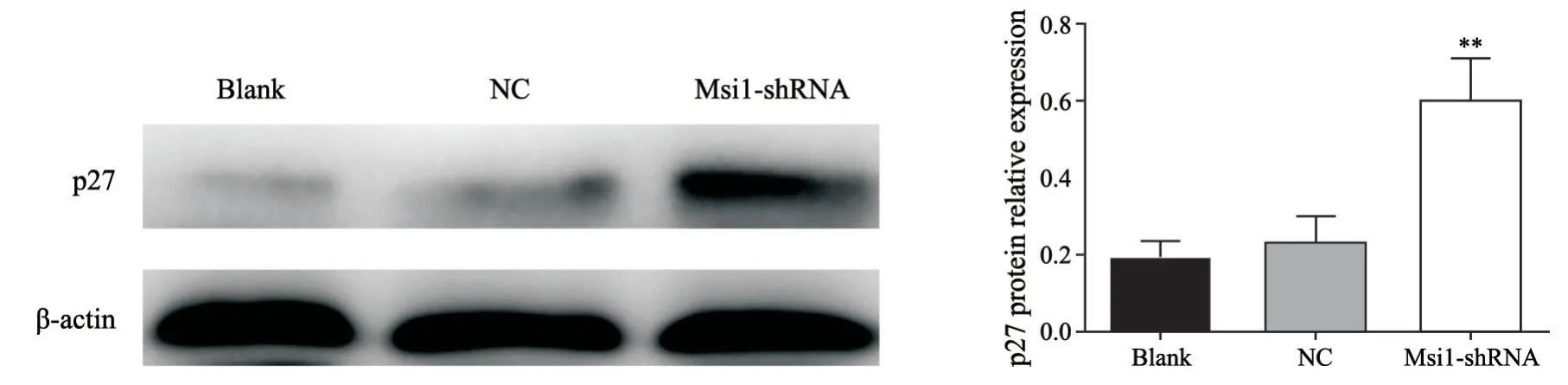
图8 Western blot检测各组细胞p27蛋白相对水平Fig.8 The p27 protein level of each group detected by Western blot
2.8 Msi1通过p27 mRNA的特定位点抑制p27表达
Msi1主要通过与下游靶基因mRNA 3’-UTR特定序列结合而调控下游靶基因的表达。实验中将靶基因p27 mRNA 3’-UTR区的野生型(WT1和WT2)和突变型(MU1和MU2)结合序列克隆至载体中报告基因荧光素酶的下游,构建荧光素酶质粒,并送至上海吉凯基因化学技术有限公司进行测序分析,证实已将p27 mRNA 3’-UTR区的野生型和突变型结合序列克隆入pMIRReport载体(图9)。Msi1可通过该结合序列调控荧光素酶的表达,检测荧光素酶的活性变化可以鉴定Msi1对p27是否有调控作用。将构建的p27 3’-UTR区的荧光素酶报告载体(p27野生型)及其突变体(p27突变型),分别转染3组细胞。结果显示,与Blank组(0.373±0.045)、NC组(0.438±0.072)相比,Msi1-shRNA组(0.954±0.075)p27野生型的荧光素酶活性明显上升(P<0.001),提示Blank组和NC组中高表达的Msi1可以和野生型p27 mRNA 3’-UTR特定序列结合并抑制荧光素酶的表达,而沉默组Msi1低表达,因此荧光素酶的表达上调。同时,各组Msi1反应位点突变体p27突变型的荧光素酶活性则没有明显变化(P>0.05),表明Msi1是通过与p27 mRNA 3’-UTR区结合从而抑制了p27蛋白表达(图10)。
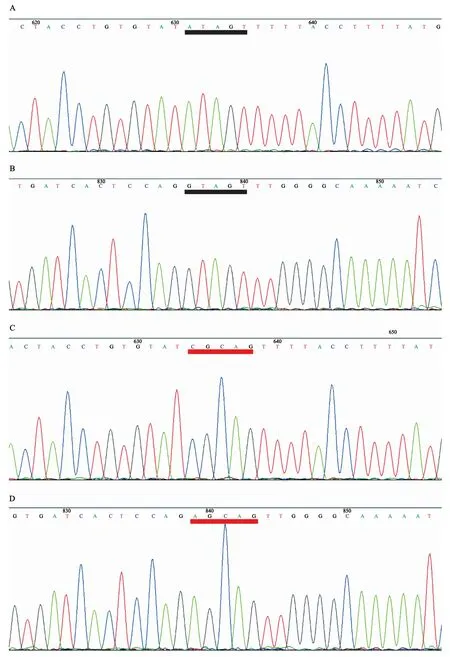
图9 2种质粒测序图Fig.9 Sequencing map of 2 plasmids

图10 Msi1通过结合p27 mRNA的特定位点抑制p27蛋白表达Fig.10 Msi1 inhibited p27 protein expression by binding to specific sites of p27 mRNA
3 讨 论
Msi1是一种进化保守的RNA结合蛋白,它的作用与转录因子类似,是干细胞的重要标志物,但在分化后的细胞中几乎检测不到[9]。最近的研究[2-6]表明,神经胶质瘤、胃癌和乳腺癌等均发现Msi1异常高表达,并且Msi1高表达被认为与许多恶性肿瘤分期及增殖活性相关,并提示疾病的预后较差,提示Msi1在恶性肿瘤发生、发展过程中起关键作用,可能是一种原癌基因,但至今在结肠癌中的确切作用机制仍然未知。本研究利用慢病毒成功构建Msi1稳定低表达的HCT116细胞株,发现沉默Msi1基因后,结肠癌HCT116细胞G0/G1期阻滞,S期细胞明显减少,细胞分裂显著减缓,并造成细胞体外增殖活性及克隆形成能力明显下降。另外,裸小鼠移植瘤实验表明,沉默Msi1基因可显著抑制结肠癌HCT116细胞在体内的成瘤性。上述结果表明,Msi1在结肠癌演进过程中有重要影响,沉默Msi1基因对结肠癌细胞具有生长抑制作用。Chen等[10]在肝细胞癌的研究中发现,当沉默Huh7细胞Msi1基因后,细胞增殖能力及克隆能力明显受到抑制,并在G1/S期转换时引起细胞周期停滞。Wang等[11]的研究发现,干扰口腔鳞状细胞癌中Msi1表达,将导致细胞增殖、迁移及侵袭能力显著下降,出现细胞周期停滞于S期,因此认为Msi1是肿瘤发生、发展过程中的核心调节因子。以上研究报道与本研究结果相似。
目前Msi1通过何种机制发挥其癌基因的作用仍不很明确。Msi1是RNA转录后表达的关键调控者,主要通过与转录产物的非翻译区域的序列发生特异结合,从而影响翻译的过程。之前有研究[7]发现,Msi1可以通过与下游靶基因mRNA 3’-UTR区特异性结合抑制翻译的过程,进而调控其下游基因表达,最终参与细胞增殖、细胞周期、细胞分化和细胞凋亡。最新研究[8]也表明,p27 mRNA 3’-UTR区存在Msi1的潜在结合位点。p27作为细胞周期负性调节因子,被认为是一种抑癌基因,并且在结肠癌组织中p27蛋白的表达明显降低,且其表达的阳性率与结肠癌的分化程度、有无淋巴结转移及预后有关[12-13],其从生物功能上可能是最直接地影响G1/S期限制位点的调控因子,p27蛋白高表达可导致肿瘤细胞周期停滞在G1期,进而抑制肿瘤细胞增殖[14-16]。本实验的结果也印证了上述观点,沉默结肠癌细胞Msi1基因表达后,发现沉默组p27蛋白水平显著上调,通过FCM观察到沉默组肿瘤细胞发生了明显的G0/G1期阻滞,细胞周期进程受阻,而且CCK-8实验、克隆形成实验和裸小鼠移植瘤实验证实,沉默组细胞体内外增殖能力及克隆形成能力均受到明显抑制。因此推测,Msi1可能正是通过与其靶基因p27 mRNA 3’-UTR区特异性结合,抑制其翻译,降低其蛋白水平,进而参与结肠癌的发生、发展。为验证该假设,本实验首先需要证明Msi1作用于p27 mRNA翻译阶段,而对p27 mRNA水平并无影响。因此,本实验针对细胞周期调控因子设计了p27的特异性引物,采用RTFQ-PCR进行转录水平的检测,并用Western blot检测了蛋白水平。结果显示,与Blank组及NC组相比,沉默组细胞中p27基因的mRNA水平无明显改变,但是其蛋白水平明显上调,说明Msi1可以抑制p27 mRNA的翻译,从而负向调节p27的蛋白水平,而对p27 mRNA表达无影响。为进一步挖掘沉默Msi1上调p27蛋白水平的机制,进行了荧光素酶报告实验,结果显示,Msi1能明显抑制p27 3’-UTR区野生型的荧光素酶活性,但p27 3’-UTR区中Msi1的结合区域突变时,Msi1抑制p27 3’-UTR区的荧光素酶活性现象消失,提示结肠癌中Msi1能够与p27 mRNA 3’-UTR区特异性的结合,进而靶向抑制p27蛋白的水平从而发挥其癌基因的作用,这与Liu等[17]在宫颈癌中的研究结果相似。
综上所述,p27是Msi1的靶基因,沉默Msi1后可以通过上调p27蛋白水平,导致结肠癌HC116细胞G0/G1期阻滞,从而抑制肿瘤细胞增殖。本研究存在一定局限性,如未对p27进行靶基因的功能验证,有待后续进一步研究,从而系统地解析Msi1的信号转导通路,为结肠癌的预防、诊断和治疗提供新的靶点。

