自噬基因WIPI2在人肝细胞癌索拉非尼耐药细胞株Huh7-SR中的表达及意义
陈灿金,叶在秉,阮煜,童洪飞,倪仲琳,赵亚新
(温州医科大学附属第二医院/育英儿童医院 外科,浙江 温州 325027)
肝癌是我国常见的恶性肿瘤之一,临床上以肝细胞癌最多见,其治疗困难,又极易复发[1-2]。索拉非尼是治疗晚期肝癌的重要药物[3-4]。索拉非尼通过抑制丝氨酸/苏氨酸激酶以及酪氨酸激酶受体来抑制肿瘤的血管生成和增殖[5]。然而,索拉非尼仅对大约30%的患者有益,并且通常在6个月内发生获得性耐药[6-7]。肝细胞癌的索拉非尼耐药性可能由多种因素介导,目前仍未被充分阐明。
自噬是一个进化保守的过程,是将受损或无用的细胞器、蛋白质或其他细胞质成分传递至溶酶体系统进行降解的过程, 通过回收养分,以提供能量并再生细胞器[8-9]。研究表明,自噬通过维持肿瘤细胞在代谢和药物治疗下的存活而被认为是耐药性的重要机制[10]。自噬基因WIPI2(WD repeat domain,phosphoinositide interacting 2,WIPI2)是酵母ATG18基因(autophagy-related protein 18)的哺乳动物同源物,在自噬中起关键作用。它结合ω-体及内质网的磷脂酰肌醇3-磷酸[PI(3)P]富集域,而该域是成熟的自噬体形成的场所[11-12]。缺失WIPI2的细胞无法形成自噬体,对致病细菌(包括沙门氏菌)的吞噬也受到严重损害[13]。本研究选用人肝细胞癌Huh7细胞和索拉非尼诱导的耐药细胞株Huh7-SR细胞,通过测定自噬基因WIPI2的表达情况,肿瘤细胞的克隆情况等,初步探究WIPI2基因与肝细胞癌耐药的相关性,为肝细胞癌的治疗寻找新的分子靶点。
1 材料和方法
1.1 材料
人肝细胞癌Huh7细胞(中国科学院上海细胞生物学研究所),DMEM培养液、胰蛋白酶及胎牛血清(GIBCO公司),索拉非尼(美国Sigma公司),WIPI2抗体(杭州浩克生物技术有限公司,批号:15432-1-AP,稀释度:1:400),GADPH内参抗体及二抗(Abcam公司),ECL试剂盒(碧云天生物技术有限公司),NC-siRNA及WIPI2-siRNA(广州市锐博生物科技有限公司),CCK-8细胞增殖检测试剂盒(日本DOJINDO公司),BCA蛋白测定试剂盒(南京凯基生物科技发展有限公司),凝胶成像仪(美国Bio-rad公司),荧光显微镜(日本Olympus公司),自动酶标仪(美国Bio-tek公司) 。
1.2 方法
1.2.1 人肝细胞癌索拉非尼耐药细胞株Huh7-SR的建立:选人肝细胞癌Huh7细胞为亲本细胞,采用药物浓度梯度递增法,以索拉非尼为诱导药物,建立索拉非尼耐药细胞株Huh7-SR。索拉非尼药物配制:将索拉非尼粉末加入适量二甲基亚砜(DMSO)溶液,配制成浓度为200 μmoL/L的索拉非尼工作液,-20 ℃保存;后再用10% FBS的DMEM培养基稀释至所需浓度。按照每周递增索拉非尼0.25 μmol/L浓度,CCK8法检测细胞增殖活性,历时8个月后,自制细胞能在5 μmol/L索拉非尼浓度的培养液中稳定生长,获得稳定的索拉非尼耐药细胞株,诱导的耐药细胞株命名为Huh7-SR。
1.2.2 细胞培养:人肝细胞癌Huh7细胞和人肝细胞癌索拉非尼耐药Huh7-SR细胞,采用含10%新生胎牛血清的DMEM培养液,在37 ℃、5% CO2培养箱中培养。为维持Huh7-SR细胞的耐药性,细胞培养过程中,加入2 μmol/L的索拉非尼,于实验前2周撤药。
1.2.3 蛋白质印迹法检测Huh7与Huh7-SR细胞中WIPI2蛋白的表达情况:取对数生长期Huh7细胞与Huh7-SR细胞,加裂解液裂解,离心收集上清,提取蛋白质。采用Bradford法测定蛋白浓度,蛋白质变性,SDS-PAGE电泳,转膜,封闭,一抗孵育,TBST洗涤,二抗孵育,TBST洗涤,采用ECL化学发光试剂盒进行化学发光法显影,以每条蛋白电泳带的灰度值表示蛋白表达量,以GADPH为标准,计算WIPI2蛋白相对表达值。
1.2.4 用siRNA转染法敲低Huh7-SR细胞中WIPI2基因表达:根据siRNA试剂说明书要求,在转染前1 d,将Huh7-SR细胞接种在培养板中,第2天细胞密度达到30%~50%时加入制备好的转染复合物(转染浓度为50 nmol/L)。分设两组,其中对照组转染NC-siRNA(si-NC),实验组(敲低组)转染WIPI2-siRNA(si-WIPI2)。转染后继续培养24~96 h后,采用蛋白质印记法检测转染细胞中WIPI2蛋白的表达水平,验证基因敲低效率。实验所用siRNA序列见表1。

表1 实验所用siRNA序列
1.2.5 用细胞平板克隆实验检测不同siRNA转染后Huh7-SR细胞对索拉非尼敏感性改变:取稳定转染siRNA的两组Huh7-SR细胞(即转染si-WIPI2组和转染si-NC组),用胰酶消化并吹打成细胞悬液,进行细胞计数后按每孔500个细胞加入培养器皿中。两组加入索拉非尼处理(维持浓度为0.75 μmol/L),同时两组各对应设置空白对照处理(未予索拉非尼处理,其余条件相同),培养10~14 d,当培养器皿板中出现肉眼可见的克隆时,终止培养,加4%多聚甲醛固定后加入结晶紫染液染色,将平皿倒置并叠加在带网格的透明胶片上,肉眼直接计数细胞克隆数。
1.3 统计学分析
采用SPSS 16.0软件进行统计学处理。计量资料采用(±s)表示,两组间比较采用t检验,多组间比较采用方差分析;P<0.05表示差异有统计学意义。
2 结果
2.1 人肝细胞癌索拉非尼耐药细胞株Huh7-SR的建立
Huh7亲本细胞通过长时间的索拉非尼诱导后形成稳定的索拉非尼耐药细胞株Huh7-SR。Huh7-SR细胞能在5 μmol/L索拉非尼浓度下稳定生长增殖,光镜下可见Huh7细胞与Huh7-SR细胞形态改变(图1 A1,A2)。采用CCK8法测定细胞活力,结果显示用不同浓度索拉非尼处理后的Huh7-SR细胞的细胞活力明显高于亲本组Huh7细胞的细胞活力(图1 B1,B2,B3,B4)。其中Huh7-SR细胞在7.5 μmol/L、10 μmol/L、12.5 μmol/L浓度索拉非尼处理24 h后其细胞活力分别是(81.04±4.33)%,( 76.65±3.87)%,(69.14±4.06)%,处理48 h后Huh7-SR细胞活力分别是(69.86±3.20)%,( 59.92±3.73)%,( 50.46±4.11)%,与亲本细胞组相比均有统计学意义(P<0.05)。这表明Huh7-SR细胞已对索拉非尼表现出明显的耐药性,索拉非尼耐药株Huh7-SR成功建立。
2.2 WIPI2蛋白在人肝细胞癌索拉非尼耐药细胞株Huh7-SR中表达水平增加
采用Western blotting检测Huh7细胞和Huh7-SR细胞中WIPI2蛋白的表达情况。在Huh7细胞中WIPI2蛋白呈低水平表达,其蛋白相对表达值为(1.02±0.07),在耐药株Huh7-SR中WIPI2蛋白表达明显升高,其蛋白相对表达值为(2.18±0.23),二者相比有统计学差异(P<0.05,图2 C1,C2)。提示WIPI2基因可能在肝细胞癌耐药形成过程中发挥重要作用。
2.3 用siRNA转染法成功敲低Huh7-SR细胞中WIPI2基因表达
用蛋白质印记法检测发现,WIPI2蛋白在转染si-WIPI2的Huh7-SR细胞中的为低表达,其蛋白相对表达值为(0.44±0.03),而在转染si-NC的Huh7-SR细胞中仍为高表达,其蛋白相对表达值为(1.21±0.08) (图3 D1,D2),两组相比有统计学差异(P<0.05),由此验证si-WIPI2转染敲低了WIPI2基因在Huh7-SR细胞中的表达。
2.4 敲低WIPI2基因表达后Huh7-SR细胞对索拉非尼的敏感性升高
通过细胞平板克隆实验发现,两不同转染组细胞即敲低组(si-WIPI2)和对照组(si-NC),在给予索拉非尼处理后细胞克隆数有不同的变化。如图4所示,在没有给予索拉非尼处理的两组细胞克隆数无明显差异(P>0.05);而在索拉非尼处理下,敲低组(si-WIPI2)的细胞克隆数明显低于对照组(si-NC)[(60±4)个vs(102±3)个,P<0.05],这说明敲低WIPI2基因表达后可增加耐药株Huh7-SR对索拉非尼的敏感性,进一步提示WIPI2基因表达对人肝癌索拉非尼耐药Huh7-SR细胞的耐药性产生具有重要的意义。
3 讨论
目前肝癌发病率和死亡率总体呈上升趋势,我国每年约有38万人死于肝癌,占全球肝癌死亡病例数的51%[14]。肝癌具有生长速度快、恶性程度高、易复发转移及药物耐受等特点,因此肝癌的预后较差[15]。索拉非尼作为目前唯一用于临床的肝癌分子靶向治疗药物,其疗效仍然有限,耐药性的产生可能是导致其化疗失败的主要原因[16]。因此研究肝细胞癌的耐药机制,对于提高其化疗疗效,指导临床用药有着重要的价值。
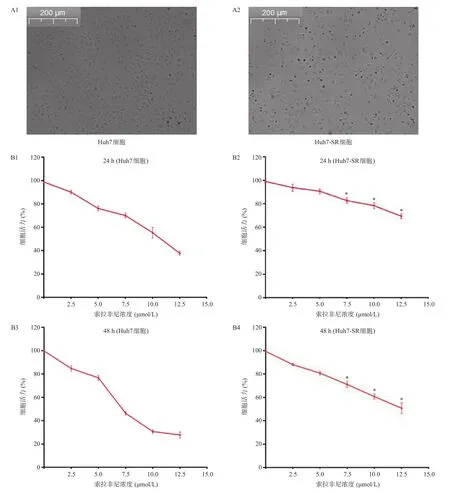
图1 索拉非尼对Huh7细胞和Huh7-SR细胞的影响
基因的分子靶向治疗是目前的研究热点之一[17],由于自噬与耐药性的产生可能存在一定的联系,而自噬基因WIPI2在细胞自噬小体和自噬通量形成中起重要作用[12-13],因此我们开展相关实验验证WIPI2基因与耐药性的产生是否存在一定的关联。本研究首先采用药物浓度梯度法对索拉非尼敏感的亲本细胞Huh7在体外诱导培养成为耐药株Huh7-SR。在实验中我们发现WIPI2在耐药细胞株Huh7-SR中的表达明显高于Huh7细胞,因此我们推测WIPI2与肝细胞癌化疗过程中产生的耐药性存在一定关系。为了证明这一假设,我们在Huh7-SR细胞中敲低WIPI2后,细胞的耐药性降低,恢复了对索拉非尼的敏感性,进一步证明了WIPI2与耐药性的密切关系。该现象提示我们在肝细胞癌化疗过程中,WIPI2可能是提高肿瘤细胞对化疗药物敏感性的一个重要分子靶点。同时,考虑到这一现象的发生可能与自噬信号通路的激活相关,我们也将开展下一步实验探索其具体作用机制。
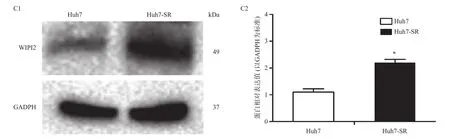
图2 WIPI2蛋白在不同肝癌细胞株中的表达情况
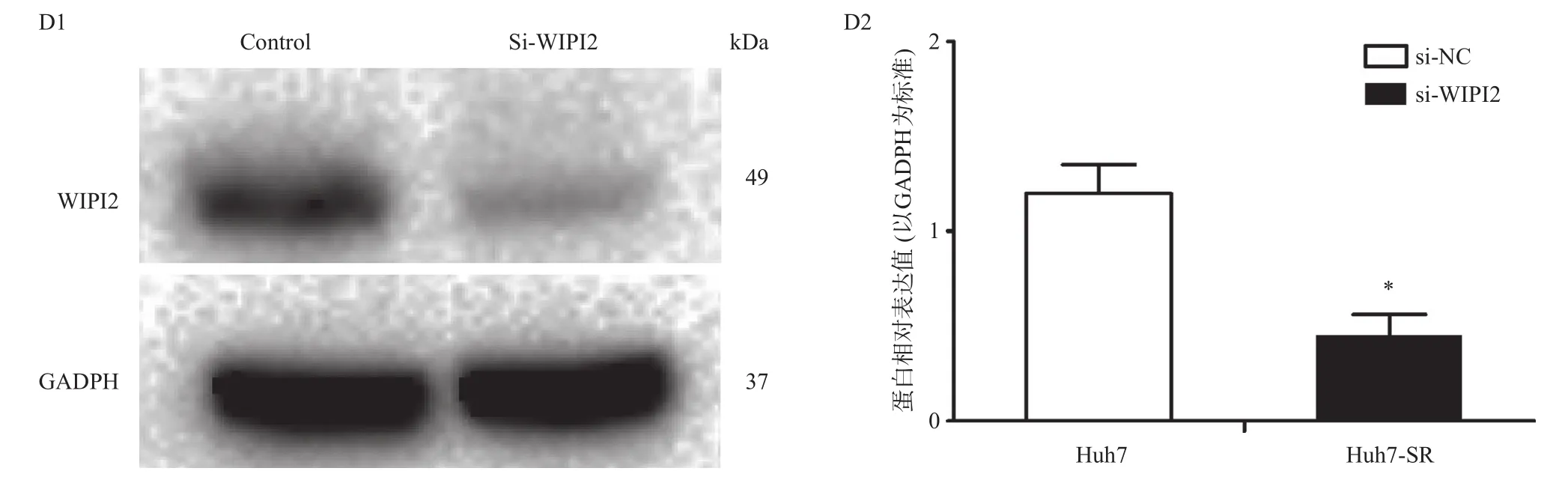
图3 siRNA转染后Huh7-SR细胞中WIPI2蛋白表达情况
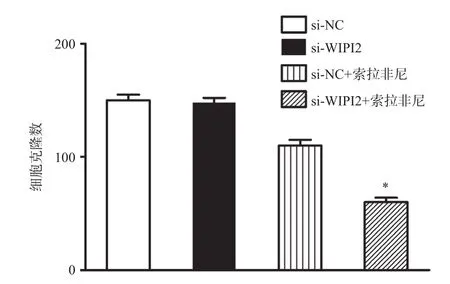
图4 不同条件下Huh7-SR细胞的克隆情况

