射频消融术与传统手术治疗小肝癌疗效与安全性的Meta分析
庄李磊,雷鑫明,童秀萍,王海英,陆小锋
(义乌市中心医院 消化内科,浙江 金华 322000)
肝细胞癌(hepatocellular carcinoma,HCC)作为消化系统最常见的肿瘤之一,在我国非常常见,且病死率有逐渐上升的趋势[1]。随着医疗技术的飞速发展,肝细胞癌无论从诊断、治疗、预后方面都已经有了明显的改善,小肝癌作为肝细胞癌的常见类型同样如此[2]。然而,由于肝脏的代偿能力较强,大多数患者在早期无明显临床表现,发现后大多已经失去手术机会[3],故早发现、早治疗对于早期小肝癌的治疗就显得尤其重要[4]。以往对于小肝癌的治疗以传统手术切除为主[5],但手术可能会受肿瘤的位置,患者心、肝、肾功能及患者自身因素等影响[6]。而后又逐渐出现肝脏动脉导管栓塞(TACE)、无水乙醇注射(PEI)等治疗方法,研究发现以上方法对于小肝癌疗效与传统手术(traditional surgery,TS)较为相似[7]。近年来,随着热消融技术的飞速发展,射频消融术(radiofrequency ablation,RFA)逐渐运用于早期小肝癌的治疗,该方法无创且能使肿瘤组织完全坏死[8]。然而是否可将其作为小肝癌最优选的治疗方法,目前有较大争议。本研究对射频消融术及传统手术治疗小肝癌的疗效和安全性进行Meta分析,以期提供循证医学相关的依据。
1 材料和方法
1.1 检索方法
检索国内外公开数据库,国外数据库:Embase、PubMed、the Cochrane Library;中文数据库:中国知网数据库、中国生物医学文献数据库、万方数据库、维普数据库。检索时间范围为2008年1月至2018年1月。检索词主要为:“hepatocellular carcinoma”“hep atectomy”“radiofrequency ablation”“射频消融术”“传统手术”“小肝癌”。检索语种主要为英文和中文。
1.2 纳入及排除标准
1.2.1 纳入标准:(1)确诊为小肝癌,且为初诊;(2)无远处转移;(3)未接受除传统手术及射频消融方式外的其他治疗方式。
1.2.2 排除标准:(1)不符合小肝癌诊断标准;(2)非初诊研究对象;(3)存在远处转移的研究对象;(4)观察指标过少,样本量过小,随访时间过短的研究对象。
1.3 相关文献评价及文献数据分析
由2名研究者以Cochrane评价手册内的质量评价标准分别进行筛选和评价并相互核对。
1.4 统计学分析
对于纳入的研究对象,用RevMan 5.3进行Meta分析。对于二分类变量而言,采用OR值及其95%CI描述,χ2检验各研究间异质性。当I2<50%,P>0.1时,提示各研究之间异质性较低或者异质性不存在,此时Meta分析采用固定效应模型。当I2≥50%,P≤0.1时,提示异质性较高,此时Meta分析采用随机效应模型并且需要排除可能影响异质性的相关因素,运用漏斗图进行偏倚评价。
2 结果
2.1 文献搜索结果和文献基本情况
按照检索方法共检索到文献1 477篇,将所有的重复文献,会议记录,系统评价及综述剔除后纳入文献785篇,再通过文章标题、摘要及全文后最终纳入10篇文献[9-18]。射频消融(RFA)组共1 503例,传统手术(TS)组共1 657例,2篇文献实验方法为随机对照实验,其余8篇为非随机对照实验。其中2篇文献质量评价为B级,其余8篇文献为C级。文献检索流程如图1。各文献基本情况见表1。
2.2 1、3、5年总生存率的Meta分析
1年总生存率:对RFA组和TS组组间异质性检测得出I2=54%,P=0.02,存在异质性,则用随机效应模型进行Meta分析,结果显示OR0.76,95%CI0.45~1.31,P=0.33,两组差异无统计学意义。具体详见图2。
3年总生存率:对RFA组和TS组组间异质性检测得出I2=71%,P=0.00003,存在异质性,则用随机效应模型进行Meta分析,结果显示OR0.63,95%CI0.43~0.91,P=0.01,两组差异有统计学意义。具体详见图3。
5年总生存率:对RFA组和TS组组间异质性检测得出I2=47%,P=0.06,不存在异质性或者存在轻度异质性,则用固定效应模型进行Meta分析,结果显示OR0.46,95%CI0.39~0.54,P<0.00001,两组差异有统计学意义。具体详见图4。
2.3 1、3、5年无瘤生存率的Meta分析
1年无瘤生存率:对RFA组和TS组组间异质性检测得出I2=39%,P=0.11,不存在异质性,则用固定效应模型进行Meta分析,结果显示OR0.76,95%CI0.62~0.92,P=0.004,两组差异有统计学意义。具体详见图5。
3年无瘤生存率:对RFA组和TS组组间异质性检测得出I2=51%,P=0.04,存在异质性,则用随机效应模型进行Meta分析,结果显示OR=0.52,95%CI0.39,0.69,P<0.00001,两组差异有统计学意义。具体详见图6。
5年无瘤生存率:对RFA组和TS组组间异质性检测得出I2=9%,P=0.36,不存在异质性,则用固定效应模型进行Meta分析,结果显示OR0.51,95%CI0.43~0.62,P<0.00001,两组差异有统计学意义。具体详见图7。
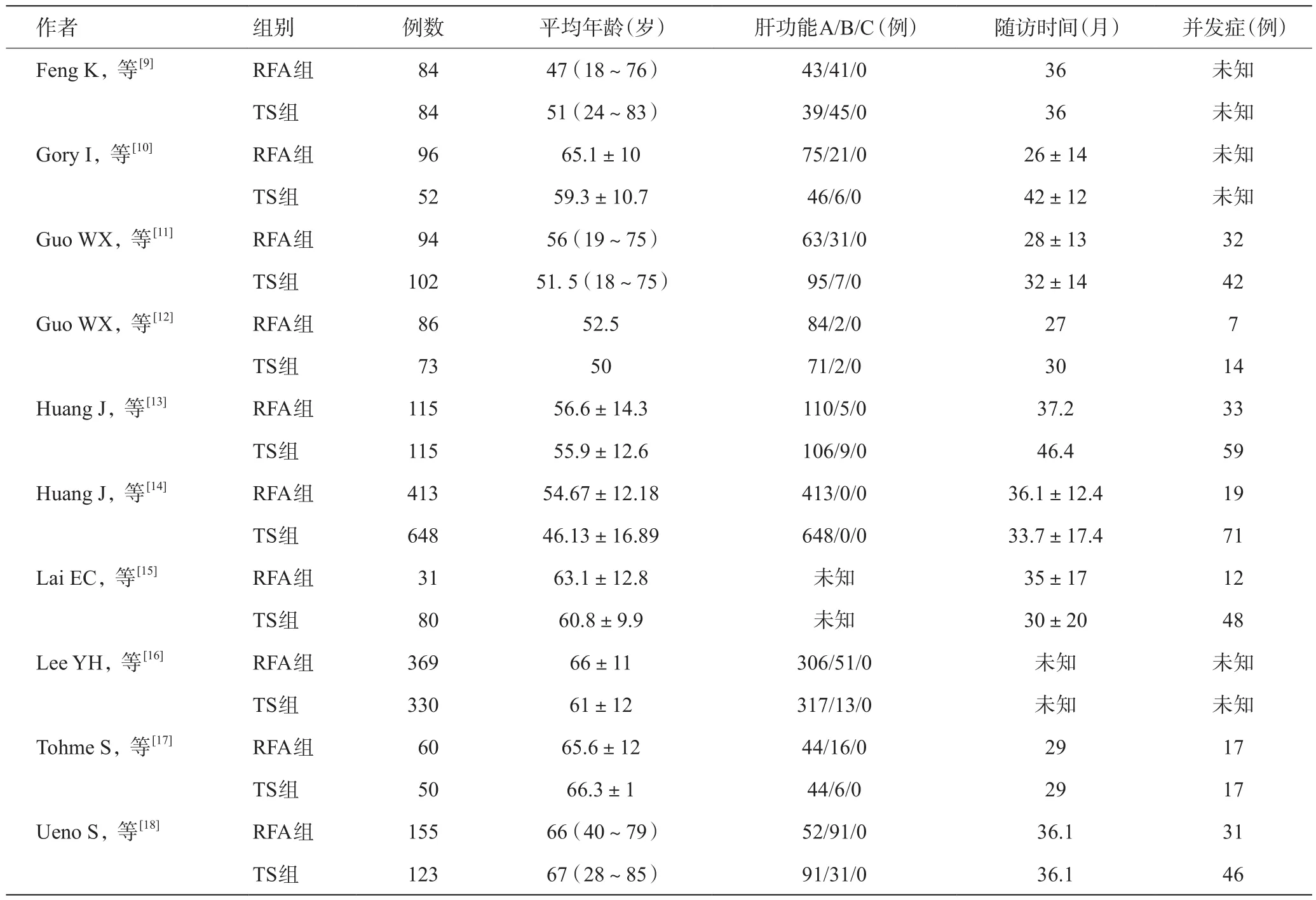
表1 患者基本情况
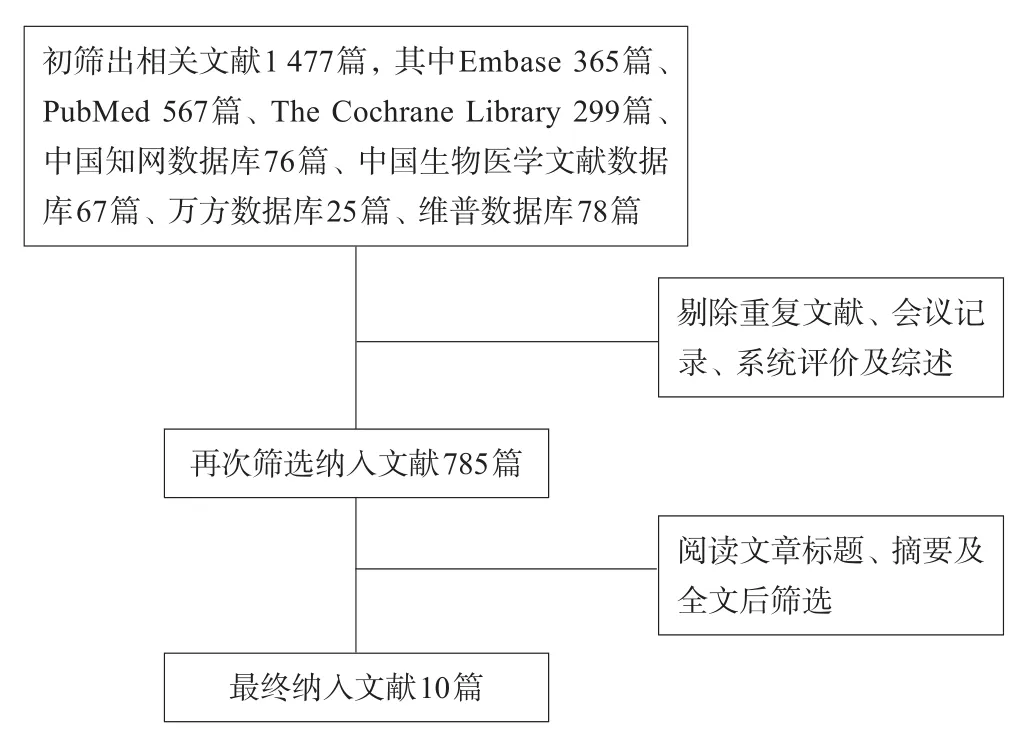
图1 文献检索流程图
2.4 并发症情况Meta分析
对RFA组和TS组组间异质性检测得出I2=0,P=0.52,不存在异质性,则用固定效应模型进行Meta分析,结果显示OR0.47,95%CI0.37~0.59,P<0.00001,两组差异有统计学意义。具体详见图8。
2.5 发表偏倚评价
各个研究漏斗图提示:散点基本对称并且呈倒漏斗状分布,故漏斗图提示无发表偏倚。具体详见图9。
3 讨论
小肝癌作为肝癌的一种常见类型,由于其处于肝癌的早期,临床表现往往不明显,故针对小肝癌的诊断和治疗显得尤其重要。研究发现,当肝癌直径≤3 cm时,手术切除和RFA可被作为一线治疗方法[19]。当小肝癌直径≥3 cm时,RFA的疗效不如手术切除。为了系统了解RFA和TS治疗小肝癌的效果,本研究在国内外多项研究的基础上,对RFA及TS的疗效和安全性进行Meta分析。
TS的优点在于医师在开腹的过程中对肿瘤进行精准定位,观察更为直观,进而能对于肿瘤病灶进行彻底清除[20]。而RFA的原理是在肿瘤内部插入电极,利用电热原理,使肿瘤细胞温度升高,达到变性、凝固,进而使其坏死[21]。其主要优点在于创伤小、并发症少、重复性强,进而能大幅缩短住院时间、减少住院费用,显著提高患者生活质量[22]。
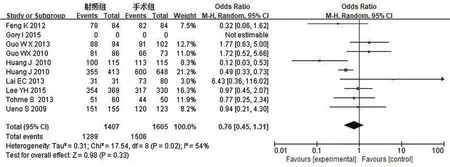
图2 1年总生存率Meta分析
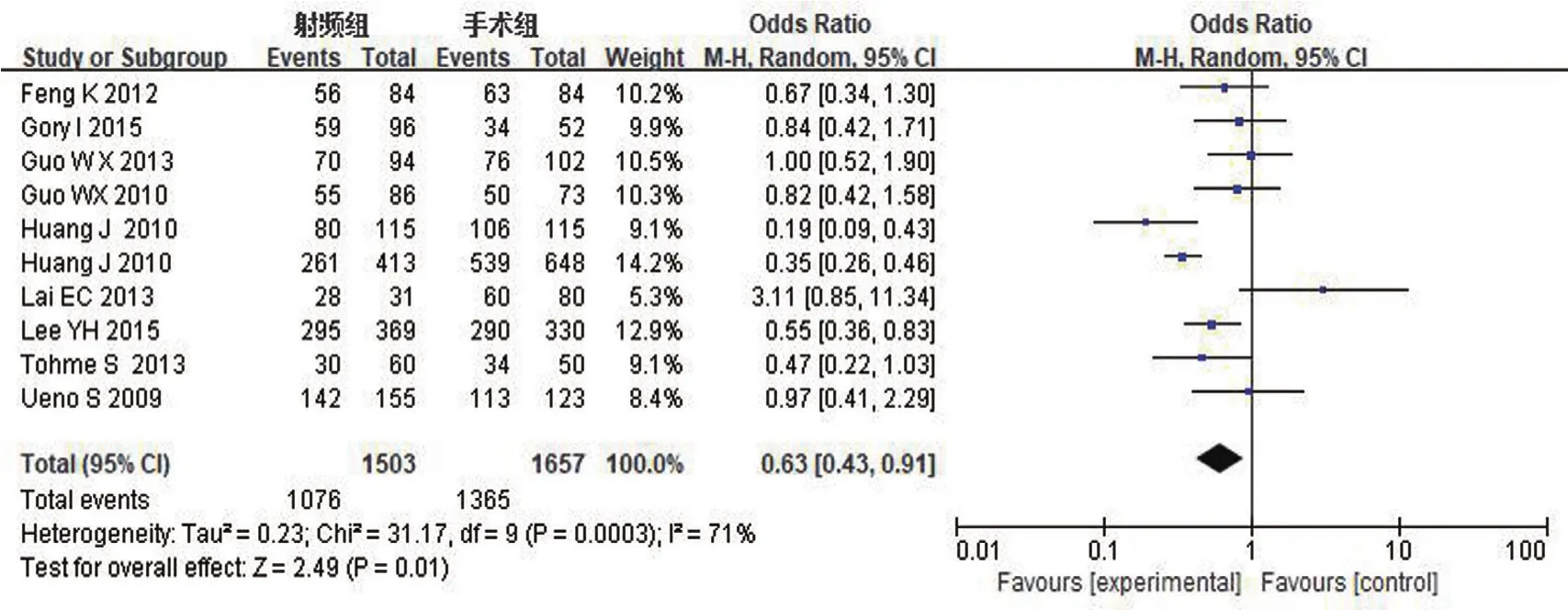
图3 3年总生存率Meta分析
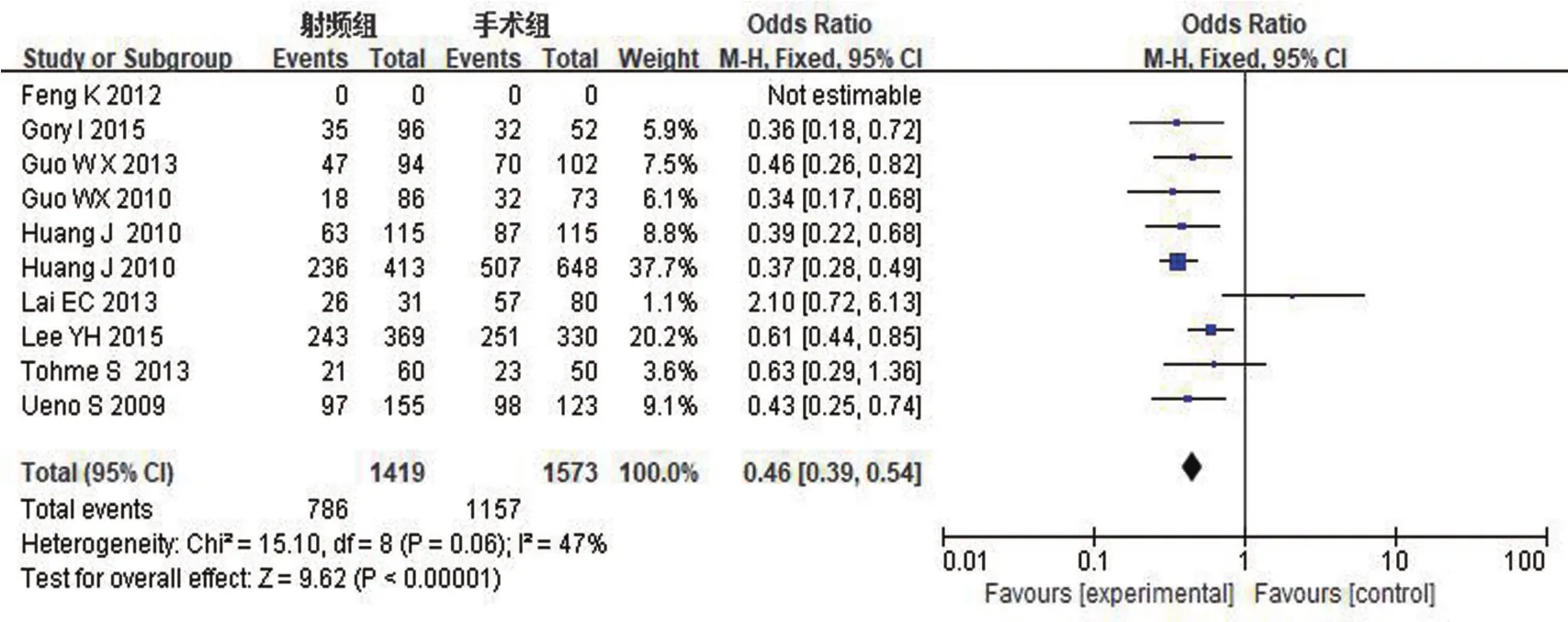
图4 5年总生存率Meta分析
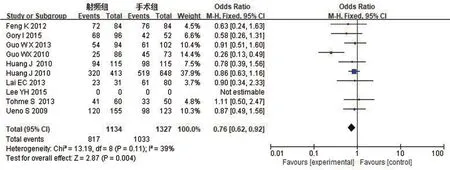
图5 1年无瘤生存率Meta分析
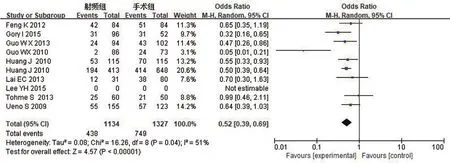
图6 3年无瘤生存率Meta分析
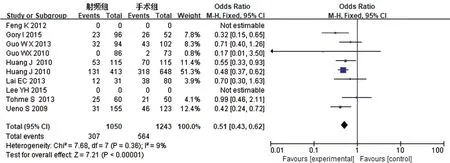
图7 5年无瘤生存率Meta分析
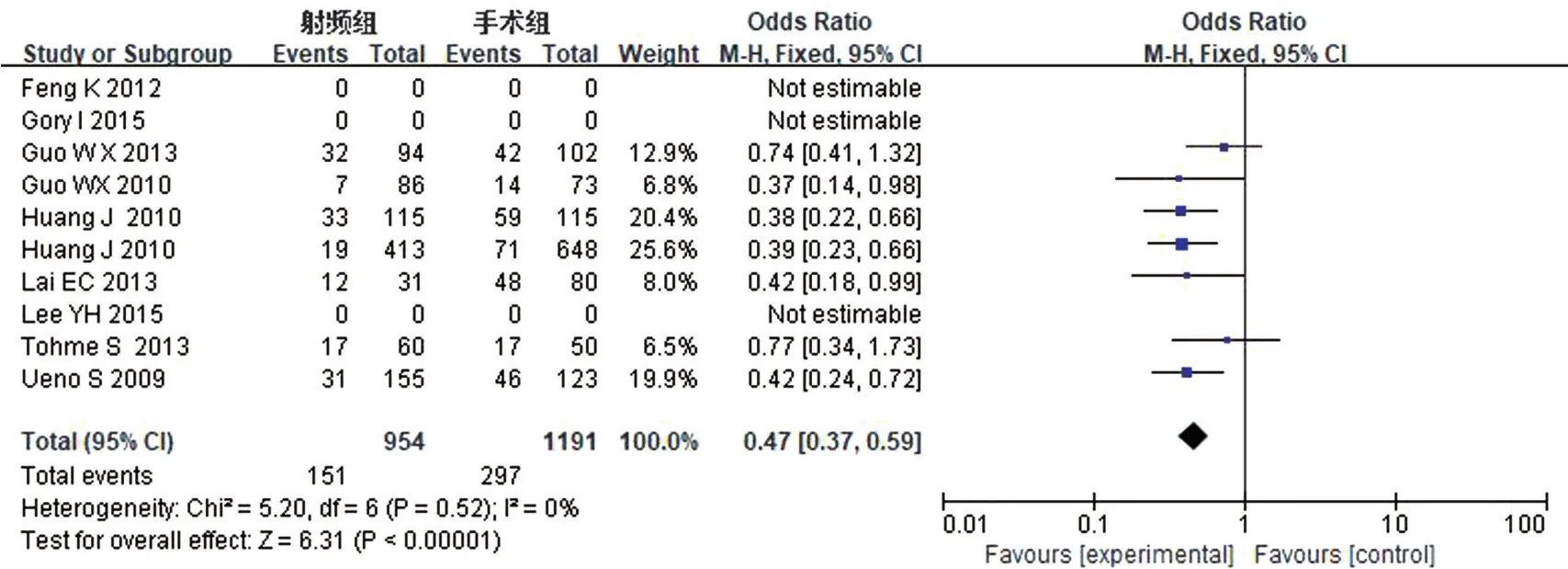
图8 并发症情况Meta分析
本研究共纳入10篇文献,RFA组共1 503例研究对象,TS组共1 657例研究对象,Meta分析结果表明:在1年总生存率方面,二者无统计学差异(P>0.05),而在3、5年总生存率和1、3、5年无瘤生存率方面,TS组患者的生存率高于RFA组,差异有统计学意义(P<0.05)。这可能是由于肝脏作为一个多重血供,多重分支的器官,其组织内部的温度非常容易受到多重血供以及各个分支的影响[23],还可能与RFA本身无法对于整个肝脏组织进行观察,进而容易使肿瘤本身周边的组织残留有关[24]。在并发症方面,RFA主要为热、穿刺相关的直接损伤等,TS主要为发热、出血、感染、加重肝功能损伤等[25]。本研究结果显示RFA组患者并发症发生率低于TS组患者,二者差异有统计学意义(P<0.05)。
然而,本研究也存在以下不足:(1)由于此次研究文献数目少,且总的样本量不大,结果偏倚可能较大;(2)纳入的文献主要来源于亚洲;(3)纳入的每项研究中无法获得每个患者的精确数据;(4)部分研究存在较大的异质性。
综上所述,在长期生存率方面,TS对于小肝癌的疗效要优于RFA,目前仍然可作为治疗小肝癌的首选治疗方法;但RFA并发症少,安全性较好。需要指出的是,此次研究纳入的文献数目仍较少,并且大部分研究的质量为C级,且无法对每一篇文献进行进一步的亚组分析,因此希望将来有更多的双盲、多中心、随机、大样本的对照实验,为临床医师针对小肝癌的诊疗提供更好的指导。
图9 各个研究漏斗图

