朝鲜蓟提取物颗粒剂的制备工艺研究
汤须崇,卢绍基,明艳林,邓爱华,牛文静
(1.华侨大学化工学院,福建 厦门 361021;2.厦门塔斯曼生物工程有限公司,福建 厦门 361027;3.福建省亚热带植物研究所,福建 厦门 361000;4.湖南文理学院生命与环境科学学院,湖南 常德 415000)
朝鲜蓟(Cynara scolymus)别名菊蓟、菜蓟、法国百合、荷花百合,为菊科(Compositae)菜蓟属多年生草本植物,原产地中海沿岸[1]。在欧美国家有较为广泛的种植,以法国栽培量最多。我国迄今已有100多年的朝鲜蓟栽培史,多在湖南、上海、浙江、北京、云南、湖北等地栽培[2]。朝鲜蓟是一种集药、食和观赏三用于一体的植物[3—5]。作为药用植物,欧洲将朝鲜蓟作为保护肝脏以及提高食欲的兴奋剂收入药典,记载朝鲜蓟可用于降低胆固醇,并具有利尿、保护肝脏等功效[5]。现代药理活性研究表明,朝鲜蓟具有抗氧化、降血脂、抗炎、抑制癌细胞增殖等作用,并对消化系统、心血管系统有保护及调节作用,可抑制脂肪酸的产生及改变肠道微生物群的组成[6]。其中含有多酚类[7]、黄酮类[8]、菊糖[9]、氨基酸[10]和矿质元素[11]等多种化学物质,而多酚类化合物作为朝鲜蓟主要功能性成分,对人体健康起着不可忽视的作用。
多酚类化合物是天然的抗氧化剂,能有效抵抗过量活性氧引起的氧化反应,且多种多酚类化合物的抗氧化活性强于维生素[12]。在保护肝肾和增强肝脏排毒功能、促进氨基酸代谢和抑制胆固醇生物合成和低密度脂蛋白氧化、治疗消化不良、改善胃肠功能、降低血脂、防止动脉硬化保护心血管、抗微生物作用等方面均有积极作用[13]。朝鲜蓟多酚类化合物的主要功效成分是洋蓟素(1,5-二咖啡酰尼酸)、绿原酸(3-咖啡酰奎尼酸)[14]。绿原酸可通过改善葡萄糖和脂质代谢发挥抗糖尿病作用,可以抑制糖异生关键酶G6Pase 活性,从而减少肠内葡萄糖转运和肝脏葡萄糖生成[15]。朝鲜蓟多酚提取物可抑制人肝癌HepG2 细胞生长增殖,并对正常肝细胞有一定的修复作用[16]。采用乙醇水溶液作为溶剂结合回流提取朝鲜蓟,再经冷冻干燥得到朝鲜蓟冻干粉,可便于对其进行制剂研究。
朝鲜蓟提取物中含有较多的糖类成分,粘度较高、吸湿性强,制成普通片剂、胶囊剂等剂型时会有分散性差、溶出度低、不易吸收等缺点[17]。朝鲜蓟提取物有较重的苦涩味,不易被患者接受。颗粒剂不仅具有溶解快、稀释快、作用快、生物利用度高等优点,还可通过添加矫味剂等掩盖朝鲜蓟提取物的不良风味[18]。本实验结合单因素试验与正交试验对朝鲜蓟提取物颗粒制备工艺进行优选,以颗粒合格率与溶解时间作为评价指标,考察乳糖:糊精、乙醇浓度、原料药比例、干燥温度等因素对其工艺进行优化,以期制备出溶解快、稀释快、作用快、生物利用度高的朝鲜蓟提取物颗粒剂,并为后续开发朝鲜蓟新剂型提供理论支持。
1 材料与仪器
1.1 材料与仪器
朝鲜蓟花苞由湖南常德广源生物科技有限公司提供。无水乳糖(批号20170803,镇江市康富生物工程有限公司)、糊精(批号171030C,辽宁东源药业有限公司)、淀粉(批号20180119,国药集团化学试剂有限公司)、甘露醇(批号18090202,郑州德旺化工产品有限公司)、甜菊糖苷(批号20180201,曲阜圣任制药有限公司)、阿司帕坦(批号103420170701,湖南尔康制药股份有限公司),其余试剂均为药用级。
DC-NSG-30 多功能提取浓缩回收机组(上海雅程仪器设备有限公司),Pilotot5-8M 真空冷冻干燥机(北京博医康实验仪器有限公司),600Y 老本行多功能粉碎机(铂欧五金厂),AR1502CN 电子天平、AR224CN 电子天平[奥豪斯国际贸易(上海)有限公司],DHG-9075A 鼓风干燥箱(上海一恒科学仪器有限公司),药典筛(新乡市同心机械有限责任公司),C-MAG HS7control 磁力搅拌器(德国IKA 仪器有限公司)。
1.2 朝鲜蓟提取物冻干粉制备
按照汤须崇等[19]的方法,取朝鲜蓟花蕾,冷冻干燥,制粉,加入12 倍量60%乙醇,回流提取2次,每次1.5 h,提取液分别滤过,合并滤液,回收溶剂,得到朝鲜蓟料液;选用截留相对分子量5 万Da~10 万Da 的超滤膜对朝鲜蓟料液进行超滤处理,虑液浓缩成50 ℃下相对密度为1.10~1.30 的清膏,冻干48 h,粉碎,即得朝鲜蓟提取物冻干粉。
1.3 朝鲜蓟颗粒制备
按处方比例称取朝鲜蓟提取物冻干粉、乳糖、糊精,采用等量递增法混合研磨均匀,倒入托盘并加适量乙醇溶液与淀粉浆,制软材,至软材呈现“握之成团,压之即散”状态。过16 目筛制粒,然后在电热鼓风干燥箱中干燥4 h,先过10 目筛,再过80目筛整粒,取中间颗粒即得朝鲜蓟合格颗粒剂。
1.4 评价指标测定
1.4.1 颗粒合格率测定
颗粒合格率(%)=合格颗粒质量/未过筛时颗粒质量×100%
参照《中国药典》(2020 版)通则0982 第二法双筛分法进行[20]。将干燥颗粒称重,依次过1 号筛和5 号筛,能通过1 号筛且不通过5 号筛的颗粒即为合格颗粒。取合格颗粒称重,计算颗粒成型率。如有15%颗粒不合格,即颗粒成型率低于85%,则粒度不合格。
1.4.2 溶解时间测定
按照《中国药典》(2020 版)通则0104“可溶颗粒检查法”进行[20]。取10 g 颗粒,加入热水200 mL,加以搅拌,测定全部颗粒溶化所需时间。如5 min后颗粒不能完全溶解,则颗粒溶化性不合格。
1.5 单因素实验
依据文献和预实验,称取5g 朝鲜蓟提取物冻干粉,根据“1.3 朝鲜蓟颗粒制备”方法,以乳糖:糊精=3:1、10%淀粉浆、70%乙醇溶液、干燥温度70 ℃为固定量,考察辅料配比、原料药比例、乙醇浓度与干燥温度以及甜味剂种类等因素对颗粒剂成型率及溶化时间的影响。乳糖与糊精质量比例设为1:2、1:1、2:1、3:1、4:1,乙醇浓度设为40%、50%、60%、70%、80%,原料药比例5%、6%、7%、8%、9%、10%,干燥温度分别为40 ℃、50 ℃、70 ℃、90 ℃、110 ℃,甜味剂选用阿司帕坦、蔗糖、甜菊糖苷等3 种,用量0.01 g,200 mL 水冲泡,品尝口感。
1.6 验证实验及质量检查
按照最佳工艺条件,称取3 份朝鲜蓟提取物冻干粉,并按照“1.3 朝鲜蓟颗粒制备”操作。
性状检查:应干燥,粒径均匀,色泽一致,无吸潮、软化、结块、潮解等现象。
粒度测定:依照“1.4.1 颗粒合格率测定”操作。
水分测定:参照《中国药典》(2020 版)通则0832水分测定烘干法[20]。取供试品2 g,平铺于干燥至恒重的扁形称量瓶,厚度不超过5 mm。精密称定,开启瓶盖在100~105 ℃下干燥5 h。盖好瓶盖移至干燥器内放冷,精密称定。连续两次称重差异不超过5 mg 为止。除另有规定外,水分不超过8%。
干燥失重测定:参照《中国药典》(2020 版)通则0831 干燥失重法测定[20]。于105 ℃干燥(含糖颗粒在80 ℃减压干燥)至恒重,减失重量不超过2.0%。
溶化性测定:参照“1.4.2 溶解时间测定”操作。
2 结果与分析
2.1 单因素分析
2.1.1 乳糖:糊精比例筛选
由图1 可知,随着乳糖:糊精比例增大,颗粒剂合格率呈缓慢上升,说明增加乳糖有利于颗粒成型;溶化时间则一直下降,即乳糖比例增加有利于颗粒溶解。但乳糖比例过高会导致颗粒粘连,颗粒难以烘干整粒。为降低成本,可适当降低乳糖比例、增加较廉价的糊精。而糊精为不溶性辅料,比例过高会影响颗粒溶化性。因此选择乳糖:糊精=3:1 作为最佳辅料配比。

图1 辅料配比对颗粒合格率及溶化时间的影响Fig.1 Effect of the ratio of excipients on the qualified rate and dissolution time of particles
2.1.2 乙醇浓度筛选
根据图2 可得,颗粒合格率随着乙醇浓度增加,在40%~60%范围内先上升后在60%~95%范围内呈下降趋势。在乙醇浓度为60%时,颗粒合格率达到最高,为90.67%。这可能是由于乙醇浓度过高会导致颗粒过软过小,低浓度乙醇溶液含水量较高使得制粒干燥后颗粒过硬。溶化时间与合格率呈相反趋势,随着乙醇浓度增加颗粒溶解时间先降低后上升。同样在乙醇浓度为60%时,溶化时间最短。因此制粒过程中乙醇溶液最佳浓度选择60%。
2.1.3 原料药比例筛选
由图3 可得,朝鲜蓟提取物比例为5%时,显示颗粒合格率为90.05%,之后随着朝鲜蓟提取物比例的增加颗粒合格率持续降低。溶化时间在原料药比例为5%时为46 s,然后随着原料药比例增加溶化时间变化较快,逐渐延长。综合考虑,朝鲜蓟提取物比例为5%,相比于其他浓度,在节约成本的同时又可兼顾药效问题。

图2 乙醇浓度对颗粒合格率及溶化时间的影响Fig.2 Effect of ethanol concentration on qualified rate and dissolution time of particles
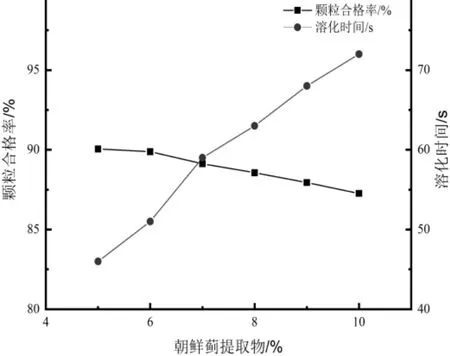
图3 原料药比例对颗粒合格率及溶化时间的影响Fig.3 Effect of the proportion of raw materials on the qualified rate and dissolution time
2.1.4 干燥温度筛选
从图4 可见,颗粒合格率在干燥温度40~50 ℃时呈较大幅度提升,50~60 ℃之间颗粒剂合格率较平缓增长,在70 ℃干燥温度下,颗粒合格率达最高89.34%,此后温度升高颗粒剂合格率下降。溶化时间在40~70 ℃之间持续下降,同样地在干燥温度为70 ℃时,溶化时间出现转折点,达最小值。因此,选择70 ℃为最佳干燥温度,此温度下朝鲜剂提取物颗粒合格率最高、溶化时间最短。
2.1.5 甜味剂种类筛选
选择阿司帕坦、蔗糖、甜菊糖苷加入颗粒剂对其进行口感评价并选出最佳甜味剂。在乳糖:糊精=3:1,原料朝鲜蓟提取物7%的条件下,加入相同质量的阿司帕坦、蔗糖、甜菊糖苷,口感测评。由表1 可看出,阿司帕坦较甜,味道比较正常。蔗糖则几乎没有甜味,而甜菊糖苷较甜,但口感中含有苦涩。因此阿司帕坦应是最优选择。

图4 干燥温度对颗粒合格率及溶化时间的影响Fig.4 Effect of drying temperature on qualified rate and dissolution time of particles

表1 不同种类甜味剂口感评价Table 1 Taste evaluation table for different kinds of sweeteners
2.2 正交设计优选朝鲜蓟颗粒最佳制备条件
2.2.1 正交试验水平设计
根据单因素试验分析,选取辅料配比、原料药比例、乙醇浓度与干燥温度为考察因素,建立四因素三水平的正交试验(表2),通过颗粒合格率与溶化时间评价选取朝鲜蓟提取物颗粒的最佳制备工艺。

表2 正交实验因素水平Table 2 Orthogonal experiment factor level table
2.2.2 不同因素对颗粒合格率与溶化时间的影响
根据表2 的四因素三水平表,采用L9(34)正交表试验,考察四因素对颗粒合格率的影响作用大小。
由表3 可知,在四个因素中,对颗粒合格率的影响作用依次为A>B>C>D,即乳糖:糊精比例对颗粒合格率影响最大,乙醇浓度、原料药比例次之,干燥温度影响最小。由于考察指标为颗粒合格率,其值越大越好。比较表3 中k值大小,最优工艺组合为A2B2C2D3。结合方差分析,因素A、B、C、D对颗粒合格率无显著作用。综合考虑实际结果,选择最佳工艺组合为A2B2C3D1,即乳糖:糊精=3:1,乙醇浓度60%,原料比例7%,干燥温度50 ℃。
从四因素对颗粒溶化时间的影响来看,因溶化时间指标越小越好,故选择k值最小的水平作为最优工艺水平。表3 中理论最优水平组合为A3B2C1D1;根据已有的实验结果,实际最优水平组合为A3B2C1D3。根据极差分析,各因素对溶化时间影响大小为A>C>B>D。方差分析显示,A、B、C、D各因素对溶化时间并无显著影响,可根据实际情况调整。取最佳工艺组合为A3B2C1D3,即乳糖:糊精=4:1,乙醇浓度60%,原料比例5%,干燥温度90 ℃。
因四因素对溶化时间影响不显著,最佳工艺选择以颗粒合格率为主要考量。故选择A2B2C3D1为最佳工艺组合,即乳糖:糊精=3:1,乙醇浓度60%,原料比例7%,干燥温度50 ℃。
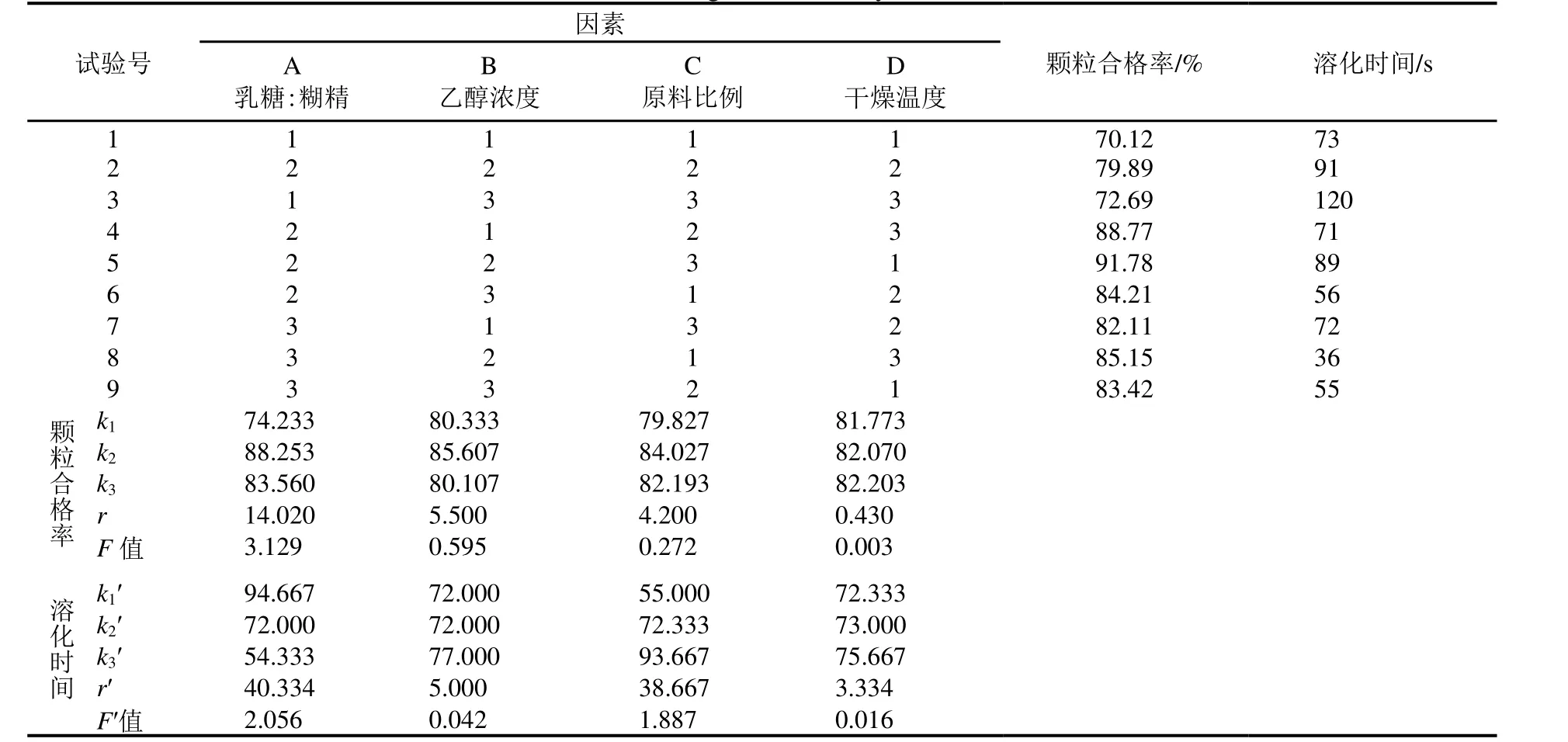
表3 正交试验分析Table 3 Orthogonal test analysis results
2.3 验证实验及质量检查
在乳糖:糊精=3:1、乙醇浓度60%、原料比例7%、干燥温度50 ℃的最佳制备条件下,进行三组验证实验,并对所得颗粒进行质量检查。
性状检查:三组朝鲜蓟颗粒外观稍有差异,颗粒均已干燥,色泽呈土黄色较均匀,无吸潮、软化、结块、潮解等现象,满足颗粒剂的性状要求。
粒度测定:三组朝鲜蓟提取物颗粒的合格率分别为91.13%、91.67%、91.54%,取其平均值91.45%,与中国药典中粒度要求相符,即颗粒成型率不低于85%,符合《中国药典》(2020)规范。
水分测定:三组朝鲜蓟提取物颗粒2 g 烘干后恒重为1.8994 g、1.9037 g、1.9031 g,平均为1.9021 g,其含水量4.90%,小于8%,符合《中国药典》(2020)规范。
干燥失重测定:三组朝鲜蓟提取物颗粒分别取1 g 置于与供试品相同条件下干燥至恒重的扁形称量瓶于105 ℃干燥至恒重,精密称定,其恒重分别为0.983 g、0.987 g、0.995 g,减失重量小于0.02 g,符合《中国药典》(2020)规范。
溶化性测定:参照“1.4.2 溶解时间测定”操作,三组颗粒溶解时间分别为87 s、86 s、84 s,平均溶解时间为85.67 s,远小于300 s,达到《中国药典》(2020)要求。
3 结论
朝鲜蓟中的多酚类化合物洋蓟素、绿原酸等分子结构中有酯键不饱和双键及多个酚羟基,是抗氧化作用的主要功能物质,能对氧化作用极强的自由基和活性氧(ROS)强效清除[21]。因此通过乙醇回流提取朝鲜蓟多酚类化合物洋蓟素、绿原酸等,去除杂质,富集其有效成分,再制成冻干粉有利于后续剂型研究。将朝鲜蓟提取物制成颗粒剂,可通过辅料添加使药物性质稳定,掩盖朝鲜蓟提取物苦涩口感,加快溶解速率。
本研究首先通过单因素实验考察辅料配比、原料药比例、乙醇浓度与干燥温度以及甜味剂种类对颗粒剂成型率及溶化时间的影响,再同时考虑辅料配比、原料药比例、乙醇浓度及干燥温度四个因素,采用L9(34)正交试验选出最佳因素水平组合,优选出朝鲜蓟提取物颗粒最佳制备工艺。最终朝鲜蓟提取物颗粒剂的最优制备工艺为乳糖:糊精=3:1,乙醇浓度60 %,原料比例7%,干燥温度50 ℃。正交试验方差分析也显示,辅料配比即乳糖:糊精是影响朝鲜蓟提取物颗粒合格率的显著因素。此条件下,三组验证实验所得颗粒依据《中国药典》(2020)要求进行质量检查,均符合规定。说明优选得到的最优制备工艺可为后续开发朝鲜蓟新剂型提供理论支持。

