南方红豆杉产IAA 内生芽胞杆菌的分离、鉴定及产脂肽类化合物研究
董蒙蒙,袁 博,徐玲霞,曹小迎,蒋继宏
(江苏师范大学生命科学学院/ 江苏省药用植物生物技术重点实验室,江苏 徐州 221116)
红豆杉是红豆杉科红豆杉属植物的总称,主要分布在北半球,是我国国家一级珍稀保护树种,是世界公认的濒临灭绝的天然珍稀抗癌植物[1—2],其有效抗癌成分是紫杉醇。紫杉醇最早由美国化学家Wani 等[3]在1963 年从短叶红豆杉(Taxus brevifolia)中分离获得,并确定为一种三环二萜生物碱类化合物。紫杉醇可有效抑制癌细胞的增生繁殖且副作用小,在临床上被广泛用于乳腺癌、卵巢癌和部分头颈癌以及肺癌治疗[4—6]。但是,在自然条件下红豆杉生长缓慢,且紫杉醇主要存在于树皮中,含量低,这是目前制约紫杉醇应用的最大瓶颈。虽然目前已有报道通过人工全合成法可获得紫杉醇单体,但成本较高,产率较低,合成工艺对环境也不友好,难以满足目前对紫杉醇的需求[7—10]。提高天然状态下紫杉醇的合成速率和含量成为目前研究的热点和难点之一。
植物内生菌是指一定阶段或全阶段生活在健康植物的组织和器官内部而又不引起宿主植物明显病害的真菌或细菌。在长期进化中,内生菌与宿主协同进化,并对宿主具有一定的促进作用,甚至一些内生菌可以产生和宿主相同或相似的化合物。1993年Strobel等[11]首次从太平洋短叶红豆杉树皮中分离到一株能产生紫杉醇的内生真菌,此后陆续有报道发现产紫杉醇及紫杉烷类化合物的内生真菌,因此人们对于红豆杉内生真菌的研究越来越多。相比较而言,对于内生细菌的研究较少[12—13]。有研究表明,植物内生菌与其宿主生长具有一定的关联,因此从促生角度筛选、评价是红豆杉内生细菌提高宿主代谢成分研究的重要切入点。
芽胞杆菌是广泛存在于土壤与植物微生态中的微生物种群[14],因其具有较强的抗逆能力及抗菌防病作用而被用于生物防治领域[15—16]。如苏云金芽胞杆菌被广泛用作微生物杀虫剂,枯草芽胞杆菌可产生脂肽类抑菌物质[17—18]。芽胞杆菌的生防作用机制主要有竞争作用、诱导植物抗性作用、拮抗作用和促进植物生长作用[19]。其中在促进植物生长方面尤以产IAA 较为普遍,IAA 是植物六大内源激素之一,可以促进植物生长,在植物生长发育过程中具有重要作用。植物在生长发育过程中伴随着病害的干扰,而某些芽胞杆菌也可以产生一些脂肽类抑菌物质,如表面活性素(Surfactin)、伊枯草菌素(Iturin)和丰原素(Fengycin),这些物质可以有效保护植物免受病原菌入侵。本文以湖北星斗山自然保护区的南方红豆杉(Taxus wallichianavar.mairei)为样品,对其内生细菌进行分离鉴定、产IAA 菌株筛选以及产脂肽类化合物研究,以期为森林资源保护及生物菌肥生产提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验材料
内生细菌分离样品为采自湖北星斗山自然保护区健康成熟的南方红豆杉新鲜植物组织,采摘后置于冰盒暂存。
1.1.2 培养基
LB:蛋白胨10.0 g,酵母浸出粉5.0 g,氯化钠10.0 g,蒸馏水1000 mL,琼脂15~20 g,pH 7.0~7.2。
NA:牛肉浸膏3.0 g,蛋白胨5.0 g,葡萄糖2.5 g,蒸馏水1000 mL,琼脂15~20 g,pH 7.0~7.2。
有氮培养基:葡萄糖10.0 g,硫酸铵1.0 g,磷酸氢二钾2.0 g,七水硫酸镁0.5 g,氯化钠0.1 g,酵母膏0.5 g,碳酸钙0.5 g,蒸馏水1000 mL,pH 7.0~7.2。
1.2 内生细菌分离
参照文献的方法对红豆杉根茎叶植物组织消毒[20—21],并在无菌条件下研磨。加一定量无菌水于分离培养基平板上稀释涂布,然后置于30 ℃培养箱。待细菌长出后,挑取单菌落四区划线纯化培养,甘油保存。
1.3 内生细菌鉴定
将分离纯化的菌株摇床培养,使用CTAB 结合溶菌酶的方法提取细菌总DNA[22],细菌16S rDNA序列扩增使用通用引物27F(5′-CAGAGTTTGATCC TGGCT-3′)、1492R(5′-AGGAGGTGATCCAGCCGC A-3′)。PCR 反应体系:27F(10 μmol·L-1)、1492R(10 μmol·L-1)及DNA 模板各1 µL,Mix(2×HiFi-PCR Master) 12.5 µL,加无菌双蒸水至25 µL。PCR 反应条件:94 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,共35 个循环;72 ℃ 10 min。PCR 产物使用1%琼脂糖凝胶电泳检测后送上海生工测序。将测序结果提交EzBioCloud (https://www.ezbiocloud.net/)数据库检索并下载相似性较高的相关菌株16S rRNA 基因序列,分别用MUSUAL 及MEGA7.0 软件进行序列比对分析,最后使用邻接法(Neighbor-Joining,NJ)构建系统进化树,并做系统发育分析。
1.4 产IAA 菌株筛选
将分离的内生菌株在液体LB 培养基中摇床过夜培养成种子液,将种子液按1%接种量接种于含色氨酸终浓度为0.5 mg·mL-1有氮液体培养基,30 ℃、200 r·min-1摇床暗培养5 d,每株菌3 次重复。参照文献对培养的发酵液萃取[23—24],低于40 ℃将萃取的乙酸乙酯相蒸干,加入2 mL 甲醇洗出蒸干物质,过0.22 µm 有机相滤膜后使用。使用高效液相色谱-高分辨飞行质谱测定IAA 含量,色谱条件如下:Halo C18色谱柱(4.6×150 mm,3 μm);流动相为水(0.1%甲酸,A)-甲醇(0.1% 甲酸,B),比例为25:75;梯度洗脱,流速0.4 mL·min-1。质谱条件:电喷雾电离离子源正离子模式(ESI+),离子源温度550 ℃,电压4500 V,碰撞电压70 eV,去簇电压30 eV,取130m/z为吲哚乙酸目标定量离子,检测限0.0015~0.5388 μg·L-1,在5~200 μg·L-1范围内线性良好。
1.5 内生菌产脂肽类化合物能力分析
按 1.4 方法获得菌株发酵液提取物,利用HPLC-TOFMS 对提取物的脂肽类化合物进行分离、鉴定,结合数据库分析筛选菌株所产脂肽类化合物种类及含量差异。色谱条件:Halo C18色谱柱(4.6×150 mm,3 μm),流动相水(0.1%甲酸,A)-乙腈(0.1%甲酸,B),梯度洗脱,流速0.5 mL·min-1。梯度洗脱程序如下:0~20 min 内,B 的比例从60%降至5.0%,并保持10 min。质谱条件:电喷雾电离离子源正离子(EIS+)模式,离子源温度400 ℃,碰撞电压50 eV,去簇电压10 eV,扫描范围100~2000m/z。
1.6 数据统计
使用Grapad prism 8.0 软件进行t检验,以±SD表示误差。
2 结果与分析
2.1 内生细菌分离与鉴定
从南方红豆杉根茎叶中共分离内生细菌31 株,其中根18 株,茎8 株,叶5 株。通过形态学观察及16S rDNA 序列得知,根中18 株内生细菌均为厚壁菌门芽胞杆菌纲芽胞杆菌目菌株,其中1 株为Paenibacillaceae 科Brevibacillus菌株;1 株为动球菌科Viridibacillus菌株;其余16 株均为芽胞杆菌科芽胞杆菌属菌株,芽胞杆菌在根中属于优势属。茎中8 株菌主要分布在3 个门:厚壁菌门、放线菌门、变形菌门;4 个纲:芽胞杆菌纲、放线菌纲、α-变形菌纲、γ-变形菌纲;4 个目:芽胞杆菌目、微球菌目、红杆菌目、Lysobacaterales 目;4 个科:芽胞杆菌科、微杆菌科、红杆菌科、Lysobacteraceae 科;4 个属:芽胞杆菌属、微杆菌属、副球菌属、Xanthomonas属。叶中5 株菌主要分布在厚壁菌门和变形菌门,2个纲:芽胞杆菌纲、α-变形菌纲;2 个目:芽胞杆菌目、鞘脂单胞菌目;2 个科:芽胞杆菌目、鞘脂单胞菌科;2 个属:芽胞杆菌属、鞘脂单胞菌属(图1)。
2.2 产IAA 菌株筛选
采用HPLC 法检测样品IAA 含量。结果表明,31 株内生细菌中有20 株菌株具有产IAA 能力,其中根14 株,茎4 株,叶2 株。根叶中产IAA 菌株均为芽胞杆菌属,而茎中4 株产IAA 菌株分别为微杆菌属、芽胞杆菌属、副球菌属、Xanthomonas属。同时从根中筛选出一株高产IAA 菌株,编号为KLBMPTC10,是芽胞杆菌属菌株,产IAA 含量达210.3955±0.81 μg·L-1,芽胞杆菌属菌株KLBMPTC31最低,可产IAA 0.2869±0.02 μg·L-1(图2)。

图1 基于16S rRNA 基因序列的南方红豆杉分离菌株系统发育树Fig.1 Phylogenetic tree of the bacteria from Taxus wallichiana var.mairei based on the 16S rRNA gene sequences
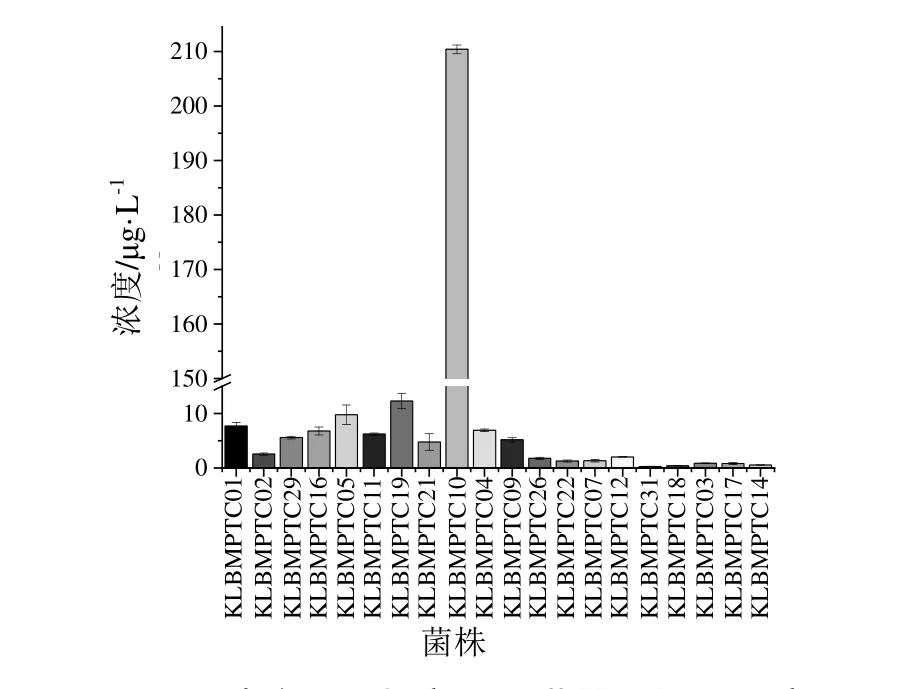
图2 南方红豆杉产IAA 菌株及其IAA 产量Fig.2 IAA producing strains and contents in Taxus wallichiana var.mairei
2.3 内生细菌产脂肽类化合物
利用LC-TOF-MS 对细菌提取物进行分离,通过自建的细菌代谢产物库,对产脂肽能力进行筛选,目标脂肽见表1,以分子离子峰强度进行相对含量计算,结果如图3。
从红豆杉分离获得的内生细菌脂肽类化合物约22 种(表1),通过定量可以看出每株内生细菌的脂肽类化合物在种类和含量上都有显著差异。从图3 可知,菌株KLBMPTC10 所产脂肽类化合物最丰富,且含量比其他菌株高。其次是菌株KLBMPTC19、KLBMPTC01、KLBMPTC02 和KLBMPTC29。
利用LC-MS/MS 技术对菌株KLBMPTC10、KLBMPTC01 和KLBMPTC29 中的两种典型的芽胞杆菌脂肽类化合物Surfactin 和Iturin A2进行定量分析,并以实验室前期获得的一株专利菌株Bacillus amyloliquefaciensCGMCC5569 为阳性对照进行对比(图4)。分离获得的三株内生细菌所产Surfactin和Iturin A2与对照差异显著。其中菌株KLBMPTC29产Surfactin 能力优于其他两株菌,相对含量为(24.47±4.05)%,菌株KLBMPTC10 产Iturin A2能力优于其他两株菌,相对含量为(26.06±2.68)%。
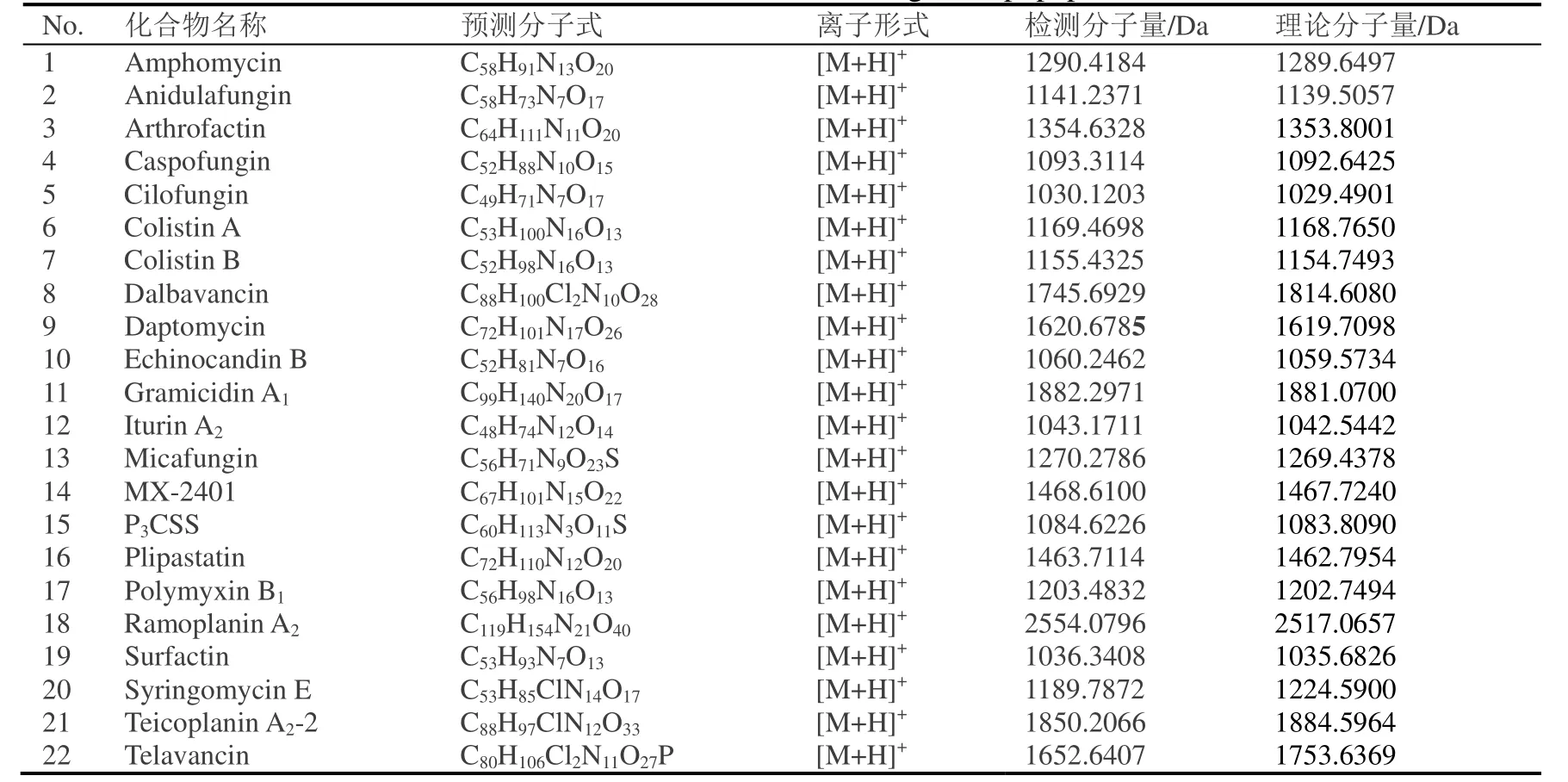
表1 目标脂肽化合物筛选信息Table 1 The mass information of targeted lipopeptides
3 讨论与结论
内生细菌多为植物内有益寄生菌,在长期的植物进化和系统发育过程中与宿主建立了和谐互惠的关系[25]。植物内部环境稳定,可使内生细菌不受外界环境影响,同时内生细菌可增强植物的环境适应能力。内生细菌具有重要的生态和管理作用,还能作为潜在的生防资源和外源基因载体[26—27]。

图3 南方红豆杉内生菌产脂肽类化合物聚类分析Fig.3 Cluster analysis of lipopeptide compounds produced by endophytic bacteria of Taxus wallichiana var.mairei

图4 基于LC-MS/MS 计算的3 株内生细菌两种典型脂肽类化合物含量Fig.4 Quantitative calculation of two typic lipopeptides in three endophytic bacteria strains based on LC-MS/MS
目前国内外对植物内生细菌研究较多,但主要集中于内生细菌多样性以及拮抗实验研究。本实验室前期对红豆杉内生放线菌资源有较为系统的研究[28]。国内外文献对红豆杉内生真菌研究居多[29—31],但对红豆杉,尤其是南方红豆杉内生细菌研究较少。芽胞杆菌是一类常见的细菌,在农业、工业、医药生产方面都具有广泛的应用[32—33],尤其以促进宿主生长为特色,成为目前微生物菌剂的重要选择菌株之一。芽胞杆菌还可以产生许多对真菌、细菌以及病毒具有显著抑制效果的物质,产生的伊枯草菌素(Iturin)和表面活性素(Surfactin)已在农业上应用[34]。研究表明,植物内生细菌可产生多种植物促生物质,如吲哚乙酸、赤霉素、细胞分裂素等[35]。产IAA 的内生菌再回接到宿主植物时大都能促进宿主植物生长[36—37]。本研究分离获得的芽胞杆菌是产IAA 能力较强的一类菌。芽胞杆菌属分泌的吲哚乙酸和赤霉素可促进植物的生长。本研究通过HPLC-TOF-MS精确定量了各个菌株产IAA 能力,结果表明菌株KLBMPTC10 产 IAA 能力最强,含量可达210.3955±0.81 μg·L-1。同时利用HPLC-TOF-MS 对各个菌株脂肽类化合物种类和相对含量进行定性、定量分析。结果表明,KLBMPTC10 菌株是南方红豆杉内生细菌中产脂肽类化合物最丰富的,该菌产Iturin A2能力优于其他菌株,含量达(26.06±2.68)%。而Iturin 类化合物具有显著抑制真菌生长的活性。因此综合以上结论推测,KLBMPTC10 菌株在促生和生防方面都具有重要的潜力,作为红豆杉内生菌,该菌一方面具有提高宿主红豆杉生长发育的潜能,另一方面对可能存在的病原真菌等病菌具有拮抗作用的潜力,因此可以进一步开发研究,为全面开发红豆杉资源提供思路和研究基础。

