白细胞介素32基因多态性与慢性牙周炎易感性的关系▲
郝云菲 桑国耀 徐 隽
(新疆医科大学第一附属医院1 牙周黏膜科,2 医学检验中心,乌鲁木齐市 830011,电子邮箱:181134151@qq.com)
慢性牙周炎(chronic periodontitis,CP)是一种牙菌斑微生物感染导致的炎症性疾病,该病可以通过破坏牙周组织产生持续的过度免疫反应[1]。研究表明,基因位点变异在牙周炎的发病机制中扮演了重要的角色[2]。白细胞介素(interleukin,IL)-32是一种炎症调控因子,在炎症反应中起着关键作用,同时, IL-32也参与了机体免疫应答反应[3]。最近的研究显示,IL-32基因多态性与炎症免疫性疾病的发病密切相关,例如系统性红斑狼疮、结核性病变以及多发性硬化[4-6]。然而,目前有关IL-32基因多态性和CP遗传易感性之间关系的研究较少见,故本研究探讨IL-32基因多态性和CP易感性的关系。
1 资料与方法
1.1 临床资料 选取2016年1 月至2018年 12月于新疆医科大学第一附属医院就诊的487例CP患者为观察组。临床分型轻型291例(59.8%),重型196例(40.2%);病变局部型227例(46.6%),病变广泛型260例(53.4%)。所有患者的诊断和分型均符合1999年牙周疾病分类国际研讨会制定的CP诊断标准[7]。另采用随机抽样法选取来我院例行体检的530例同地区的健康个体作为对照组,与观察组的个体均无血缘关系。所有研究对象排除标准:合并全身性疾病(高血压、糖尿病、心血管疾病、肝肾功能不全、感染性疾病、自身免疫性疾病以及肿瘤)、药物性牙龈增生、妊娠以及因任何疾病而需长期药物治疗的患者。两组研究对象的性别、年龄以及民族比较,差异均无统计学意义(均P>0.05),见表1。本研究经过新疆医科大学第一附属医院伦理委员会批准,所有研究对象均对本研究知情同意。

表1 两组研究对象基线资料比较
1.2 方法
1.2.1 DNA的提取及基因型检测:取两组研究对象清晨空腹肘静脉血2~5 mL置于乙二胺四乙酸抗凝管中,于-80℃长期保存。采用改良碘化钠法提取DNA,试剂盒购自Seebio公司(批号:XB1645),于-80℃保存备用。IL-32的3个基因位点rs28372698、rs12934561以及rs11861531引物序列见表2。IL-32的PCR 扩增反应体系共20 μL,包含0.5 μL反应物、3.5 μL去离子、5 μL缓冲液,灭菌双蒸水补足至20 μL。PCR反应条件为95℃ 10 min变性,92℃ 15 s,60℃ 1 min,共75个循环。实时荧光定量PCR仪购自Applied Biosystems公司(型号:QuantStudioTM7 Flex)。采用 GeneMapper 4.5软件进行基因分型。
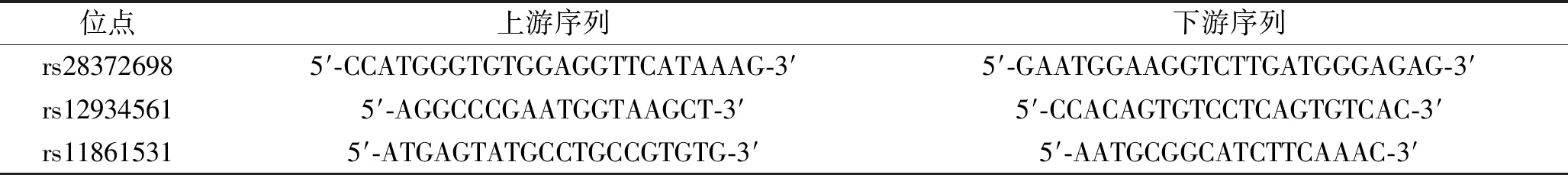
表2 IL-32基因位点rs28372698、rs12934561及rs1186153引物序列
1.2.2 血清IL-32水平检测:取1.2.1采集的血样5 000 r/min离心10 min,吸取上层血清,采用酶联免疫吸附测定法检测血清IL-32的表达水平(观察组患者未接受治疗),试剂盒购自Elabscience公司 (批号:E-EL-H0216c),严格按照说明书进行操作。
1.3 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用t检验或Mann-Whitneyu检验,多组间的比较采用单因素方差分析;计数资料以例数和百分比表示,比较采用Kruskal-WallisH检验;采用Hardy-Weinberg定律检验两组基因型是否符合遗传平衡。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组IL-32基因型和等位基因频率的比较 IL-32基因位点rs28372698的基因型为AA、AT、TT,位点rs11861531的基因型为CC、CT、TT,位点rs12934561的基因型为CC、CT、TT。两组3个基因位点的频率分布均符合Hardy-Weinberg遗传平衡(均P>0.05)。两组IL-32基因位点rs28372698基因型分布、等位基因频率差异均有统计学意义(均P<0.05)。而两组IL-32基因位点rs12934561和rs11861531的基因型、等位基因频率差异均无统计学意义(均P>0.05)。见表3。

表3 两组IL-32基因3个位点基因型和等位基因频率比较[n(%)]
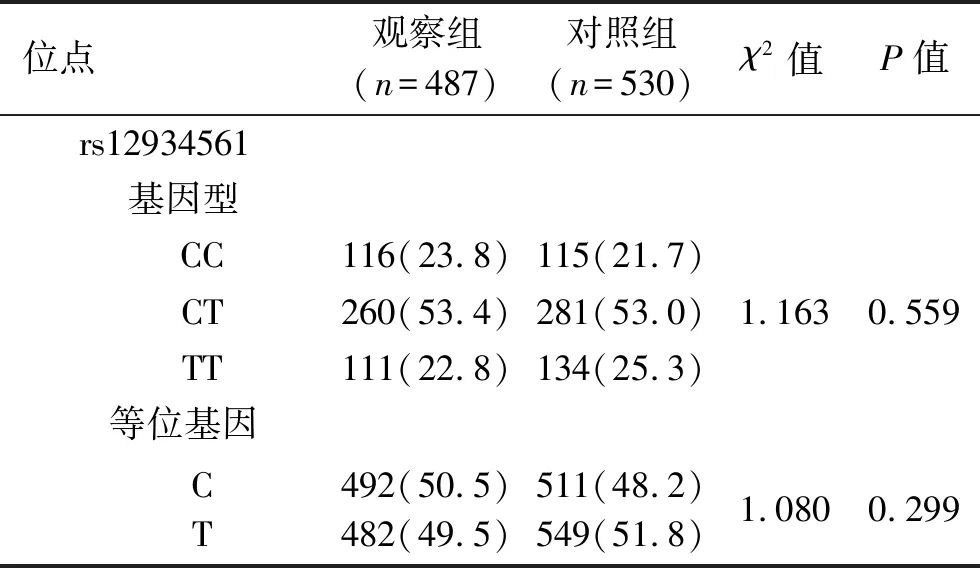
续表3
2.2 两组之间以及不同基因型CP患者之间血清IL-32表达水平比较 观察组血清IL-32水平为(266.8±37.9)pg/mL,高于对照组的(129.5±20.6)pg/mL(t=72.551,P<0.001)。IL-32基因位点rs28372698 AT、TT和AA基因型 CP患者之间血清IL-32 表达水平差异有统计学意义(P<0.05),其中AT和TT基因型CP患者血清IL-32 表达水平高于AA基因型CP患者(均P<0.05),AT型和TT基因型CP患者血清IL-32的表达水平差异无统计学意义(P>0.05),见表4。
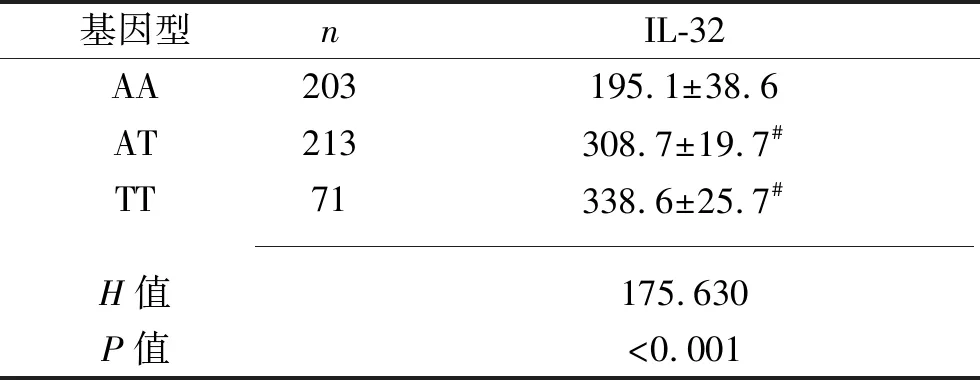
表4 血清IL-32在IL-32基因位点rs28372698不同基因型CP患者中的表达水平(x±s,pg/mL)
注:与AA基因型 CP患者相比,#P<0.05。
3 讨 论
在0.1%基因组DNA中,人类有200~300万个单核苷酸多态性,位于非编码区的单核苷酸多态性可以调控基因表达,位于编码区的单核苷酸多态性可以改变蛋白质序列,常常引起生物功能的改变[8]。IL-32在1992年被首次报道,其主要在激活的T细胞和自然杀伤细胞中高度表达,IL-32基因位于染色体16p13.3,包含8个外显子和6个亚型[9]。IL-32基因多态性与众多疾病密切相关,例如rs12934561位点内含子的基因易感性和急性肺损伤的严重程度相关[10], rs28372698位点变异和甲状腺相关癌症存在密切联系,这种基因变异导致血清IL-32基因表达增加[11],而纯合子IL-32基因的rs28372698位点变异会增加胃癌的发病风险[12]。
近年来,有研究表明,单核苷酸多态性与CP密切相关[13-14]。而炎症和免疫因素参与了CP的发病机制,并可加速CP的发展[15],许多炎症标记物的基因位点突变可导致CP发病,比如IL-6、IL-10以及肿瘤坏死因子[16]。有研究证实,作为促炎细胞因子和内源性调节因子,IL-32 的合成可以增加上述炎症因子的表达,同时IL-32的表达也促进各种趋化因子的合成和分泌[17]。此外,IL-32可以促进核因子κB信号通路的激活,而核因子κB信号通路可以调控炎症相关因子基质金属蛋白酶2和9的高表达[18-19]。因此,IL-32基因相应位点的变异可能参与了CP的发病机制,增加了CP的易感性。本研究结果显示,观察组血清IL-32水平高于对照组,且两组IL-32基因位点rs28372698基因型分布、等位基因频率差异有统计学意义(均P<0.05),这提示IL-32基因位点 rs28372698与CP发病存在联系。此外,IL-32基因位点 rs28372698 AT、TT和AA基因型的 CP患者之间血清IL-32表达水平差异有统计学意义(P<0.05),其中AT和TT基因型 CP患者血清IL-32 表达水平高于AA基因型CP患者(P<0.05),这表明CP患者IL-32基因rs28372698位点A/T的变异可能参与了CP的发病过程。
总之,CP的发病机制至今没有完全阐明,环境、基因以及遗传因素均参与了CP的发病。IL-32基因位点rs28372698 多态性可能增加了CP易感性,其中等位基因A/T变异或与CP的发病密切相关。

