构建脆性X染色体综合征患者来源的诱导多能干细胞系*
包勤敏,梁栋,乔凤昌,王艳,马定远,张翠平,胡平,许争峰
(南京医科大学附属妇产医院产前诊断中心,南京 210004)
脆性X综合征(fragile X syndrome,FXS,OMIM 300624)是遗传性智力低下最常见的原因之一[1]。FXS是由于FMR1基因(位于Xq27.3)5′非翻译区CGG重复扩增导致其所编码的脆性X智力低下蛋白(fragile X mental retardation protein,FMRP)功能缺失的疾病[2]。FXS以男性发病为主,主要临床表现为重度智力低下、大耳朵、大睾丸、大下巴等[3]。FXS可通过PCR扩增结合微流控毛细管电泳技术检测X染色体上FMR1基因5′UTR区CGG三核苷酸重复数而确诊。人诱导多能干细胞(human induced stem cells,hiPSCs)具有多向分化和自我更新增殖能力,近年来成为疾病模型研究的热点[4]。本研究拟利用本课题组前期建立的非整合技术进行人外周血单核细胞(PBMC)重编程的技术平台[5],建立2例FXS患者的PBMC来源的iPSCs细胞系,为FXS的临床研究提供体外细胞模型。
1 材料和方法
1.1主要试剂及仪器 Ficoll淋巴细胞分离液(天津灏洋公司);仙台病毒重编程试剂盒、Rock抑制剂、stemPro-34 培养液(美国Life technology公司);细胞冻存液、10%二甲亚砜(DMSO)、Geltrex基底膜、DPBS、StemFlex培养液(美国Thermo公司);Triton-X(美国Sigma公司);小牛血清BSA、无胰蛋白酶EDTA、小鼠抗人TRA-1-60单克隆抗体、小鼠抗人TRA-1-81单克隆抗体、小鼠抗人SSEA4单克隆抗体、DAPI染液、山羊抗小鼠488荧光二抗、山羊抗兔555荧光二抗、0.2 g/L明胶、兔抗人叉头蛋白A2(FOXA2)单克隆抗体、兔抗人心肌钙蛋白1(c-TN1)多克隆抗体、兔抗人β微管蛋白(b-Ⅲ-Tubulin)多克隆抗体(英国Abcam公司);cDNA逆转录试剂盒、DNA提取试剂盒、FragilEaseTMFragile X PCR试剂盒(美国Perkin Elmer公司);SanPrep柱式PCR产物纯化试剂盒(上海生工公司)。ST16离心机、NanoDrop紫外分光光度计(美国Thermo公司);荧光倒置显微镜(德国Leica公司);Gel Doc XR凝胶成像分析仪(美国Bio-Rad公司);Allegra X-12R离心机(美国Beckman Coulter公司)。
1.2患者PBMC的分离和冻存 于2019年1月至6月在南京市妇幼保健院产前诊断中心采集2例FXS全突变男性患者(分别为5岁和24岁)新鲜的外周血5 mL,2例先证者在本院均通过PCR扩增结合微流控毛细管电泳技术确诊为脆性X综合征,先证者母亲Ⅰ∶2均为前突变携带者,家系2中Ⅱ∶2为女性全突变携带者(图1)。本研究经南京市妇幼保健院医学伦理委员会审核批准(宁妇伦字[2019]KY-003),各研究对象均知情同意。根据Ficoll淋巴细胞分离液说明书操作提取PBMC,用含10% DMSO的细胞冻存液重悬,经-80 ℃冻存过夜后置于液氮中长期保存。

注:Ⅱ∶1为先证者;Ⅰ∶2为先证者母亲前突变携带者;家系2中Ⅱ:2为全突变携带者。
图1 2例脆性X患者家系图谱
1.3仙台病毒(sendai virus,SeV)方法重编程PBMC 将冻存的PBMC复苏后,用PBMC完全培养液(含100 ng/μL SCF、100 ng/μL Flt-3、20 ng/μL IL-3、20 ng/μL IL-6的StemPro-34培养液)调整细胞密度至1×106/mL,接种至24孔细胞培养板,置于37 ℃、5% CO2、饱和湿度条件下连续培养4 d,每天半数换液。用台盼蓝染液进行活细胞染色计数,调整细胞密度至1×105/孔,按照KOS(感染复数multiplicityof infection,MOI)=5,hc-Myc MOI=5,hKlf4 MOI=3,病毒滴度按KOS=1.4×108、c-Myc=1.5×108、Klf4=1.2×108计算病毒使用量,公式:病毒使用量(μL)=[MOI(CIU/cell)×细胞数量]/[病毒滴度(CIU/mL)×10-3(μL/mL)]计算所需病毒量,在1 mL培养液分别加入含KOS、c-Myc和Klf4的仙台病毒(仙台病毒重编程试剂盒提供),置于37 ℃、5% CO2、饱和湿度条件下培养24 h,弃去含病毒的培养液,将感染后的细胞分别按1×104/孔、5×104/孔、1×105/孔的细胞密度转移至Geltrex基底膜基质包被的6孔细胞培养板中,用不含细胞因子的StemPro-34培养液半换液,3 d后更换为StemFlex培养液。2~3周后,出现大小不一的克隆,挑选合适大小的形态上类似胚胎干细胞的克隆,用5 mL无菌注射器针头切割并转移至Geltrex基底膜基质包被的细胞培养板中,按照胚胎干细胞方法进行传代、扩大培养、鉴定和冻存。
1.4iPSCs细胞系的培养和传代 取1.3中构建的iPSCs,用StemFlex培养液调整细胞密度至2×104/mL,加入至Gletrex包被的6孔细胞培养板中,置于37 ℃、5% CO2、饱和湿度条件下培养。每24 h更换新鲜StemFlex培养液,当细胞融合度达80%时进行传代。为了保证克隆均一性,前5代用机械切割法进行单克隆传代,5代后使用0.1 mmol/L EDTA消化传代,传代时加入10 μmol/L Rock抑制剂,置于37 ℃、5% CO2、饱和湿度条件下培养24 h,每日换液。取该细胞用于细胞传代和后期细胞实验。
1.5核型分析 取上述成功建立细胞系的iPSCs进行培养,细胞生长至对数期时,加入0.2 μg/mL秋水仙素处理26 min,后用10 g/L柠檬酸三钠在37 ℃水浴锅内消化细胞10 min,1 700 r/min离心10 min,弃上清液,充分吹打混匀收集细胞。用甲醇与冰醋酸(体积比为3∶1) 溶液固定3次,用滴管将细胞悬液滴在经0 ℃冰水浸泡的洁净载玻片上并吹散,酒精灯烤干后置55~60 ℃烤箱中烤片过夜。用预温的1 g/L胰蛋白酶消化10~15 s,10倍稀释后的Giemsa染色液染色1 min,高倍显微镜下观察分裂中期细胞染色体,并用GSL-120扫描仪获取细胞核型图,用Cytovision软件对其进行结果分析。
1.6iPSCs多能性鉴定
1.6.1免疫荧光染色 将成功建系的稳定iPSCs传代至12孔细胞培养板中,待克隆生长至合适大小,将培养液吸弃,预热后的PBS轻柔洗涤2次,加入4%多聚甲醛(PFA),室温固定1 h,PBS洗涤3次后使用含0.1% TritonX-100通透30 min,用含1%小牛血清(BSA)的PBST封闭1 h。分别加入小鼠抗人TRA-1-60单克隆抗体,小鼠抗人TRA-1-81单克隆抗体,小鼠抗人SSEA4单克隆抗体(均为1∶100稀释)4 ℃过夜。加入PBST后置于摇床上震摇30 min,重复3次。加入山羊抗小鼠荧光二抗(1∶1 000稀释),室温避光静置2 h。避光条件下PBS洗涤3次后,加入3 μmol/L DAPI染液,室温避光静置10 min后吸弃DAPI染液,PBST洗涤1次,加入1 mL PBS,并在荧光倒置显微镜下观察及拍照。
1.6.2体外拟胚体EB形成和分化试验 将1.3中成功构建的iPSCs按1×105/mL的密度传代至6孔细胞培养板中,待细胞融合度大于80%时,使用0.1 mmol/L EDTA将iPSCs室温消化3 min,并用含4 mg/mL聚乙烯醇(PVA)、10 μmol/L ROCK抑制剂的StemFlex培养液将克隆吹打成单细胞悬液,接种至超低吸附Petri培养板中。置于37 ℃、5% CO2、饱和湿度条件下培养24 h。使用EB培养液[Knockout DMEM 83 mL、血清替代物KSR 15 mL、谷氨酰胺Glutamax 1 mL、非必需氨基酸NEAA 1 mL]隔天半数换液。7 d后将透亮的拟胚体转移至1%明胶包被的24孔细胞培养板中,每孔15~30个。加入含10% FBS的EB培养液,置于37 ℃、5% CO2、饱和湿度条件下培养2周。待EB贴壁后使用外胚层标志基因——抗人β微管蛋白(b-Ⅲ-Tubulin)抗体(1∶200稀释)、中胚层标志基因——抗人心肌钙蛋白Ⅰ(c-TNI)抗体(1∶400稀释)和内胚层标志基因——FOXA2抗体(1∶500稀释)对迁出的细胞进行免疫荧光染色(方法同1.6.1)。当染色的结果显示荧光可被检测时,表明贴壁的拟胚体已定向分化为相应胚层的细胞,以此鉴定拟胚体具有向三胚层多能分化的能力。
1.6.3逆转录PCR(RT-PCR) 取正常传代至第10代iPSCs(约1×106个),用0.1 mmol/L EDTA消化。用Trizol法提取细胞的总RNA,NanoDrop紫外分光光度计检测RNA浓度和纯度,选择浓度>100 ng/μL,吸光度(A260/280 nm)>2.0的RNA样本,按照cDNA逆转录试剂盒说明书操作将1 μL RNA逆转录为cDNA。引物设计序列按照参考文献[5],由苏州金唯智生物科技公司合成。采用RT-PCR检测iPSCs标志性基因OCT4、SOX2、NANOG的表达水平,以GAPDH作为内参照。PCR反应体系为20 μL。包括cDNA模板1 μL,10 μmol/L上、下游引物各1 μL,PCR Mixture 10 μL,ddH2O 7 μL。PCR循环参数为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环30次;72 ℃延伸5 min。PCR产物行0.2 g/L琼脂糖凝胶电泳并用凝胶成像系统扫描并拍照。
1.7CGG重复数测定
1.7.1DNA提取及测定 取1.3中成功构建的iPSCs细胞系和患者原代PBMC,严格按照DNA提取试剂盒说明书操作提取人类基因组DNA,紫外分光光度计进行DNA浓度测定,取DNA浓度≥12.5 ng/μL,DNA总量>480 ng,吸光度(A260/280 nm)比值在1.8~2.0之间;A260/230 nm>1.0的样本用于后续试验。
1.7.2PCR扩增及纯化 按照FragilEaseTMFragile X PCR试剂盒说明书进行PCR扩增。PCR循环参数:95 ℃预变性5 min;98 ℃变性35 s,59 ℃退火35 s,72 ℃延伸4 min,循环25次;72 ℃延伸10 min。采用SanPrep柱式PCR产物纯化试剂盒对PCR产物进行纯化。
1.7.3PCR产物微流控毛细管电泳分析 采用微流控毛细管电泳仪(PerkinElmer/Caliper Lab Chip®MultiDx)及单吸管微流体芯片对96孔细胞培养板中的样本进行DNA片段大小分析。采用Labchip MultiDx图标软件导出结果。
1.7.4软件分析 电泳结果的数据利用FraXsoftTM分析软件(PerkinElmer公司)绘制标准曲线,并计算待测样本CGG三联重复序列的拷贝数。
2 结果
2.1患者来源的iPSCs细胞系的建立 仙台病毒感染的PBMCs培养至15 d,镜下可见细胞贴壁生长,呈铺路石状,细胞团间有明显边界,形态光整。细胞核质比较高,核仁明显,细胞排列紧密,传代得到的细胞高核质比,核仁明显,细胞排列紧密呈铺路石样,边缘清晰的克隆样细胞团(图2)。在克隆样细胞团中,挑选多个细胞团进行传代,最终成功建立iPSCs细胞系。
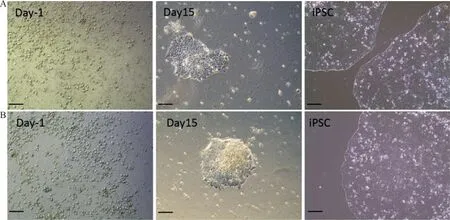
注:A,先证者1的PBMC及重编程后细胞形态;B,先证者2的PBMC及重编程后细胞形态;Day-1,加入病毒前1 d的PBMCs;Day15,加入病毒后15 d的PBMCs;iPSC,第5代hPBMC-iPSC克隆;比例尺标识为100 μm;放大倍数(×100)。
图2 2例先证者PBMC进行重编程的结果
2.2细胞染色体核型分析 对已成功建立细胞系的患者来源的PBMC-iPSCs传代至第10代后进行染色体核型分析,结果显示细胞可保持正常核型46,XY,重编程后的iPSCs染色体核型并未发生改变,表明该构建体系能够成功获得核型正常,且不含外源性基因的iPSCs(图3)。

注:A,先证者1第10代细胞核型(46,XY);B,先证者2第10代细胞核型(46,XY)。
2.3iPSCs多能性鉴定
2.3.1iPSCs表面标志物表达的鉴定 免疫荧光染色结果显示,未分化的iPSCs克隆样干细胞的多能性标志物抗原TRA-1-60,TRA-1-81,SSEA-4的表达均呈阳性(图4)。
2.3.2拟胚体分化试验 对iPSCs向三胚层分化能力进行检测,结果发现iPSCs可悬浮培养形成拟胚体,并且这些拟胚体在贴壁培养2周后,对贴壁生长的细胞进行免疫荧光染色,可分别发现其外、中、内三胚层标志基因b-Ⅲ-Tubulin、c-TN1、FOXA2的表达呈阳性。表明建立的iPSCs细胞系具有向三胚层分化的能力(图5)。

注:A,先证者1的免疫荧光染色结果;B,先证者2的免疫荧光染色结果;比例尺标识为100 μm;放大倍数(×100)。
图4 2例先证者iPSCs表面标志物表达的鉴定

注:A,先证者1的三胚层分化鉴定结果;B,先证者2的三胚层分化鉴定结果;b-Ⅲ-Tubulin抗体鉴定外胚层细胞的分化;c-TNI抗体鉴定中胚层细胞的分化;FOXA2抗体鉴定内胚层细胞的分化;比例尺标识为100 μm;放大倍数(×100)。
图5 2例先证者三胚层分化鉴定试验
2.3.3干细胞标志性基因的RT-PCR检测结果 成功建系的iPSCs中,其干细胞标志性基因OCT4、SOX2、NANOG在iPSCs中均呈阳性表达(图6)。

注:1,Oct4基因(141 bp);2,Sox2基因(447 bp);3,NANOG基因(206 bp);4,GAPDH基因(137 bp)。
图6 RT-PCR检测iPSCs干细胞标志基因Oct4、Sox2、NANOG及GAPDH的表达
2.4DNA提取和CGG重复数测定 对所建立的iPSCs细胞系和患者PBMC,利用PCR扩增结合微流控毛细管电泳技术检测X染色体上FMR1基因5′UTR区CGG三核苷酸重复数,结果显示重编程前后的CGG重复数无差异(图7)。
3 讨论
脆性X综合征是最常见的遗传性认知障碍,严重危害儿童生长发育,无有效治疗方法[6]。目前已建立了许多FXS转基因和基因敲除动物模型[7-9],但没有一种能够准确完整地再现患者常见的遗传表型。事实上,来自遗传性疾病患者的iPSCs的制备不涉及胚胎细胞,回避了伦理学问题。另一方面将患者来源的体细胞重编程得到的hiPSCs已经被证实能够在体外模拟疾病的特征,也可以在体外被定向诱导分化为相应表型[10-11]。因此,由FXS患者来源的体细胞或患病的胚胎组织中直接取材,诱导分化为iPSCs,以此研究FXS胎儿发育过程中的分子机制,为探索FXS相关组织和/或发育阶段提供了便利。
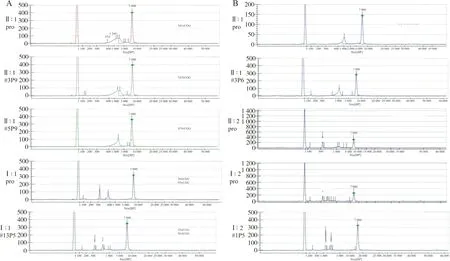
注:A,家系1的毛细管电泳结果;B,家系2的毛细管电泳结果;pro,PBMC重编程前;#mPn,表示第m号克隆第n代iPSC重编程后毛细管电泳结果;右上角的数据为相应细胞CGG重复数;横坐标为检测序列大小(bp),纵坐标为荧光信号峰值。
图7 重编程前后毛细管电泳的结果
本研究中,我们通过2例FXS家系患者的PBMCs,利用人OKSM转录4个因子及非整合重编程技术,成功将其重编程为iPSCs。进一步通过特异性免疫荧光染色、体外诱导分化为三胚层等方法鉴定获得的iPSCs具有多能性,此外,采用G显带技术检测证实该iPSCs核型正常。本研究利用PCR扩增结合微流控毛细管电泳技术证实,使用非整合重编程技术前后CGG重复数无明显差异。虽然患者来源iPS细胞在再生医学和人类遗传疾病建模方面具有显著的优势,但在用于研究FXS时仍存在一些潜在的限制,如可能造成额外染色体异常,以及重编程过程可能增加CGG重复数目的不稳定性等[12]。值得注意的是,本研究得到的2个iPS细胞系重编程前后核型均正常,CGG重复数目无明显差异,成功保留了CGG重复的全突变长度。本研究结果表明,通过仙台病毒进行的非整合重编程过程并未造成CGG重复的不稳定,所获得的不同CGG拷贝数FXS-iPSC为FXS深入研究提供良好的平台和重要的临床干细胞资源。然而,我们仍然需要进一步探讨这些细胞系如何模拟体内的分子和细胞通路等,以及更好地评估CGG拷贝数不同导致疾病在iPSC水平的表型差异。近年来,通过CRISPR/Cas9基因编辑技术在FXS-iPSC全突变等位基因中切除扩增的CGG并激活FMR1,可以促进功能性FMRP的重新产生,但某些相关信号通路和功能是否能够全面恢复仍然是个值得深入研究的问题[13-15]。未来通过FXS-iPSC在这些方面的研究将有助于阐明FXS的基本机制和治疗潜力。
综上所述,由患者来源的iPSCs可成为研究遗传病的良好疾病模型。通过将其定向诱导分化为与疾病表型相关的细胞类型,并对其进行生理、生化等各项检测,这些诱导分化细胞类型亦可用于药物筛查,为移植生成替代细胞,或作为纠正致病突变/缺失的基因编辑的起始材料。而本研究采用X连锁遗传性疾病患者来源的iPSCs,其保留了突变染色体,并且iPSCs有分化成人体各个类型细胞的潜能,这为以后的研究提供了取之不尽的细胞资源。

