外源六价铬在土壤中的有效性及其小麦毒性效应
彭叶棉,杨阳,侯素霞,程鹏飞,宋旭昕,杨泽胜,刘同旭*
1. 中国科学院广州地球化学研究所,广东 广州 510640;2. 广东省生态环境技术研究所/广东省农业环境综合治理重点实验室,广东 广州 510650;3. 中国科学院大学,北京 100039;4. 邢台职业技术学院资源与环境工程系,河北 邢台 054000;5. 华南土壤污染控制与修复国家地方联合工程研究中心,广东 广州 510650
铬(Cr)因为熔点、沸点高,硬度大,抗腐蚀性强等特点而在中国高科技工业领域中占重要地位(阳伦庄等,2010)。铬同时也是土壤、沉积物和地下水中第二常见的金属污染物,其广泛应用于电镀、制革、印染、造纸、纺织、化肥、农药制造等工业领域,产生人为和自然释放铬污染的过程进而导致严重的环境问题(Singh et al.,2013;Xia et al.,2019)。铬在土壤生态中会影响土壤酶、微生物等的活性,提高了土壤生态的安全风险,超量的铬还会对植物光合作用和营养吸收产生不利影响(Cai et al.,2019)。此外,植物中积累的铬通过食物链进入人体,会导致皮炎、支气管炎、结核病等,也增加了人类罹患癌症的风险。
铬的各种价态中,Cr(VI)和Cr(III)是最常见、最稳定的形式。Cr(VI)是一种强氧化剂,以四面体氧化物的形式存在,具有致癌性、诱变性和致畸性(Choppala et al.,2013;Zhitkovich,2011)。Cr(VI)在土壤中具有高流动性和植物毒性,而Cr(III)相对更稳定,更容易被土壤颗粒固持,且在环境中毒性较低(Brown et al.,1999)。Cr(VI)对动物、人类和植物均为有害物质,但Cr(III)是动物和人体的重要组成成分,而Cr(III)是否为植物必需元素仍存在争议(Gardea-Torresdey et al.,2005)。Sharma et al.(2003)认为,铬并非植物的必需元素,Cr(III)也不是植物必需的营养物质。此外,已有研究表明,外源Cr(III)进入土壤环境后,主要以Cr(III)的形式存在,而Cr(VI)处理的土壤中,大部分铬容易转化为Cr(III) (Han et al.,2004;Chen et al.,2010)。毒性不同的Cr(VI)和Cr(III)在环境中的有效态含量也存在差异,它们可以在土壤环境中相互转换,这使得土壤-植物体系内铬有效性较难评估。中国目前农田土壤中铬污染的风险评估依然缺乏统一标准,因此建立适用于农田土壤的铬有效性评价模型具有重要意义。
大量关于铬在土壤-植物体系有效性的研究采用全量铬作为评价因子,但全量铬与土壤中的生物有效态铬含量具有较大差异,这些评估方法依然有待完善(Muhammad et al.,2017)。McLaughlin et al.(2014)的认为土壤中提取态的化学物质可作为生物积累或毒性的预测因子,其研究结果表明提取态铬与有效态铬具有很好的关联性。于是本研究以小麦(TriticumL.)根伸长为测试终点,以提取态铬及其价态分配作为模型参数,建立了区分Cr(VI)和Cr(III)毒性作用的预测模型。该研究可以补充中国土壤铬的植物毒性数据,也为建立农田土壤中铬的环境质量标准提供了依据。
1 材料和方法
1.1 试验材料
供试的6种典型农田土壤来自中国 6个不同地区,土壤取样深度为0—20 cm,风干后研磨,过0.15 mm的尼龙筛。对土壤样品进行了pH、阳离子交换能力(CEC)、有机质、非晶质铁、锰、铝氧化物等性质的测定(鲁如坤,2000),比表面积(BET)采用BET氮吸附法测定(Wang et al.,2018)。土壤中全量铬的测定使用石墨炉消解法(HNO3-HF-HClO4)(15:2:2,V/V)对供试土壤样品进行消解处理(Li et al.,2016),植物样品用HNO3-HClO4(5:1,V/V)溶液进行消解(Yang et al.,2017)。采用电感耦合等离子体发射光谱法(ICP-OES,Optima 8000,PerkinElmer,USA)测定总铬含量,使用紫外可见分光光度计(TU-1950,普析,中国)测量其中的Cr(VI)含量。供试土壤基本理化性质如表1所示。

表1 供试土壤基本理化性质Table 1 Physical and chemical characteristics of selected soils
1.2 试验设计
1.2.1 污染土壤的制备
外源添加一定量Cr(VI)污染液到盛装土壤的培养器皿中,混合均匀,配制成不同质量浓度的铬污染土(编号如表2所示),每个处理3个重复。保持持水量 (70%±5%),老化平衡1个月后进行小麦根伸长测试,并测定污染土壤的提取态总铬和Cr(VI)含量(备注:Cr(III)含量等于总铬含量减去Cr(VI)含量)。提取态铬的测定使用 1 mol·L-1NH4OAc(pH=5)进行化学提取(Yu et al.,2002)。

表2 不同处理水平污染土壤的Cr质量比Table 2 Chromium concentration of polluted soils with different treatment levels
1.2.2 小麦根伸长测试
试验所用小麦种子由刘志勇研究员提供(中国科学院遗传与发育生物学研究所,北京)。小麦种子催芽后移植到塑料花盆中,埋入土壤约 1 cm深处,定期浇水,5 d后采样。试验在恒温培养室内进行,生长条件为白天22 ℃,夜间18 ℃。采集完植物样品后采集盆栽中污染土壤,及时测定提取态总铬和Cr(VI)含量、全量Cr。用去离子水清洗小麦根系,测定根长。整株样品杀青后(105 ℃,30 min)置于烘箱中(70 ℃)干燥,至恒重。测定样品干重后粉碎过0.5 mm尼龙筛,储存于干燥处。植物样品重金属含量测定前用HCl-HNO3溶液(3:1,V/V)进行微波消煮(黎森等,2019)。
1.3 数据分析
1.3.1 富集系数
本研究采用外源法计算生物富集系数(BCF),暨植物样品中金属含量与土壤中金属含量扣除背景值后的比值(代允超等,2018)。计算方程式为:

式中,F——外源法生物富集系数;Cplant——添加铬处理的小麦中铬质量比,mg·kg-1;Cplant-CK——对照处理的小麦中铬质量比,mg·kg-1;Csoil——添加铬处理的土壤中铬质量比,mg·kg-1;Csoil-CK——对照处理土壤中铬质量比,mg·kg-1。
6种土壤不同处理下富集水平如图1所示。
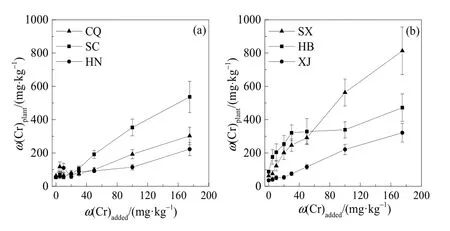
图1 不同土壤中小麦的铬含量Fig. 1 The Cr content of wheat in different soils
1.3.2 毒性阈值
参考ISO 11269的小麦根伸长实验方法,计算小麦相对根长(ISO 11269,2012)。然后用Oringin 9.0软件中的Growth-Dose-Resp方程拟合剂量-效应关系,并绘制剂量效应曲线图。拟合方程如下:
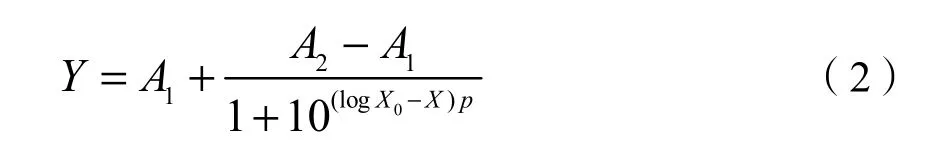
式中Y代表相对根伸长,X代表外源铬的质量浓度。X0、A1、A2均为拟合所得参数。EC10、EC20和EC50分别为小麦根伸长产生10%、20%和50%抑制效应时对应的Cr质量比。
1.3.3 分配系数
Cr(III)、Cr(VI)的生物有效性共同作用于土壤-植物体系,为了区分其影响,根据式(3)、(4)计算Cr(III)与Cr(VI)在提取态总铬中的分配比值。
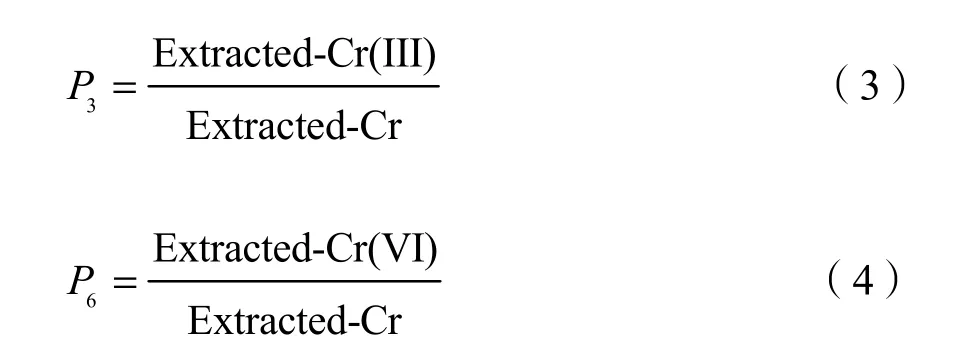
试验所有数据均采用 Microsoft Office Excel 2010进行数据统计,IBM SPSS statistics 20进行统计分析,Oringin 9.0进行作图。
2 结果与分析
2.1 不同土壤中小麦对铬的富集
如图1所示,在5—175 mg·kg-1范围内,各处理的质量浓度越高,土壤上种植的小麦富集的铬含量也越高。其中,陕西土壤种植小麦铬含量最高可达 813.76 mg·kg-1,相同处理下(T7=175 mg·kg-1),重庆和河南仅为 302.41 mg·kg-1和 222.87 mg·kg-1。由图2可知,所有处理下,小麦富集系数均大于1,相同处理下的各土壤之间富集系数存在差异。土壤铬质量分数在5—175 mg·kg-1范围内时,所有土壤上小麦富集系数均随着外源铬含量的升高而降低,直至小麦根系停止生长。T7处理下6种土壤之间富集差异显著,重庆、河南土壤富集因子较高,而T1处理下,陕西、四川土壤富集因子高于重庆等土壤。
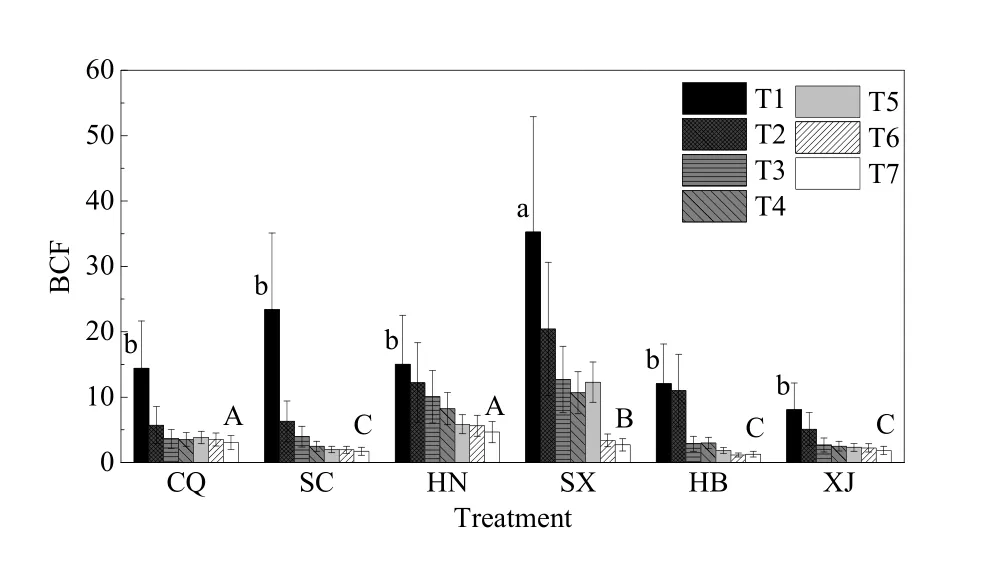
图2 不同处理下6种土壤中富集系数的变化Fig. 2 Variation of BCF (biological concentration factor) in six soils among different treatments
2.2 基于根伸长的土壤Cr小麦毒性阈值
重金属与小麦的根直接接触可产生毒害作用,而可以通过小麦根伸长来评价(赵淑婷等,2018)。根据图3可知,随着土壤中铬的质量浓度的升高,小麦根的相对根伸长(%)逐渐降低。河南、陕西和河北土壤在T2、T3处理水平下(质量浓度:10—20 mg·kg-1)开始出现抑制根长现象,重庆和新疆土壤在 T4—T5处理水平下(质量浓度:30—50 mg·kg-1)才开始抑制根长。富集含量达到约 200 mg·kg-1时所有处理土壤种植的小麦根长均下降。根据小麦根长的数据利用剂量效应曲线拟合求得不同土壤中铬对小麦的毒性阈值(EC10、EC20、EC50),见表 2。试验结果表明,不同土壤间的毒性阈值差异显著。根据表3所示,四川、河南、陕西以及河北土壤的 EC50毒性阈值(18.48—55.60 mg·kg-1)显著低于重庆和新疆土壤(75.27—135.66 mg·kg-1)。
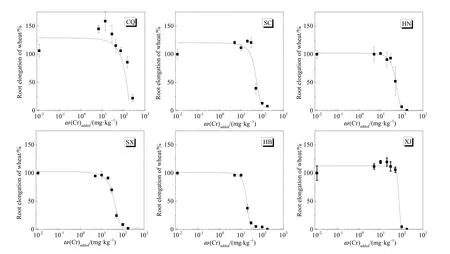
图3 6种土壤种的小麦相对根伸长Fig. 3 Root elongation of wheat in six soils

表3 土壤铬的毒性阈值(EC10、EC20、EC50)及其95%置信区间Table 3 Toxicity thresholds (EC10, EC20, EC50) and the 95% confidence interval of Cr in soil
2.3 土壤中的提取态铬与外源铬添加量的关系
根据图4所示结果,定量外源铬进入土壤中老化平衡一段时间后,不同土壤间可提取态铬含量差异较大。随着铬质量浓度的升高,提取态总铬含量升高,在T7,四川、陕西、河北土壤提取态总铬质量分数分别为 64.63、81.77、78.90 mg·kg-1,而重庆土壤仅为 24.01 mg·kg-1。
2.4 不同形态铬的有效性及其预测模型
2.4.1 有效性差异
对实测的全量铬、提取态总铬、提取态Cr(VI)与Cr(III)含量分别进行了测定,并利用相关性分析比较不同形态的铬的有效性。对数化处理分析植物毒性与重金属含量,可提高数据间方差变异的同质性(Liang et al.,2013)。因此,以相对根伸长作为其植物有效性的测试终点,与上述不同形态铬含量(对数化处理)进行相关性分析,见图5。统计分析的结果表明,对数化处理后土壤中不同形态的铬含量与小麦相对根伸长相关关系均显著。提取态总铬与根伸长相关性要好于全量铬(R2Extracted-Cr=0.741,R2Total-Cr=0.633)。Cr(VI)与 Cr(III)与相对根长相关性均显著(R2Extracted-Cr(VI)=0.603,R2Extracted-Cr(III)=0.70),但二者显著性均低于提取态总铬。分析其原因可能为提取态总铬更能反应Cr(VI)与Cr(III)两种毒性的共同作用。
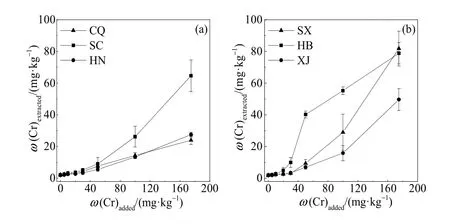
图4 种植小麦后不同处理下实测土壤提取态总铬含量Fig. 4 The content of Crextracted (extracted-Cr) in different Cradded (Crtreated) soils after planting wheat
2.4.2 预测模型

图5 不同形态铬含量与小麦根伸长的相关关系Fig. 5 Relationship between Relationship between Cr(VI)/Cr(III) content and relative root elongation of wheat

表4 以小麦根伸长为测试终点的有效性预测模型Table 4 Predicted models with relative root elongation of wheat as the end point of test
为区分Cr(VI)与Cr(III)各自的毒性作用,将对数化处理后的提取态总铬、Cr(III)与 Cr(VI)在提取态总铬中的分配比值与相对根伸长进行回归分析。得到以小麦根伸长为测试终点的有效性预测模型,见表 4。lg(ω(Extracted-Cr))简写为 lg(E-Cr),P3、P6见式(3)、(4)。提取态总铬与小麦相对根伸长呈显著负相关,而提取态Cr(VI)与Cr(III)在提取态总铬中的比值则分别呈负相关和正相关。预测模型决定系数均为0.75,当RR为50%时的提取态总铬含量暨提取态预测的EC50值。提取态总铬含量代表的有效态Cr对植物毒性起主导作用,同时Cr(VI)与Cr(III)分配比的影响也不可忽视。
2.5 土壤中提取态Cr(VI)与Cr(III)的分配
如图6所示,提取态Cr(VI)与Cr(III)在土壤中的分配会随着外源铬含量的增加发生变化。在 0—20 mg·kg-1范围内,土壤中的提取态Cr(VI)与Cr(III)含量变化较小,土壤 Cr(VI)含量极低(<1.19 mg·kg-1),而 Cr(III)含量略高于 Cr(VI)(1.76—3.83 mg·kg-1)。在T7处理水平下,土壤提取态Cr(VI)含量可达 13.16—59.36 mg·kg-1,而 Cr(III)含量为10.85—31.18 mg·kg-1,总体略低于 Cr(VI)。
土壤间提取态Cr(VI)与Cr(III)分配比变化情况存在差异,在 T7处理水平下,重庆土壤的提取态Cr(III)和 Cr(VI)含量分别为 10.85、13.16 mg·kg-1;陕西土壤 Cr(III)和 Cr(VI)含量分别为 22.41、59.36 mg·kg-1,河北土壤的提取态 Cr(III)和 Cr(VI)含量分别为 31.17、47.72 mg·kg-1。
3 讨论
3.1 土壤中铬的植物富集能力及毒性效应
Cr是植物的有毒和非必需元素,但Cr进入植物体内的初期阶段,铬的吸收需要与许多无机元素竞争以快速进入植物系统,再与根细胞液泡中的物质螯合而降低植物毒害(Shanker et al.,2005)。在植物体系中,Cr具有抑制其他无机元素的吸收,改变叶绿体结构使得小麦光合作用受损等作用,这些作用抑制了植物生长及代谢功能(Sharma et al.,1995)。本研究结果表明,在低质量浓度的铬污染下,小麦根伸长抑制不明显,对铬的富集系数较高。但随着土壤中铬含量的增加,富集系数逐渐降低。这符合上述Cr进入植物的机制,土壤中Cr质量浓度较低时,Cr快速被植物吸收,由于植物自身抗毒害机制使得其毒性较小;但随着其质量浓度的升高,植物吸收的铬含量积累过多使得生长代谢等功能受损,同时也降低了铬摄取,从而对铬的富集含量也逐渐降低。
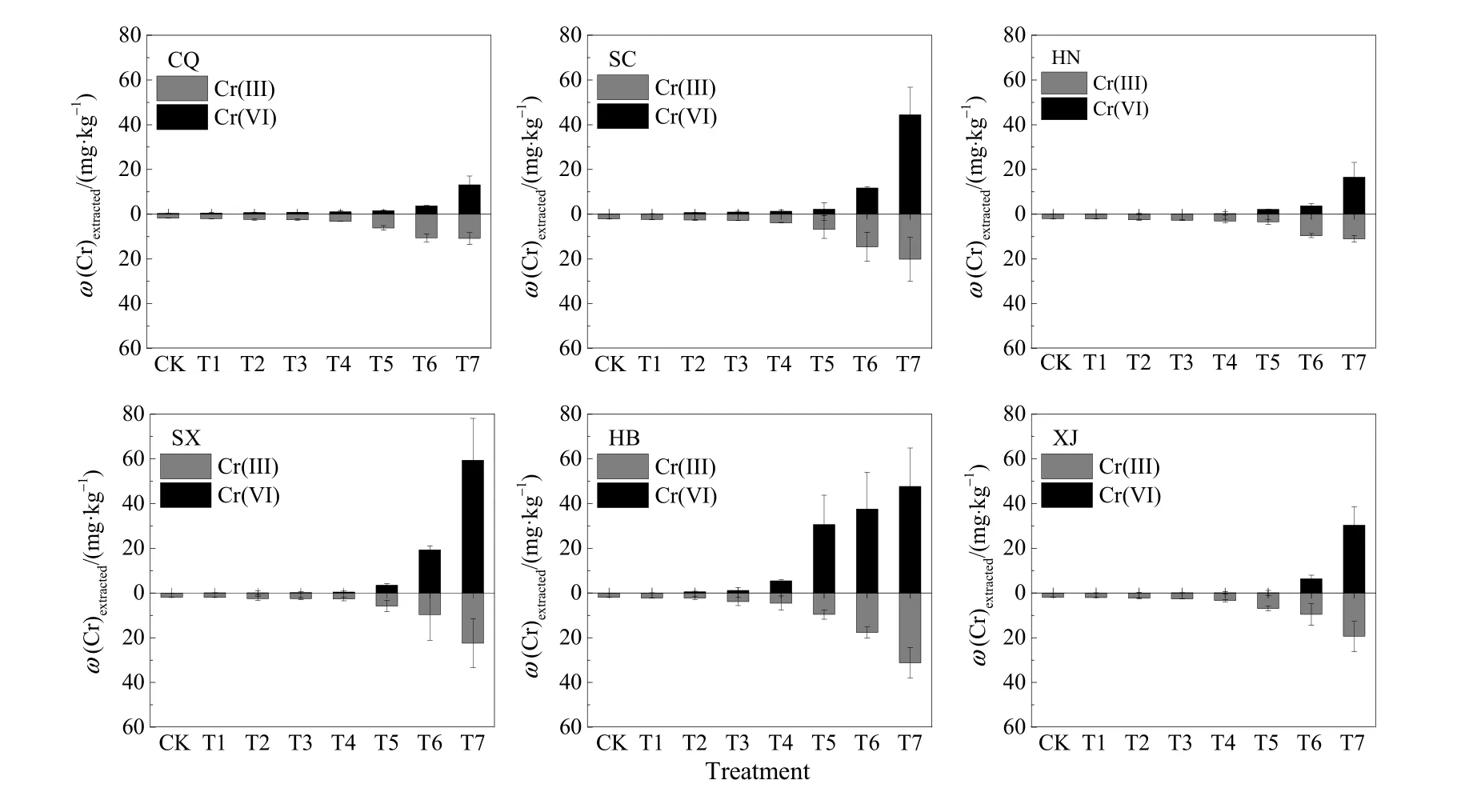
图6 不同形态铬的含量与小麦根伸长的相关关系Fig. 6 Relationship between Cr(VI)/Cr(III) content and wheat relative root elongation
López-Luna et al.(2009)的研究表明在 500 mg·kg-1的Cr(VI)下,小麦地上部分和地下部分富集含量分别为20.65、26.24 mg·kg-1。而本研究结果表明在质量浓度为175 mg·kg-1的Cr(VI)处理下,土壤为生长介质的小麦富集含量在 222.87—813.76 mg·kg-1之间。这与 López-Luna et al.(2009)的研究结果略有不同,小麦品种、土壤种类以及污染平衡时间的差异可能是导致该结果的原因。不同植物在同一土壤上富集铬含量也存在差异,已有研究报道了黑麦草(Lolium perenneL.)、高丹草(Sorghum bicolor(L.) Moench×S.Sudanense(Piper) Stapf)、狼尾草(Pennisetum alopecuroides(L.) Spreng)在土壤中,外源污染为100—300 mg·kg-1的条件下,最高富集含量大致分别为 4541、400、1090 mg·kg-1(乔云蕾等,2016)。
本研究的结果表明不同土壤间的毒性阈值、富集能力均差异显著,导致这些差异的原因可能为土壤的物理化学性质影响了植物对污染物的摄取,进而左右了污染物的毒性效应。Mishra et al.(1995)、Srivastava et al.(1994)的研究报道过土壤作为植物的生长介质,对植物摄取铬含量具有显著影响,其试验证明植物在土壤和沙土培养下对铬的富集含量显然不同。毒性阈值EC50被广泛认为在评价土壤的毒性阈值时具有良好的稳定性(Smolder et al.,2009;宋文恩等,2014)。Lin et al.(2019)的研究基于跳虫(Folsomia candida)活性为测试终点报道了铬在对土壤中生物体的毒性阈值。其中老化22 d(与本实验平衡时间相近)的河南和重庆土壤 EC50分别为22、41 mg·kg-1,这与本研究中重庆土壤具有高毒性阈值的结果相近,少许差异可能是小麦根长与跳虫的物种敏感性差异所导致(丁枫华等,2018)。不同土壤中,同一测试终点评价得到的毒性效应差异较大(于修乐等,2018),而EC50值越低,该土壤Cr污染敏感性则越强,该类型土壤上生长的植物则更易遭受Cr污染的毒害。研究结果中,四川、河南、陕西以及河北土壤的 EC50(18.48—55.60 mg·kg-1)显著低于重庆和新疆土壤(75.27—135.66 mg·kg-1),重庆、新疆土壤上植物铬毒害的影响较小。
3.2 铬有效性预测模型及价态分配
McLaughlin(2001)、Ma et al.(2006)的研究表明相同含量的重金属在理化性质不同的土壤中的老化一段时间后,其有效态含量变化不同。在农田污染治理的实际应用中,用全量计算毒性阈值的方法准确性仍存在争议,Ahmad et al.(2015)曾在其研究中表示用重金属全量来衡量毒性效应的方法并不恰当,而化学提取态的含量变化一定程度上可以代表有效态含量变化(Paula et al.,2015)。Ding et al.(2014)利用提取态铬含量,建立了基于胡萝卜为毒性测试终点的铬预测模型,而肖文丹(2014)则在 2014年建立了基于白菜、水稻为测试终点的铬预测模型。本研究也将提取态铬作为重要的预测因子,却未直接将土壤理化性质作为模型预测因子,因为考虑到土壤理化性质影响提取态总铬含量,不适宜将其与提取态总铬含量同时作为预测因子。本研究基于实测的提取态总铬含量及其价态分配,建立了新的预测模型,可以根据实测提取态含量预测植物毒性。模型以小麦相对根长作为因变量,自变量为提取态总铬含量、Cr(VI)与Cr(III)占总铬比值。相比前人的研究,该模型在实际应用中减少了需要测定的 pH值、阳离子交换量、有机质含量等土壤理化性质参数。Cr(VI)与Cr(III)分别与小麦相对根伸长呈现正相关和负相关。这是因为在提取态总铬恒定的情况下,Cr(VI)含量越多则Cr(III)含量相对少,毒性效应越强,而Cr(III)含量相对多时,毒性较小。价态分配的结果表明高Cr污染下,陕西土壤P6高于重庆土壤,河北土壤P6与重庆相近,但陕西、河北土壤Cr(III)和Cr(VI)含量均显著高于重庆土壤。显然,重庆土壤上的植物铬毒害要低于陕西河北土壤,且重庆土壤具有高毒性阈值,同处理下毒性阈值越高越不容易受重金属毒害。
提取态铬价态分布的差异也是导致土壤间毒性差异的重要原因,因为Cr(VI)和Cr(III)在土壤中分别被吸附固定且可以同时发生氧化还原过程。这些过程受到pH值、有机质含量、阳离子交换能力、铁锰氧化物含量等多种理化性质的共同影响(Dhal et al.,2013)。比如,Cr(VI)在土壤矿物中的滞留量与土壤中磷、铁含量相关(Gu et al.,2017),而高含量的铁氧化物和铝氧化物会促进Cr(VI)吸附过程(Jiang,2008;Pérez et al.,2014)。pH低的土壤中Cr(VI)更容易被吸附固定,且 Cr(VI)更容易还原成Cr(III)(Yang et al.,2019)。有机质丰富的土壤中Cr(VI)倾向于转化为 Cr(III)(Banks et al.,2006),而锰氧化物则会促进 Cr(III)氧化成 Cr(VI)(Stepniewska et al.,2004)。土壤理化性质对Cr(III)的固定也有不同影响,其中,CEC含量高的土壤对Cr(III)的吸附更强(Cao et al.,2011),而低pH值的土壤中Cr(III)吸附能力远远弱于Cr(VI)。综上所述,土壤间铬毒性差异是由多种土壤理化性质综合作用所致。重庆土壤由于低pH值、高有机质含量等理化性质因素导致Cr(VI)含量低,在6种土壤中铬毒害最轻。如何区分各种土壤理化性质具体作用力度或贡献度是本研究的尚未解决的科学问题,这也是评估铬在土壤污染中危害的重要部分。在后续的研究中,我们将重点关注该问题。
4 结论
(1)在5—175 mg·kg-1土壤铬质量浓度范围内,小麦铬富集系数随着土壤铬含量的增加而降低。不同土壤上小麦铬富集系数以及毒性作用差异较大,而当小麦富集含量在高于200 mg·kg-1时,各土壤上小麦正常生长代谢均受到抑制。土壤理化性质的差异会导致有效态 Cr(VI)、Cr(III)含量差异,从而影响小麦对铬的吸收积累,导致小麦铬毒性效应不同。
(2)提取态铬比土壤全量铬更适宜预测铬的有效性,而Cr(VI)与Cr(III)的毒害效应需要进行区分。于是,本研究基于提取态铬含量及其价态分配建立了可以预测铬有效性的模型。相比利用各种土壤基本理化性质为因子的预测模型,该模型直接用提取态实测值,具有预测因子测定简便,测定参数少等优势。
(3)Cr(VI)毒性远远高于Cr(III),而土壤中铬的价态分布受土壤理化性质影响,故导致了铬毒性效应的差异。低pH值使得Cr(VI)更容易被吸附,高有机质使得Cr(VI)易还原成Cr(III),故pH值低且有机质含量高的重庆土壤在6种农田土壤中铬毒害最轻。

