吉非替尼联合125I 放射性粒子治疗肺腺癌有效性的动物研究
姚林艳,李超杰,王子寅,单群刚,庞浩鹏,陆 健,贡 桔,王忠敏,刘芬菊
癌症是世界范围主要公共卫生问题,根据2018年世界癌症报告(GLOBOCAN) 的数据显示,肺癌是最常见的恶性肿瘤,它占总癌症病例的11.6%,也是癌症死亡的主要原因,占癌症总死亡人数的18.4%[1-2]。在肺癌中,非小细胞肺癌(NSCLC)约占肺癌总数的80%以上,且大部分患者发现时已发展为不宜手术的Ⅲ、Ⅳ期[3]。因此,晚期NSCLC 的治疗倾向于多学科,包括手术、化学疗法、放射疗法、免疫治疗和分子靶向疗法等。
放射性粒子可局部直接植入肿瘤组织,通过放射线照射,能够提供更高肿瘤靶区剂量,杀死肿瘤细胞,达到治疗目的[4]。在恶性肿瘤治疗方面,国内外已有应用125I 放射性粒子植入治疗有效性的报道[5]。然而,在细胞被电离辐射损伤后,会阻碍细胞周期,使细胞有足够的时间来修复受损的DNA;此外,它在受损细胞中诱导不能修复的细胞凋亡,从而降低基因组的不稳定性并降低细胞突变的可能性。因此,在放射治疗过程中,肿瘤细胞可以通过细胞周期阻滞的作用,降低对射线的敏感性,从而降低治疗效果[6]。
表皮生长因子受体(EGFR) 是一种受体型酪氨酸激酶,与表皮生长因子(EGF)结合后形成同源或异源二聚体,从而激活细胞内酶,启动细胞核中的相关基因,增高基因转录水平,破坏细胞生长平衡,导致肿瘤的发生和发展。研究表明,EGFR 在很多种恶性肿瘤中存在高表达或异常表达,影响患者的预后[7-9]。EGFR 的表达与放疗疗效成负相关[10-11]。EGFR 是靶向治疗的关键,在肿瘤基础研究中,已证实EGFR 相关抗体及抑制剂可用于肿瘤治疗[10,12]。吉非替尼是一种靶向EGFR 的小分子酪氨酸激酶抑制剂,可竞争性抑制配体的结合位点,封闭其活性,从而达到阻断信号转导、抑制肿瘤生长的目的[9,13]。
大多数靶向治疗主要是靶向恶性癌细胞,很大程度上忽略了肿瘤微环境的影响。NSCLC 中,患者对EGFR 抑制剂产生应答,但是,由于肿瘤微环境的相互作用、旁路激活、靶点扩增或再次突变等因素的影响,最终产生耐药性[14]。放疗和分子靶向治疗是NSCLC 的重要治疗手段。本研究将抗EGFR治疗药物吉非替尼和125I 放射性粒子联合应用,观察吉非替尼和125I 放射性粒子是否具有协同抗肿瘤作用 。
1 材料与方法
1.1 实验动物和材料
4~6 周龄的雌性BABL/c 裸鼠24 只,体重约20g(上海交通大学医学院动物房提供)。放射性粒子活度0.6mCi,生物半衰期为59.6 d 的125I 粒子(上海欣科医药有限公司提供)。吉非替尼(gefitinib)[商品名易瑞莎(Iressa)]由英国AstraZeneca提供,剂型:250 mg/片,溶解于5%葡萄糖溶液。稳定表达荧光素酶的A549-luc 细胞(中国科学院提供)。荧光素酶底物(D-luciferin)(北京百灵威科技有限公司);小动物可见光活体成像系统IVIS Spectrum(Xenogen公司,美国)。
1.2 方法
1.2.1 人肺腺癌A549 细胞裸鼠皮下移植瘤模型的建立和分组 将人肺腺癌A549-luc 细胞1 x 107/mL 接种到裸鼠右侧腋窝皮下,每只0.2 mL。隔天观察移植瘤生长。每3~4 天用游标卡尺测量移植瘤大小,接种20 d 后,当移植瘤成瘤大小8~10 mm时,24 只荷瘤裸鼠随机分为空白对照组、125I 放射性粒子组,吉非替尼组,吉非替尼联合125I 放射性粒子组,每组6 只。吉非替尼单药组:吉非替尼混悬液按0.1 mL/10g 规格灌胃,每天1 次,连续用药5 周;125I 放射性粒子组:每个移植瘤内置入1 枚0.6 mCi粒子源;联合治疗组:按125I 放射性粒子组及吉非替尼组的剂量联合给予;对照组: 5%葡萄糖溶液,每天1 次灌胃,用量和用法与吉非替尼治疗组相同。全部裸鼠均在末次给药24 h后,通过颈椎脱位处死。根据公式V=L×W2/2(L 为最长径,W2为与L 相垂直的横径)计算移植瘤体积,绘制肿瘤生长曲线。剥离皮下肿瘤迅速将肿瘤组织切成多个小组织块并置于液氮中以备RT-PCR 检测使用。
1.2.2 活体生物荧光检测 裸鼠皮下接种A549-luc细胞后,在接种后第3 周进行活体荧光检测,治疗后第1、2、3 周应用IVIS-Spectrum 系统检测皮下移植瘤的生物发光信号。检测时,每只裸鼠按照150 mg/kg体重的量腹腔内注射荧光素底物,并在异氟烷麻醉后10~15 min 进行体内成像。成像后,应用系统附带软件检测皮下肿瘤生物发光信号强度。
1.2.3 18 F-FDG Micro-PET/CT 成像 采用Super Nova PET/CT 扫描仪(PINGSENG Healthcare 公司),治疗前和治疗后1 周分别进行显像。将麻醉后的裸鼠俯卧位固定在扫描架上,先行CT 检查(参数为80 kV,0.5 mA),曝光时间为10 min,然后以相同的体位进行PET 采集。通过腹腔注射7.4 MBq18F-FDG 进行PET 显像,并在注射显像剂后1 h 进行延迟显像,持续采集20 min。以3D 模式获取图像,重建冠状、矢状及横断面图像。以肿瘤最大层面计算最大标准摄取值(SUVmax)和平均标准摄取值(SUVmean )
1.3 统计学处理
2 结果
2.1 移植瘤动物模型
共计接种24 只,全部顺利成瘤,成瘤率100%。从皮下种植开始至取瘤结束,所有裸鼠均全部存活,均未发现明显放射诱导损伤。所有植入粒子未见移位、遗失,均成功回收,储备在铅盒中进行安全处理。
2.2 抑瘤效应
空白对照组、125I 放射性粒子植入组、吉非替尼组和吉非替尼联合125I 放射性粒子植入治疗组,治疗前的肿瘤体积分别为(282.89±71.32)mm3、(289.51±69.90)mm3、(287.79±32.96)mm3和(287.99±44.19)mm3,4 组中各组间差异无统计学意义(F=0.015,P >0.05);经过4 种不同方法干预后2 周,各组移植瘤体积比较差异有统计学意义(F=6.617,P <0.05),从此至治疗结束3 个时间点,即第3 至5 周,各组移植瘤体积间比较差异均有统计学意义(F=5.156,8.432,10.305,P<0.05)。空白对照组、125I 放射性粒子植入组、吉非替尼组和吉非替尼联合125I放射性粒子植入治疗组治疗后的肿瘤体积分别为(1 509.25±709.93) mm3、(840.45±43.35) mm3、(1 052.96±247.42) mm3和(317.34±52.08) mm3,吉非替尼联合125I 放射性粒子植入组低于其他3 组,差异有统计学意义(F=10.305,P <0.05)。治疗后,联合组较125I 放射性粒子组和吉非替尼组差异有统计学意义(P <0.05)。如图1 显示了裸鼠接受不同方法干预后移植瘤生长曲线。

图1 4 种不同方法处理下肿瘤体积变化
2.3 裸鼠体重
空白对照组、125I 放射性粒子植入组、吉非替尼和吉非替尼联合125I 放射性粒子植入组治疗前裸鼠体重分别为(26.17±1.72)、(26.17±1.33)、(24.83±2.40)和(26.67±1.86)g,差 异 无 统 计学意义(F=1.062,P>0.05),治疗后体重分别为(27.33±4.08)、(26.83±3.12)、(24.50±2.59)和(24.50±2.34)g,差异有无统计学意义(F=1.408,P>0.05),并均较治疗前差异无统计学意义 。
2.4 生物发光成像监测
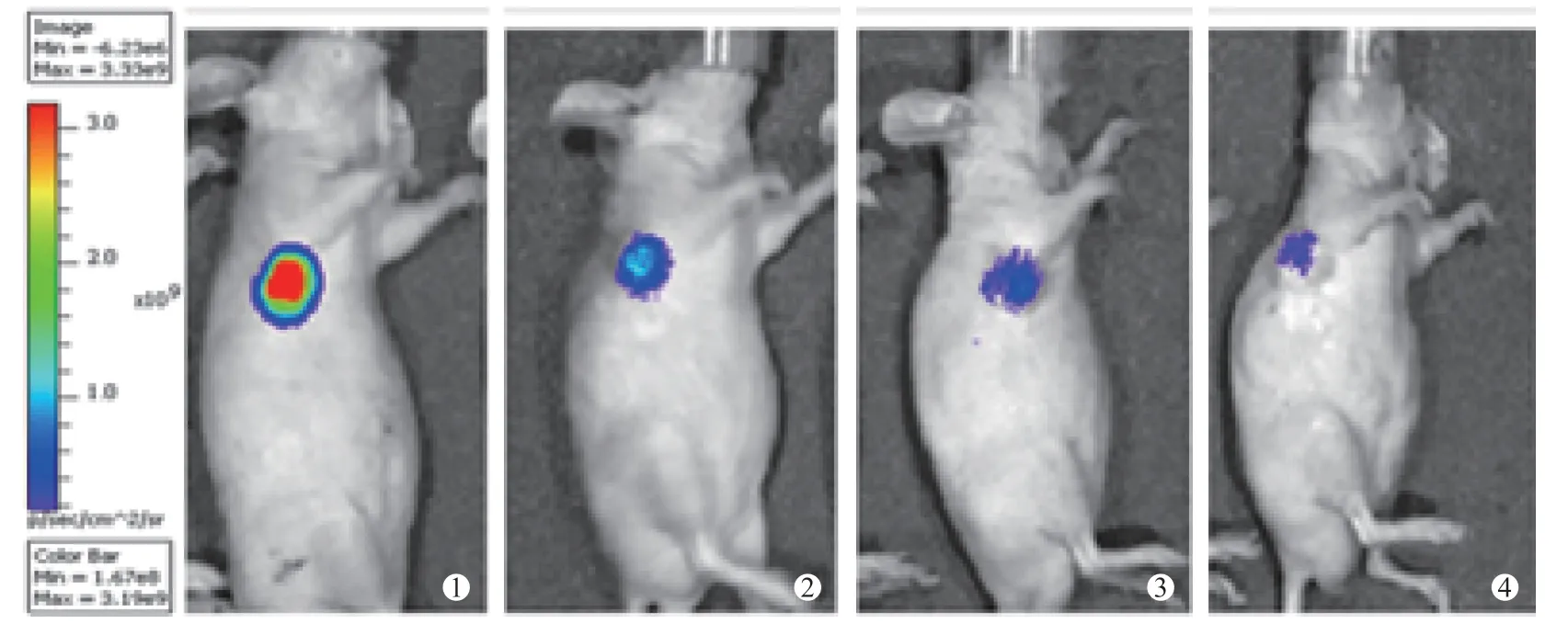
图2 125I 放射性粒子联合吉非替尼组 肿瘤生物荧光强度明显减弱
人肺腺癌A549-luc 细胞注射BALB/c 裸鼠3W 后,Xenogen IVIS-spectrum 小 动 物 荧 光活体成像仪观察裸鼠中肿瘤生长情况,肿瘤中荧光光子强度变化。结果显示裸鼠种植部位可检测到生物荧光,提示肿瘤发生。空白对照组、125I 放射性粒子植入组、吉非替尼组和吉非替尼联合125I 放射性粒子植入组治疗前肿瘤部位生物发光光子数分别为(209371666.7±32194019.58)、(2 108 666666.7±76 166 519.33)、(188 318333.3±42 959 832.60)和(212 876 666.7±70 366 339.02) P/sec/cm2/sr,差异无统计学意义(F=0.27,P >0.05),治疗后检测生物荧光信号,光子数分别为(198 605 000.0±12 976 503.00)、(99 263 333.33 ±49 293 480.57)、(87 419 500.0 ± 24 039 740.21)、(48 433 333.33±14 417 910.62)P/sec/cm2/sr,差异有统计学意义(F=28.975,P <0.05),125I 放射性粒子植入组、吉非替尼和吉非替尼联合125I 放射性粒子植入组差异均较治疗前有统计学意义(T=6.392、9.946、6.677,P <0.05),吉非替尼联合125I 放射性粒子植入组低于其他3 组。空白对照组较治疗前差异无统计学意义(T=1.189,P >0.05)。肿瘤体积大小结果与生物荧光值强弱趋势基本一致。见图2、图3、图4、图5( ①为治疗前,②、③、④治疗后1 周、2 周、3 周)
2.5 18F-FDG Micro-PET 代谢监测
空白对照组、125I 放射性粒子植入组、吉非替尼组和吉非替尼联合125I 放射性粒子植入组的18F-FDG SUVmax 治疗前为0.85±0.12、0.85±0.12、0.79±0.05、0.82±0.09,治疗后为0.88±0.13、0.77±0.10、0.75±0.19、0.75±0.03,差异无统计学意义(F=1.449、1.604,P >0.05)。SUVmean 治疗前为0.45±0.06、0.55±0.15、0.52±0.05、0.51±0.08,治 疗 后为0.56±0.07、0.54±0.06、0.49±0.12、0.48±0.04,差异无统计学意义(F=1.155、1.604,P >0.05)。如图6 治疗前和125I 放射性粒子联合吉非替尼治疗1 周后。
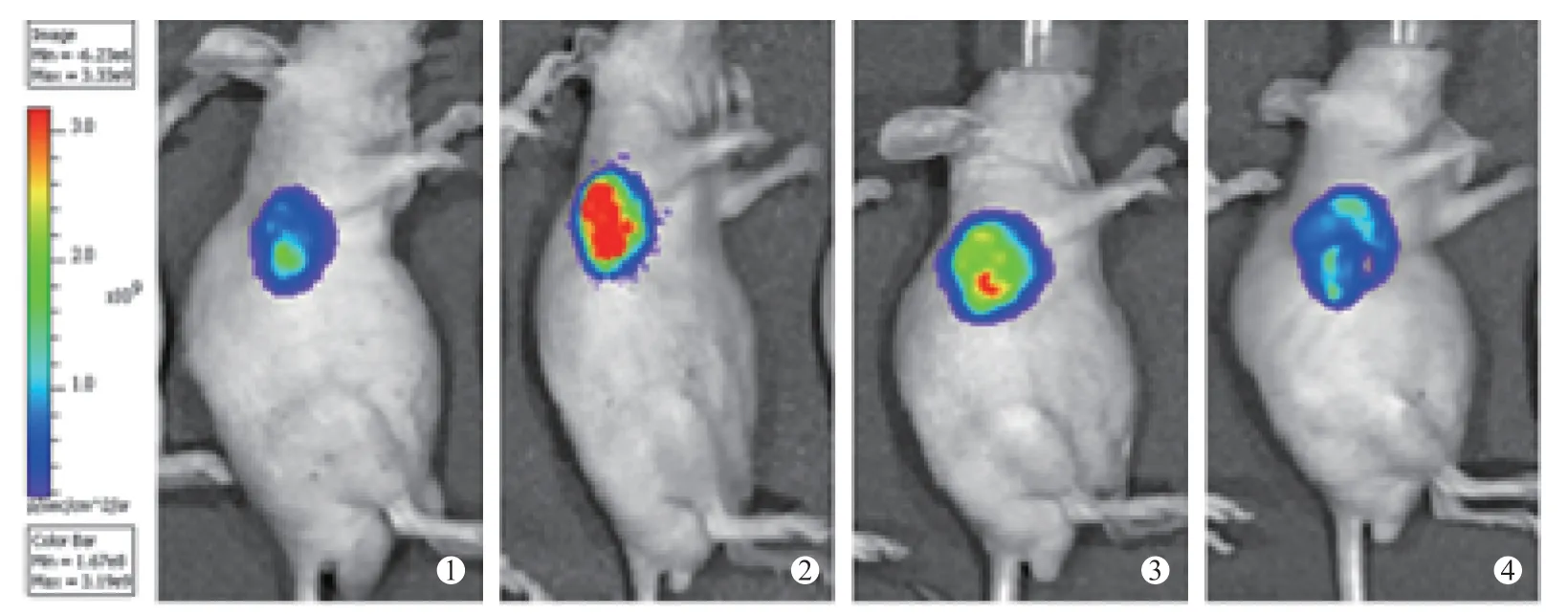
图3 125I 放射性粒子组 肿瘤生物荧光强度没有明显减弱
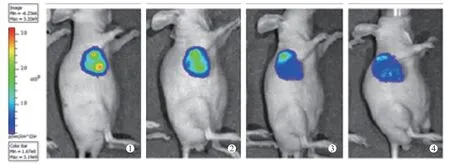
图4 吉非替尼组 肿瘤生物荧光强度没有明显减弱

图5 对照组 肿瘤生物荧光强度增强
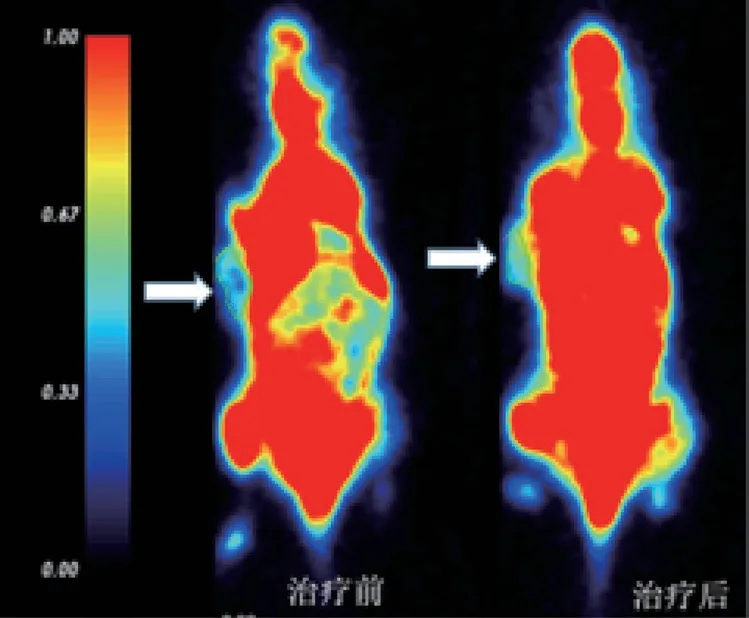
图6 治疗前和治疗1 周后
3 讨论
近年来,随着微创技术的发展,放射性粒子植入在恶性肿瘤的治疗中取得了较快进展。125I 是一种合成的核素,半衰期为59.63 d,在衰减时释放能量,分别为27.4 KeV、35.5 KeV 的X 射线、γ 射线;有效的杀伤半径范围是1.0~1.5 cm。目前临床使用的125I 放射性粒子长径为(4.50±0.3) mm,直径为(0.80±0.03) mm;每粒粒子放射性活度在0.5~0.8 mCi[15]。125I 放射活性低、疗效高、精确度高,对正常组织的损伤小等特点。通过将放射性粒子置于肿瘤内,释放出低能γ 射线破坏肿瘤细胞周期,且在杀灭肿瘤细胞中发挥作用[16-17]。DNA 是辐射的主要目标,放射可以使机体内的水分子电离并产生自由基,自由基与生物大分子相互作用,造成组织细胞伤害。
EGFR 是原癌基因Cerb-1(HER-1)表达产物,具有酪氨酸激酶活性的跨膜糖蛋白,与相应配体结合后,引起特定的酪氨酸残基自动磷酸化,最终导致细胞增殖和血管生成,其通过信号转导导致不受控制的细胞生长[18]。EGFR 在很多恶性肿瘤中存在高表达或异常表达,尤其是在NSCLC 中,其阳性率甚至高达80%~85%,而这种高表达状态是导致NSCLC 放疗抵抗的重要因素[11]。吉非替尼是一种EGFR-酪氨酸激酶抑制剂(EGFRTKI),它竞争性地结合于细胞表面Mg-ATP 结合位点上,阻断其下游的信号转导通路,使细胞周期停止在G0~G1 交界期,从而抑制细胞周期、促进细胞凋亡、抑制肿瘤增殖和转移[19-20]。本研究中,4 组裸鼠移植瘤治疗后其体积差异具有统计学意义(F=10.305,P <0.05),且吉非替尼联合125I 放射性粒子组治疗后肿瘤体积(317.34±52.08) mm3明显小于其他组的(1 509.25±709.93)、(840.45±43.35)、(1 052.96±247.42) mm3。因此,125I 放射性粒子联合吉非替尼能够更有效抑制肿瘤生长,但是具体机制仍需进一步研究。
近年来,分子成像技术得到广泛应用,可以实现动物肿瘤模型无创、连续、实时地观察,为肿瘤的分子诊断及治疗提供了重要的研究方法[21],其中生物发光成像可以检测到动物模型中微小病灶,灵敏度高、安全系数高、没有放射性危害、操作简单、定量准确[22]。荧光素酶在ATP 和氧存在的情况下催化荧光素氧化,并在荧光素氧化的过程中,发出生物荧光。使用荧光素酶标记的肿瘤细胞进行小动物体内成像可以更有效地观察肿瘤的发生和发展,并评估治疗效果[23]。本研究中,在动物荧光活体成像仪观察裸鼠中肿瘤生长情况,治疗后检测生物荧光信号,光子数差异有统计学意义,吉非替尼联合125I 放射性粒子组低于其他3 组。
18F-FDG(氟脱氧葡萄糖)是最主要的肿瘤显像剂之一,恶性肿瘤细胞对葡萄糖的需求量大,注射18F-FDG 后,肿瘤病灶部位呈高摄取状态。因此,18F-FDG PET 显像为功能显像。本实验建立了A549-luc 裸鼠肿瘤模型,结果显示,治疗前与治疗后肿瘤部分摄取状态并没有明显变化,SUVmax和SUVmean 前后差异无统计学意义,推测有以下可能:选择的是人肺癌A549 细胞,制作裸鼠肺腺癌模型,可能存在异质性差异,也可能存在裸鼠体质差异,另外可能实验尚未探索出可以表达阳性结果的浓度及剂量。在相关文献中,也并没有发现应用A549 细胞建成的裸鼠肺腺癌模型,在18F-FDG Micro-PET/CT 成像中相关阳性结果。
实验中,通过皮下注射A549-luc 细胞建立裸鼠腋下移植瘤模型,采用125I 放射性粒子,吉非替尼,125I 放射性粒子联合吉非替尼分别作用于裸鼠,测量肿瘤大小,利用生物发光成像技术检测治疗前后裸鼠移植瘤生物发光信号值,随治疗时间的延长,皮下移植瘤的体积增长受到抑制,生物发光信号逐渐降低,结果显示各治疗组均能抑制肿瘤组织生长,而125I 放射性粒子联合吉非替尼组作用更显著。两药在抑瘤方面具有一定的协同作用。本次实验各组样本量较少,具有局限性,研究中对于125I 放射性粒子与吉非替尼联合作用机制仍未明确,接下来需要加大样本量研究并进一步探讨协同作用机制。