基于Fisher 判别构建CT 引导下肺穿刺活检并发症的预测模型
张 皓,李 琳,吕发金
CT 引导下的经皮肺穿刺活检术(percutaneous transthoracic needle biopsy, PTNB)由于微创、简便和诊断准确率高,是肺癌的一种重要诊断工具[1]。但它仍是一种侵入性的检查方式,会出现气胸和肺出血,还会有呼吸困难、咯血、血胸、空气栓塞等并发症。国内外研究并发症危险因素的文献也较多[2-3],如对穿刺器械的研究分析、同轴针技术的应用等[4],都是为了尽量降低并发症的发生率,但是鲜有建立并发症预测模型的报道[5]。随着科技的发展和医疗技术的革新,机器学习算法等人工智能对人类疾病的风险预测或诊断已成为热点。本研究旨在探索应用机器学习算法的Fisher 判别,初步构建CT 引导下PTNB 并发症的预测模型,为临床风险评估提供参考。
1 材料与方法
1.1 临床资料
纳入2016 年至2018 年,在我院接受CT 引导下的PTNB 的患者227 例,男142 例,女85 例,年龄为18 ~82 岁,平均(61±12)岁。按时间先后顺序,将有病理确诊或随访结果证实的前187 例用于构建预测模型,后40 例用于预测模型的临床应用测试。纳入标准:穿刺路径需经过肺组织的肿块或结节。排除标准:穿刺路径无需经过肺组织的纵隔或贴胸膜的病灶。临床表现主要为咳嗽、咯痰,痰中带血或咯血,以及胸痛,部分为偶然发现,无明显临床症状。左、右肺单发病灶分别为97 和104 例,两肺多发病灶共有26 例。病灶大小=(长径+短径)/2,为0.5~7.0 cm,平均(3.8±1.3) cm。所有患者术前均被告知PTNB 的作用和风险,并签署手术知情同意书。
1.2 方法
1.2.1 术前准备 完善患者的术前常规检查,排除肺穿刺禁忌证及不能耐受或无法配合手术者,例如心肺功能差,凝血功能明显异常,剧烈咳嗽不能控制者或有精神疾患者。术前行CT 增强扫描,应用1 mm 的CT 薄层图像观察肋间动脉,以及穿刺路径和病灶周缘血管支气管的走行情况。参考增强扫描,靶点设定在强化明显的病灶实性部分,避开液化坏死区,结合前述血管和支气管的走行,选择适宜的穿刺层面和穿刺点来制定合理的穿刺路线,规划初步的穿刺角度和深度。
1.2.2 手术方式 在患者的体表用简易定位器标记好穿刺点,常规消毒铺巾后应用利多卡因作好皮肤及壁层胸膜的局麻,利用CT 扫描做引导,根据具体情况,扫描层厚选择5 mm、3 mm 及1.5 mm,并尽量缩小CT 的扫描范围。在胸膜外调整好18 G 同轴穿刺针的角度和方向,再平稳而快速地突破胸膜后刺中病灶,部分病灶位置较深和病灶较小,或毗邻重要组织结构时,需通过分次进针的方式,观察和修正穿刺路线,直至靶点,应用巴德全自动活检枪取材2~3 次,根据病灶部位和大小,选取检材长度为1.5 cm 或2.2 cm。术后行CT 平扫,包含穿刺区域和心脏,了解有无并发症。
1.2.3 术后处理 活检取出的组织条用15%甲醛液瓶盛装后送检病理科。术后由护士护送患者轮椅或推车返回病房,嘱患者卧床休息2~4 h,避免剧烈咳嗽和跑跳等运动,定时监测患者的基本生命体征。
1.2.4 数据收集 将CT 引导下PTNB 的小标本病理结果,与外科手术切除后的病理结果,和非手术治疗病例的追踪调查结果,进行对照比较。统计PTNB 病例的临床资料,术中和术后记录,包含并发症情况。
1.3 统计学方法
使用SPSS 22.0 统计学软件包。连续性变量采用均数±标准差表示。分类资料采用例数和百分比表示。前187 例并发症的单因素分析使用χ2检验,选取有统计学意义的变量进入二元logistic 回归分析,采用后退剔除法(α进= 0.05, α剔= 0.10)。纳入前187 例有统计学意义的并发症危险因素指标,构建Fisher 判别函数,采用交叉核实法核算模型的误差概率,后40 例进入模型实践和测评。显著性水平设置为α = 0.05。
2 结果
2.1 病理结果
187 例肺部病变PTNB 术后的小标本组织病理结果显示,恶性肿瘤136 例位于首位,占比72.7%,主要为腺癌68 例(36.4%)和鳞癌36 例(19.3%),其次是小细胞肺癌14 例(7.5%),转移瘤和未分化癌分别为9 例(4.8%)和7 例(3.7%);其后降序依次排列为,感染性病变42 例(22.46%),未明确诊断5 例(2.67%),良性肿瘤4 例(2.1%)。对照比较显示,在PTNB 术后小标本的51 例非恶性肿瘤的病理诊断中,11 例后来被确诊为肺癌,还有1 例未明确诊断者在经过1 年的追踪随访后考虑为结核瘤。本组的PTNB 小标本病理组织切片的诊断正确率为93.6%(175/187)。
2.2 并发症情况
187 例中发生并发症48 例,占总例数的25.7%。气胸29 例(15.5%),含呼吸困难3 例(1.6%);肺出血26 例(13.9%),含咯血8 例(4.3%);气胸合并肺出血7例(3.7%)。无血胸和空气栓塞等其他并发症。后40 例中并发症共发生9 例,占总例数的22.5%,其中气胸6 例,肺出血3 例。
2.3 危险因素分析
单因素的卡方检验(表 1)和多因素的二元logistic 回归分析(表 2)显示,并发症的危险因素有病灶的大小,是否合并肺气肿等疾病,病灶中心距离膈面的短径,穿刺肺组织的深度,穿刺胸膜的角度,穿刺的时间和次数,性别、年龄、病灶部位(含左右和上中下)差异无统计学意义。
2.4 预测模型构建
设定X1 =病灶大小、X2 =合并肺气肿等、X3 =病灶中心距离膈面短径、X4 =穿刺深度、X5 =穿刺胸膜角度、X6 =穿刺时间、X7=穿刺次数,阳性设值为1,阴性设值为0,设值参考表 2,构建判别函数,所得非标准化Fisher 判别公式为Z = 1.531X1+1.531X2+ 2.123X3 + 1.390X4 + 1.564X5 + 0.903X6 +1.716X7 - 3.114,群组重心函数分别为并发症(无)= 0 和函数值=-0.569,以及并发症= 1和函数值=1.597(表 3),判别界值为0.514。
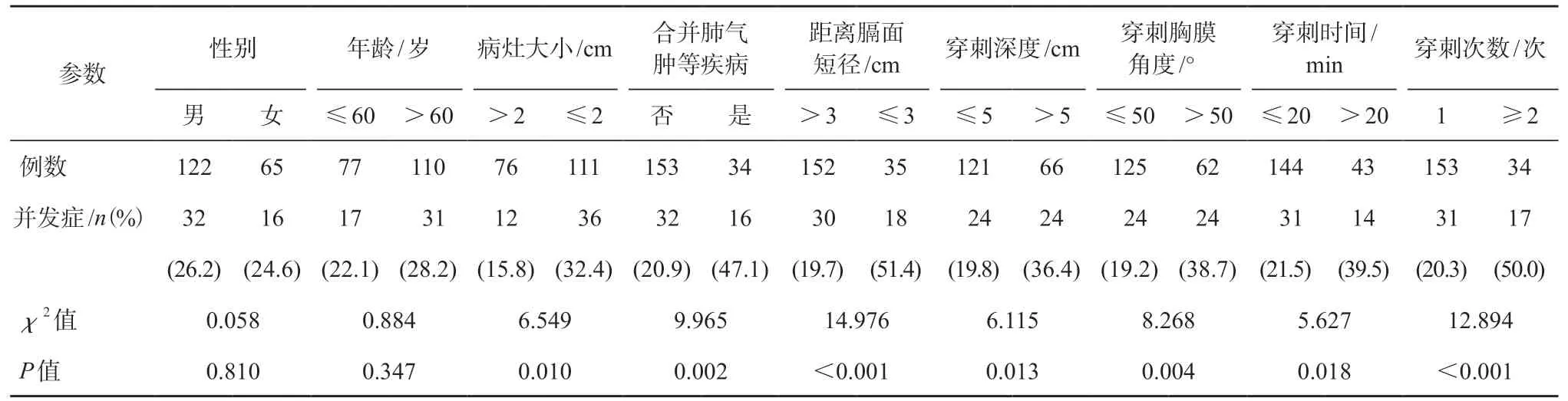
表 1 并发症的单因素分析
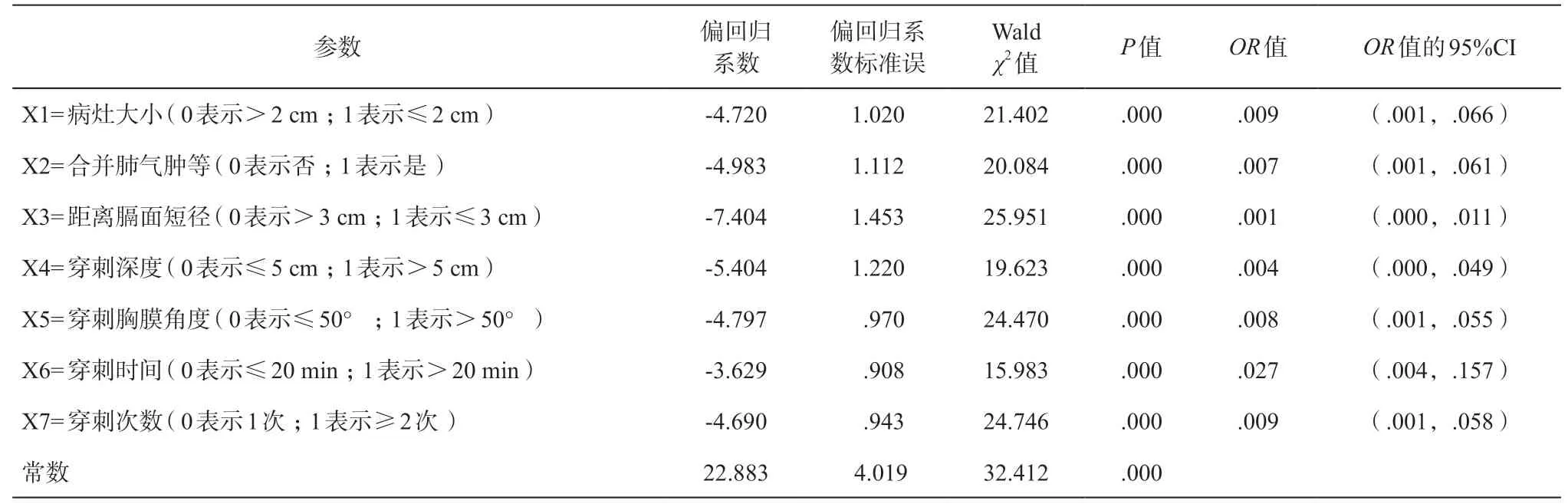
表 2 并发症的logistic 回归多因素分析
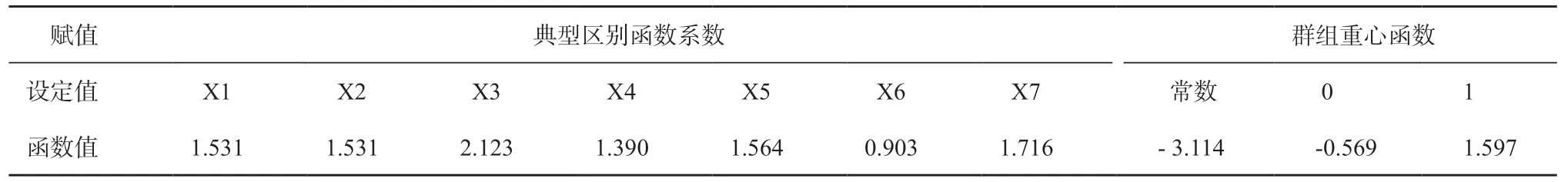
表 3 并发症的Fisher 判别函数值
2.5 预测模型的测评
通过交叉核实法得出187 例的总误判率是10.2%,符合率(准确率)是89.8%,48 例并发症中有7 例误判为无并发症,敏感度(真阳性率)为85.4%,139 例无并发症中有12 例误判为有并发症,特异度(真阴性率)为91.4%(表 4)。227 例中的后40例带入预测模型中实践,测评结果:总的误判率是7.5%,符合率是92.5%。9 例中并发症中有1 例误判为无并发症,灵敏度为88.9%,31 例无并发症中有2 例误判为有并发症,特异度为93.5%。
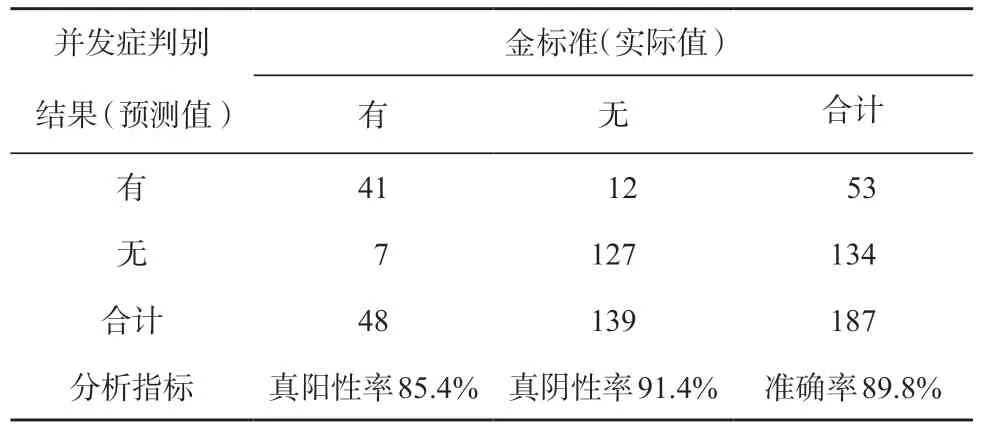
表 4 交叉核实法诊断Fisher 判别结果分析表
3 讨论
肺癌发病率位居全球首位,且有逐年递增的趋势,随着医疗技术的进步和发展,肺部小结节的早期确诊[6],以及肺癌的一些非手术治疗需要病理学依据,而CT 引导下的PTNB 能够帮助临床尽早施行精准医疗[7-8],对患者的预后具有重要影响。本次研究中PTNB 诊断正确率为93.6%,显示它具有很高的临床应用价值。但PTNB 时常伴有并发症,近年来有研究描述其总体发生率为18.4%~24.5%[9],常见的肺出血和气胸的发生率分别是8.7%~52.5%和8.5%~36.4%,而另一份肺穿刺活检的meta 分析显示,常见并发症的发生率分别为气胸17.9%~51.8%和咯血10.5%~19.4%[10]。其间的数值差异很大,值得深入研究,以尽量降低并发症的发生率。
本次研究的危险因素分析指标参考了历史文献资料,所以病灶大小和是否合并肺气肿等疾病,以及穿刺的深度、次数和时间,与既往很多研究结果近似[1-3,5-6,9,11]。有研究认为年龄也是并发症的危险因素,但注意到肺气肿患者在60 岁以上的老人年多见,即年龄和肺气肿在logistic 回归分析中可能存在共线性问题,所以应谨慎评估这个因素。穿刺路径若有肺气肿或肺大泡,易在穿刺时出现壁破裂,进而发生气胸。肺部炎症则因为病变区域炎性充血、组织水肿,在切割取检时肺出血的概率较正常肺组织高。病灶的大小和并发症呈负相关性;①靶点越小,穿刺难度增加,特别是对于呼吸活动度大或者配合度差的患者,穿刺的次数和时间易被动增加;②小结节样病灶周围大都包绕有供血或引流小血管,易被肺穿刺活检误伤;③取检小结节病灶时,活检针的组织切割槽最小选择为1.5 cm,正常肺组织易被纳入并造成切割损伤。穿刺深度越深,损伤的肺组织越多,并发症发生概率增加,而肺血管的分布是由肺门密集向外周发散,管径由粗变细,深部病灶的穿刺远较外周的所致血管损伤的概率更大。穿刺次数和时间分别作为危险因素之一,其原因和穿刺深度相似,简言之,肺组织被侵入过多。
穿刺胸膜的角度和病灶中心距离膈面的短径与并发症发生,偶有文献提及[12-13]。本研究参考并纳入其为PTNB 并发症危险因素的观察指标,结果显示这些指标也是并发症的危险因素。人体在呼吸时,肺组织是以肺门为中心,循环而规律的进行着收缩和膨胀运动,垂直或小角度穿刺胸膜,顺着肺血管走行方向的进针,顺应肺组织呼吸运动轨迹,胸膜和肺内血管的损伤概率相对小,而大角度的斜行穿刺会增加对胸膜和肺组织的牵拉力,增加并发症发生概率,同时斜行的路径一般会使针道的损伤范围相应增大,所以避免大角度穿刺可以相对减少并发症的危险因素。还有重力作用对肺组织和血流灌注的影响,各处肺泡充气量不同,肺底部大于尖部,肺间质的弹性也具有一定差异[13]。同时,根据观察,靠近膈面的肺底部结节,其呼吸动度在2.5~3.5 cm。通过训练和控制患者的呼吸,选择患者平静呼吸状态下的呼气末期,或保持在患者的同一呼吸时相的分步进针,可以降低呼吸运动产生的动度影响。
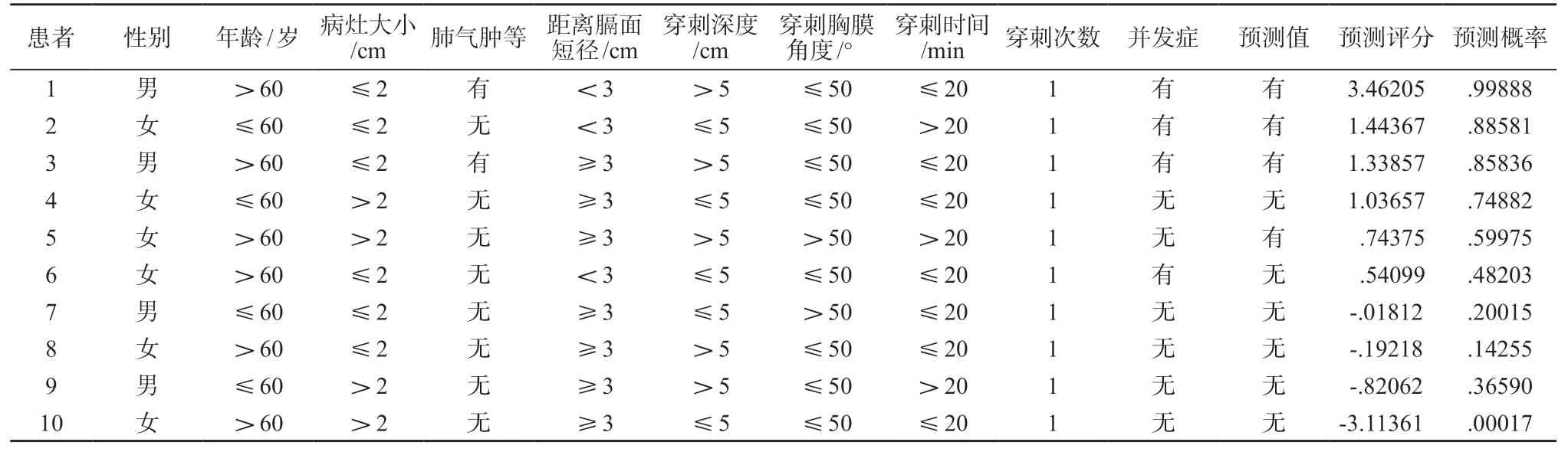
表 5 Fisher 判别直观显示10 例样本的并发症发生概率,辅助临床工作
既往文献对CT 引导下PTNB 并发症危险因素的研究,多限于陈列出各种单因素或/和多因素的分析结果,鲜有构建一套评估系统的报道[5]。本次研究纳入有统计学意义的指标,探索性的尝试通过机器学习算法,训练样本187 例,初步构建Fisher判别函数,结果显示预测模型拥有较高的准确率、灵敏度、特异度,分别为89.8%、85.4%、91.4%。应用后40 例实践,三者分别为92.5%、88.9%、93.5%,证实模型的运行可靠有效。我们注意到该模型在并发症的预测概率>85%时,错判率仅为2/35(5.7%),预测概率>70%时,错判率为4/35(10.3%),表现优异,但预测概率在50%附近时,由于非“无”即“有”的二分类评判原则,易发生错判,错判率高达6/13(46.2%),所以需要了解它的原理,注意灵活应用[14]。
Fisher 判别是一种多元统计分析方法,其基本思路是通过将多维空间中的样本和总体投影转化为一维数值,构建一维数据的线性函数。假设已知A、B 两类观察对象,纳入有统计学意义的指标,分别记录为X1、X2、X3 Xn,得到线性函数组合Z =C1X1 + C2X2 + C3X3 + + CnXn,将并发症的危险因素赋值后代入公式,逐例计算各自的函数值Z,再根据个案距离母体的亲疏程度进行判别,既根据Z值离A、B 两类群组重心的距离远近,从而归入离得最近的群组。例如,当某个案的判别函数值Z 值靠近A 类别重心时,判为A 类,Z 值靠近B 类别重心时,判为B 类,A 与B 类别重心的中点为判别界值。它借用了一元方差分析的理念,其优势在于根据组间与组内的均方差之比最大的原则来进行判别,换言之,最大化的缩小同类各样本的差异和扩大异类各样本的差异,使它们俩的比率达到最大,所以可以获得很高的判别准确率。然后采用交叉核实法计算Fisher 判别的误判概率,它又被称为“刀切法”,是指假设总体样本数量为n,按序剔除其中的一个样本,用余下的样本量(n-1)建立判别函数,再用模型去分析和判别这个被剔除的样本,并且每个样本逐一重复,这样n 次后完成一个循环,充分收集每个样品的信息,然后建立判别函数和进行验证,其预测能力优于传统的ARS 和列线图模型[15]。
表 5 应用SPSS 22.0 统计学软件包示例了10 个样本,评估得分从-3.11 361 至3.46 205 不等,与之相对应的并发症预测概率从0.00 017%至99.888%不等。据此,可以根据患者和穿刺靶点的具体情况,得到直观的并发症预测概率值,便于医患交流PTNB 的风险评估。从Fisher 判别模型中,可以注意到,病灶的大小和部位,以及合并肺气肿等疾病属客观存在的危险因素,穿刺的深度和角度是主观人为设计,穿刺的次数和时间会因术者的技术技巧或(和)患者配合度情况的不同而出现差异。应用预测模型可以提高手术团队对并发症危险因素的认知,辅助术者优化穿刺路线,关注穿刺技术和患者配合度的提高,对于预测概率高值的病例,提前规划好并发症的应对和护理工作,均有助于减低并发症的发生概率或严重程度[16]。在团队培养新人时,可以辅助教学和筛选适宜的病例,以匹配个人能力,循序渐进。
本次Fisher判别预测模型的探索存在不足之处;①本研究是回顾性分析,样本的选择存在一定的偏倚;②收集的并发症病例不够多;③连续性变量被简化为二分类变量,信息量有一定丢失。④没有逐一细分并发症的具体类型。因此,预测模型还需要在今后的工作中逐步完善,以此来获得更好的判别公式。
综上所述,应用Fisher 判别初步构建的CT 引导下PTNB 并发症的预测模型,其准确率、敏感度和特异度高,可以用于辅助临床预测CT 引导下PTNB并发症的发生概率。