马蜂柑响应黄龙病菌不同侵染时期的生物学和转录组学分析
滕彩玲,钟晰,吴昊娣,胡燕,周常勇,王雪峰
马蜂柑响应黄龙病菌不同侵染时期的生物学和转录组学分析
滕彩玲1,钟晰1,吴昊娣1,胡燕2,周常勇1,王雪峰1
(1中国农业科学院柑桔研究所国家柑桔工程技术研究中心,重庆 400712;2赣州市果业局,江西赣州 341000)
【】柑橘黄龙病(Huanglongbing,HLB)是制约柑橘产业发展的重大病害,我国发生的黄龙病由韧皮部杆菌亚洲种(‘Liberibacter asiaticus’,CLas)引起。本研究通过分析潜在耐黄龙病柑橘品种马蜂柑()在感染黄龙病后不同时期的生物学症状、显微结构和转录组学差异,揭示马蜂柑不同时期对黄龙病菌具有耐性的分子机理,为进一步深入挖掘抗性基因及开展抗病育种打下基础。以嫁接在两年生卡里佐枳橙砧木上的马蜂柑作为供试材料,使用只感染CLas、其他常见柑橘病毒类病原均呈阴性的毒源为接毒材料对马蜂柑进行接种,并在接种毒源后每隔15 d进行定期的荧光定量PCR检测。将马蜂柑接种毒源4个月(最早检测到CLas阳性)作为感病前期处理,接种毒源14个月作为感病后期处理,以健康植株为对照,进行生物学症状和显微结构观察,分析其感病后不同时期的结构变化。结合比较转录组学分析与荧光定量PCR验证,解析其耐病相关机制。症状观察发现,马蜂柑在感病前期和感病后期,植株叶片几乎不显症;显微结构观察表明,马蜂柑在感病前期中脉组织结构清晰,细胞形态正常,无淀粉粒积累的现象,仅在后期出现韧皮部极少数的筛管被堵塞;对转录组测序结果进行筛选鉴定,马蜂柑感病前期共筛选鉴定到181个差异表达基因,感病后期共筛选鉴定到1 384个差异表达基因;比较转录组分析表明,马蜂柑感病前期和后期的差异表达基因主要涉及细胞壁代谢、防御反应、淀粉与蔗糖代谢、胼胝质合成以及信号转导等方面,其中在感病前期,淀粉与蔗糖代谢、细胞壁代谢相关的调控基因下调表达,在感病后期,水杨酸代谢及其信号转导途径、病程相关蛋白和谷胱甘肽转移酶相关的调控基因上调表达。马蜂柑响应CLas早期侵染主要表现为物理结构稳定、淀粉合成和光合作用等途径不受干扰;而水杨酸介导的抗性信号转导、效应蛋白触发免疫反应(effector-triggered immunity,ETI)激活的病程相关蛋白和谷胱甘肽转移酶参与的解毒作用是感病后期的主要耐病机制。
柑橘黄龙病;韧皮部杆菌亚洲种;马蜂柑;耐病性;转录组
0 引言
【研究意义】柑橘黄龙病(Huanglongbing,HLB)是柑橘生产上的一种毁灭性病害,能侵染几乎所有的柑橘栽培品种[1],造成植株经济寿命缩短,产量锐减,果品品质变劣,并可在短期内导致植株死亡,从而造成巨大的经济损失[2]。自1919年Reinking首次在我国潮汕地区发现黄龙病以来,该病在中国的发生已有100多年,目前世界范围内仍未研发出治疗性的药剂[3]。我国发生的柑橘黄龙病由韧皮部杆菌亚洲种(‘Liberibacter asiaticus’,CLas)引起,由于CLas纯培养难题尚未攻克,病原致病机理尚不明确,极大程度地限制了病原生物学、病原-植物寄主互作及抗病基因工程育种的研究。以耐病品种马蜂柑()为研究材料,从生物学和转录水平上研究马蜂柑响应不同时期CLas侵染的应答机制,可为抗/耐黄龙病常规和转基因育种提供新思路。【前人研究进展】解剖学和生物学研究表明感染CLas引起的症状与淀粉累积和韧皮部组织坏死相关[4-7]。对不同柑橘品种及其近缘属对黄龙病的敏感性评价发现澳指檬()、来檬()、柠檬()、枳()等品种具有一定的抗/耐病性[8-10]。近年来,利用转录组学、蛋白质组学和代谢组学方法鉴定柑橘中黄龙病应答基因已取得了较大进展,柑橘感染黄龙病后,不同部位中的基因表达谱均已被解析[11-16]。CLas侵染后柑橘嫩叶、成熟叶和果实中的糖代谢和淀粉代谢相关基因的表达均受到了影响,其中叶片中蔗糖代谢和淀粉合成相关基因均被诱导上调表达,显症果实中蔗糖和棉子糖代谢相关基因被诱导上调表达,而淀粉合成相关基因被抑制表达[17-18]。光合作用相关基因在带病根、茎、叶中均下调表达[19-20],而在带病果实中却上调表达[10,21]。运用转录组学或蛋白组学技术比较了不同敏感度柑橘品种的不同部位响应CLas侵染后的差异,发现病菌侵染可导致柑橘蔗糖代谢[22]、淀粉代谢[17-18]、光合作用[19-21]、激素代谢[23-24]的平衡失调。CLas对寄主植物体内糖类的偏好性分解利用(如果糖)会导致寄主糖类代谢平衡失调,糖类代谢的失衡可能导致染病植株呈现生理及病理方面的症状[18]。柑橘黄龙病带病叶片的黄化症状与韧皮部堵塞和光合作用受抑制相关,而CLas侵染后寄主体内淀粉累积和胼胝质沉积是韧皮部堵塞的重要原因。淀粉累积的主要原因是淀粉分解过程受抑制[19]。感染CLas的柑橘中,茉莉酸(JA)和水杨酸(SA)的含量明显高于未感染CLas的柑橘[25]。笔者实验室前期对耐病品种马蜂柑和感病品种甜橙()早期感染黄龙病进行了比较转录组学研究,发现CLas侵染后甜橙的淀粉代谢和光合作用受到一定影响,但对马蜂柑无显著影响,马蜂柑中细胞壁代谢的激活和部分抗病蛋白相关基因的高水平表达与其防御能力相关[26]。【本研究切入点】近年来,在不同类型柑橘响应黄龙病菌侵染的转录组和蛋白组方面开展了大量研究,但尚无针对同一柑橘品种在感染黄龙病不同时期的比较转录组学研究。因此,有必要将感病前期和后期的马蜂柑进行生物学和转录组学分析,进一步了解感病不同时期马蜂柑显微结构及基因表达的变化。【拟解决的关键问题】以对柑橘黄龙病具有一定耐性的马蜂柑为材料,分别设置感病前期和感病后期两个时间节点。通过生物学和转录组学对两个时间节点进行比较研究,观察二者在相关代谢途径和防御反应上的差异,揭示马蜂柑在感病前期和后期的不同耐病调节机制。
1 材料与方法
试验于2017—2019年在中国农业科学院柑桔研究所国家柑桔工程技术研究中心完成。
1.1 供试毒源及苗木
黄龙病毒源:笔者实验室保存毒源采自江西赣州八镜台的琯溪蜜柚(cv. Guanximiyou)。该样品中柑橘衰退病毒(,CTV)、柑橘碎叶病毒(Citrus tatter leaf virus,CTLV)、温州蜜柑萎缩病毒(,SDV)、柑橘裂皮病类病毒(,CEVd)等常见柑橘病毒类病害检测结果均呈阴性。试验苗木:马蜂柑接穗嫁接于两年生卡里佐枳橙(×)砧木,苗木放置于国家柑橘苗木脱毒中心温室,温度为(25±3)℃。试验处理:通过芽接的方式将毒源嫁接在试验苗木上,两个月后每隔15 d进行定期qPCR检测。第一批次接种毒源传毒并放置到14个月的马蜂柑苗木作为感病后期处理;第二批次接种毒源并首次检测到(约4个月)带毒的马蜂柑作为感病前期处理;同时期接种无毒琯溪蜜柚的植株作为健康对照。两个时期分别选3株植株作为生物学重复,健康对照取2株作为生物学重复。
1.2 Spurr树脂样品制备及切片观察
取感病前期和后期的马蜂柑叶片及相应的健康叶片的中脉,切取2 mm×1 mm大小置于1.5 mL离心管中;加入固定液,固定过夜;用钾盐缓冲液漂洗样品;用不同梯度的丙酮溶液浸渍样品去除样品水分;加入Spurr树脂与纯丙酮溶液(体积比1﹕3)渗透,每4 h追加一次的Spurr树脂,3次后纯树脂过夜;在包埋模中放上渗透好的样品,加入纯树脂后,放入70℃恒温箱中聚合过夜;得到树脂样品,切片染色观察。
1.3 RNA提取及转录组建库、测序
取感病前期、后期和健康植株的完全展开嫩叶,使用Trizol法提取总RNA。用Agilent RNA 6000 Nano试剂盒处理样品后,利用NanoDrop One检测总RNA样品的纯度,用Agilent 2100检测总RNA样品的浓度、28S/18S 以及RIN值。质检合格后的样品用于文库构建,再利用BGISEQ-500平台进行双末端测序,并进行3次技术重复(深圳华大基因股份有限公司)。
1.4 序列分析
测序的原始数据去除低质量、接头污染和未知碱基N含量过高的reads后,得到clean reads,使用HISAT将clean reads比对到甜橙参考基因组序列(http://www. ncbi.nlm.nih.gov/genome/10702)。使用Bowtie 2将clean reads比对到参考序列,再使用RSEM计算基因和转录本的表达水平。使用PossionDis算法进行差异基因检测,参数为fold change(FC)≥2.00,-value ≤0.005,FDR≤0.001。差异表达基因(differentially expressed gene,DEG)功能分析,将差异表达基因通过Gene Ontology(GO)数据库(http://www.geneontology. org/)进行功能分类,同时基于NCBI mercator.results数据,利用MapMan软件对差异基因进行代谢途径分析。
1.5 差异表达基因的RT-qPCR验证
选择不同代谢途径差异表达基因,同时选取在测序样品中表达量一致的(甘油醛-3-磷酸脱氢酶)作为内参基因。以不同时期马蜂柑叶片总RNA为模板,反转录合成cDNA第一链。利用GoTaq® qPCR Master Mix(Promega)荧光定量试剂盒进行实时定量PCR。使用Primer Premier 5.0 应用软件设计RT-qPCR引物,由深圳华大基因股份有限公司合成(表1)。利用Bio-Rad iQ5进行2-ΔΔCT分析,并换算成log2FC,计算基因相对表达水平。
2 结果
2.1 马蜂柑感染黄龙病前期、后期的生物学分析
观察感染黄龙病前期(接种CLas 4个月,病原菌检测阳性)和后期(接种CLas 14个月,病原菌检测阳性)的马蜂柑植株,发现马蜂柑接种CLas后,未表现出明显的黄龙病症状,生长也未受到显著影响(图1-A、1-B、1-C)。

表1 RT-qPCR基因及引物
通过光学显微镜观察马蜂柑健康和感病样品的中脉组织发现,健康和感病样品的大部分组织结构都比较清晰,皮层薄壁细胞排列整齐,木质部细胞大而疏松,韧皮部细胞排列紧密(图1-D、1-E、1-F)。感病样品的大多结构无明显异常,进一步放大观察可以发现感病前期样品的韧皮部有极少数的筛管被堵塞,感病后期样品筛管堵塞量比前期略多(图1-H、1-I),未观察到淀粉粒积累的现象。
2.2 差异表达基因及功能注释
马蜂柑感病前期,与健康对照相比,有149个基因上调表达,32个基因下调表达,共计出现181个差异表达基因;马蜂柑感病后期,与健康对照相比,有386个基因上调表达,998个基因下调表达,共计出现1 384个差异表达基因。马蜂柑感病前期与后期比较,有542个基因上调表达,1 115个基因下调表达,共计1 657个差异表达基因。
将差异表达基因进行GO功能分类,主要分为生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组分(cell component,CC)三大类。对三大功能类单独进行进一步的分类和富集,得到不同时期、不同类别差异表达基因富集最多的前5个GO分类。马蜂柑感病前期,生物过程共富集差异基因63个,富集最多的GO分类是光合作用和信号过程等;分子功能共富集差异基因68个,富集最多GO分类是转移酶活性和电子载体活性等;细胞组分共富集差异基因37个,富集最多的是膜和膜部分相关等;马蜂柑感病后期,生物过程共富集差异基因536个,富集最多GO分类是多糖代谢过程和外部封装结构组织等;分子功能共富集差异基因623个,富集最多的是催化活性和转移酶活性等;细胞组分共富集差异基因298个,富集最多是膜和膜部分等。
2.3 差异表达基因比较分析
利用MapMan软件进行Pageman分析,将马蜂柑感染CLas后两个时间节点的差异表达基因代谢途径富集可视化(图2)。在马蜂柑感染黄龙病前期,生物胁迫反应和核苷酸代谢下调表达,蛋白质降解(半胱氨酸蛋白酶)和LRR XII受体激酶上调表达;在马蜂柑感染黄龙病后期,细胞壁相关、脂类代谢、过氧化物酶代谢、蛋白质降解(天冬氨酸蛋白酶)和氨基酸代谢下调表达,生物胁迫、激素代谢(水杨酸和茉莉酸)、细胞色素P450、RNA转录调控(MADS-box转录因子家族和WRKY转录因子家族)、蛋白质降解(泛素相关)和受体激酶等代谢途径上调表达。
为进一步明确与耐病机制相关代谢途径中差异基因表达的具体情况,利用Mapman软件将马蜂柑两个时间节点感染黄龙病菌后的差异表达基因按功能进行分类,差异基因主要集中在糖代谢、光合作用、细胞壁代谢、激素代谢、PR-蛋白、氧化还原反应等代谢途径。
2.3.1 淀粉和蔗糖代谢与光合作用相关差异基因的表达分析 CLas侵染寄主植物后,叶片出现黄化现象与CLas造成寄主植物叶片中淀粉过度累积进而导致叶绿体分解有关。在马蜂柑感病前期,与蔗糖分解有关的-呋喃果糖苷酶转化酶A基因()和己糖激酶基因()均下调表达;淀粉合成途径中,在马蜂柑感病前期并未出现相关基因的差异表达。马蜂柑感病后期,与蔗糖分解有关的蔗糖合酶基因()和己糖激酶基因()呈下调表达;淀粉合成途径中,葡萄糖-1-磷酸腺苷酰转移酶基因()下调表达(图3-A)。
CLas的侵染在一定程度上抑制了马蜂柑寄主的光合作用。马蜂柑感病前期,与光系统Ⅱ相关的PsbD 和PsbC蛋白相关基因下调表达;感病后期,与光系统Ⅱ相关的PsbW和PsbP蛋白相关基因和多个捕光复合体II叶绿素a/b结合蛋白基因()均下调表达(图3-B)。

A:健康植株Mock plants;B:感病前期CLas-infection at the early stage;C:感病后期CLas-infection at the late stage;D:健康对照叶中脉leaf midrib of healthy control;E:感病前期叶中脉CLas-infected leaf midrib at the early stage;F:感病后期的叶中脉CLas-infected leaf midrib at the late stage;G:D局部放大照片magnification of D;H:E局部放大照magnification of E;I:F局部放大照片magnification of F;Co:皮层细胞cortex;Fi:纤维细胞fiber;Ph:韧皮部phloem;Pi:髓心细胞pith;X:木质部xylem;Sc:分泌腔secretory cavity;图中箭头所指的蓝色斑点代表堵塞的筛管The blue spot indicated by arrow represents phloem plugging

CH-M-VS-CH-HLB-E:马蜂柑染病前期与健康对照相比DEGs in CLas-infected C. hystrix at the early stagecompared withhealthy control; CH-M-VS-CH-HLB-L:马蜂柑染病后期与健康对照相比DEGs in CLas-infected C. hystrix at the late stage compared withhealthy control。下同The same as below

彩色方块代表上调或下调表达的差异基因Colored squares indicate up- or down-regulated genes。图4同The same as Fig. 4
2.3.2 细胞壁代谢相关差异基因的表达分析 在马蜂柑感病前期,编码与纤维素合成相关的类纤维素合酶C基因家族基因()、类纤维素合成酶D基因家族基因()和果胶酯酶合成相关的果胶酯酶抑制因子基因()均下调表达。在马蜂柑感病后期,细胞壁代谢相关基因均呈下调表达,且下调表达倍数较大,包括纤维素合成相关的类纤维素合酶A基因家族基因(纤维素合酶A基因()和COBRA-like蛋白基因();半纤维素合成相关的半乳糖醛酸转移酶1样蛋白基因()、木聚糖-葡糖醛酸糖基转移酶基因()、-1,4-木糖基转移酶基因();细胞壁蛋白相关的簇状阿拉伯胶原蛋白基因();细胞壁降解相关的木葡聚糖内糖基酶基因()、内切葡聚糖酶基因()、鼠李糖半乳糖酸裂解酶B基因);细胞壁修饰相关的扩张蛋白基因(、)、果胶酯酶基因()和果胶酯酶抑制因子基因()以及胼胝质合成相关的胞间连丝与胼胝质结合蛋白3基因()和胼胝质合成酶3基因()(图4)。
2.3.3 激素相关差异基因的表达分析 在马蜂柑感病前期,茉莉酸途径中,多个具有ZIM结构域的转录抑制因子基因()下调表达。在马蜂柑感病后期,茉莉酸途径中,与茉莉酸合成相关的脂氧合酶2基因()上调表达、与信号转导相关的转录因子基因()下调表达;水杨酸途径中,水杨酸合成相关的异分质酸合成酶基因()、水杨酸甲酯化相关的苯甲酸羧甲基转移酶基因()均下调表达,水杨酸甲酯化相关的水杨酸羧甲基转移酶基因()与水杨酸糖基化相关的病原菌诱导的UDP葡萄糖基转移酶基因()以及水杨酸下游信号转导相关的病程相关蛋白1基因()均上调表达(图4)。
2.3.4 免疫防御反应相关差异基因的表达分析 在马蜂柑感病前期,病原相关分子模式触发的免疫反应(PAMP-triggered immunity,PTI)系统中,与Ca2+-CaM信号系统相关的钙依赖性蛋白激酶基因()、钙调蛋白基因()、呼吸爆发氧化酶基因()均表现为下调表达,与识别相关的多个受体蛋白基因()上调表达但下游相关转录因子未出现差异表达;效应蛋白触发的免疫反应(effector-triggered immunity,ETI)系统中,无相关基因的差异表达。而在马蜂柑感病后期,PTI系统中,与Ca2+-CaM信号系统相关的环核苷酸门控通道蛋白基因()的多个相关基因上调表达,钙依赖性蛋白激酶基因()、钙调蛋白基因()和呼吸爆发氧化酶基因()轻微上调表达,与识别相关的多个受体蛋白基因()上调表达且个数增多但下游相关转录因子依旧未出现差异表达;ETI系统中,相关的抗病蛋白基因(1.8倍)(1.7倍)(2.1倍)出现了上调表达(图4)。
2.3.5 病程相关蛋白与抗病相关基因的表达分析 在马蜂柑感病前期,多个抗病蛋白基因被CLas诱导下调表达,主要是TMV抗性蛋白。而在感病后期,前期下调的TMV抗性蛋白基因表现出回升趋势,同时也新增多个抗病蛋白基因的差异表达,上调表达的基因包括抗病性蛋白(CC-NBS-LRR类)家族基因的等,含NB-ARC结构域抗病性蛋白基因的等;以及同时受SA和PTI调控的蛋白基因;属于Kunitz家族胰蛋白酶和蛋白酶抑制剂蛋白的神秘果素样蛋白基因()和21 kD种子样蛋白基因()在马蜂柑感病后期下调表达。在马蜂柑感病后期,5个谷胱甘肽S转移酶基因()以及2个热休克蛋白基因()均上调表达(图4)。
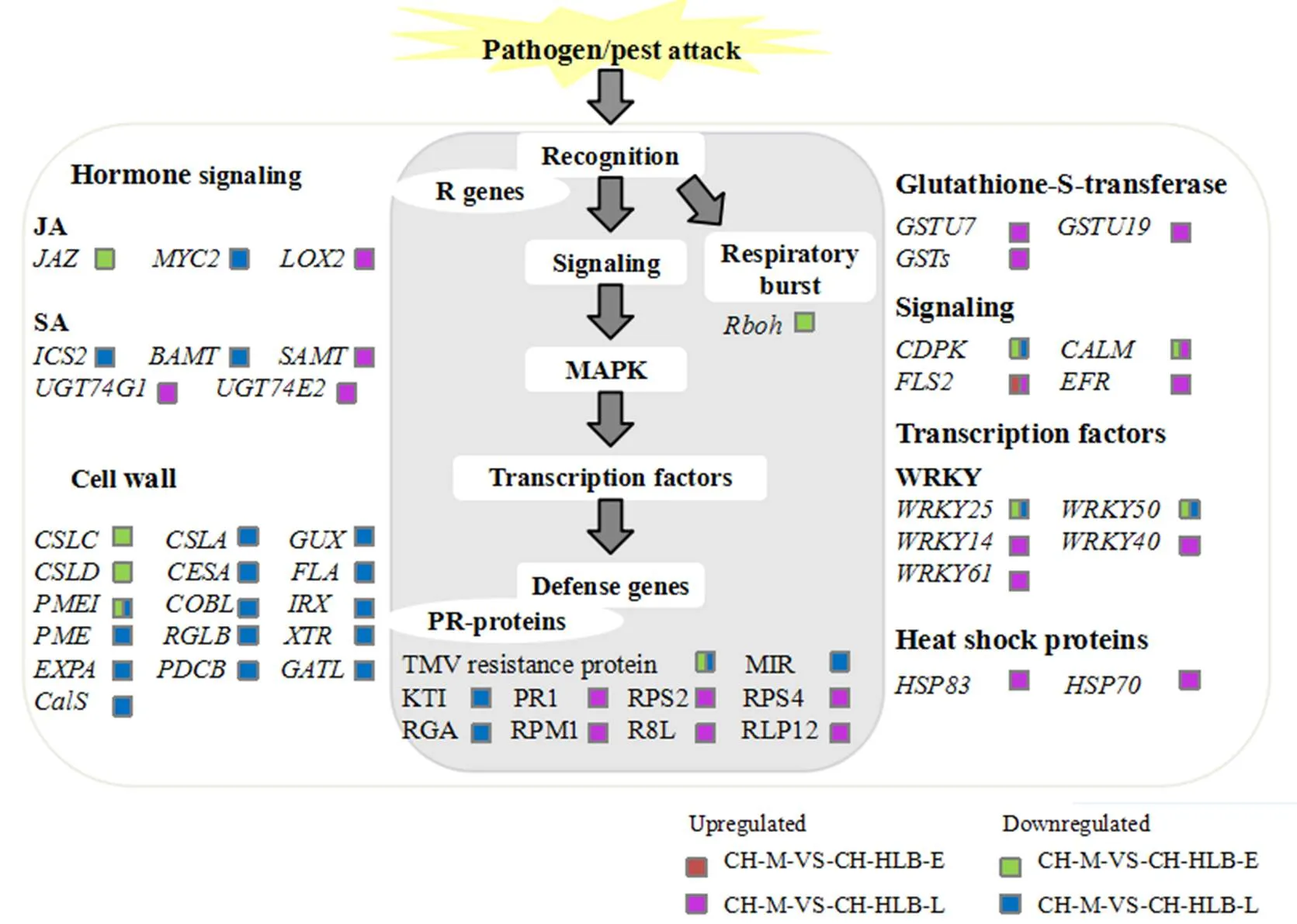
图4 马蜂柑感染黄龙病菌不同时期生物胁迫相关差异表达基因
2.4 RT-qPCR验证
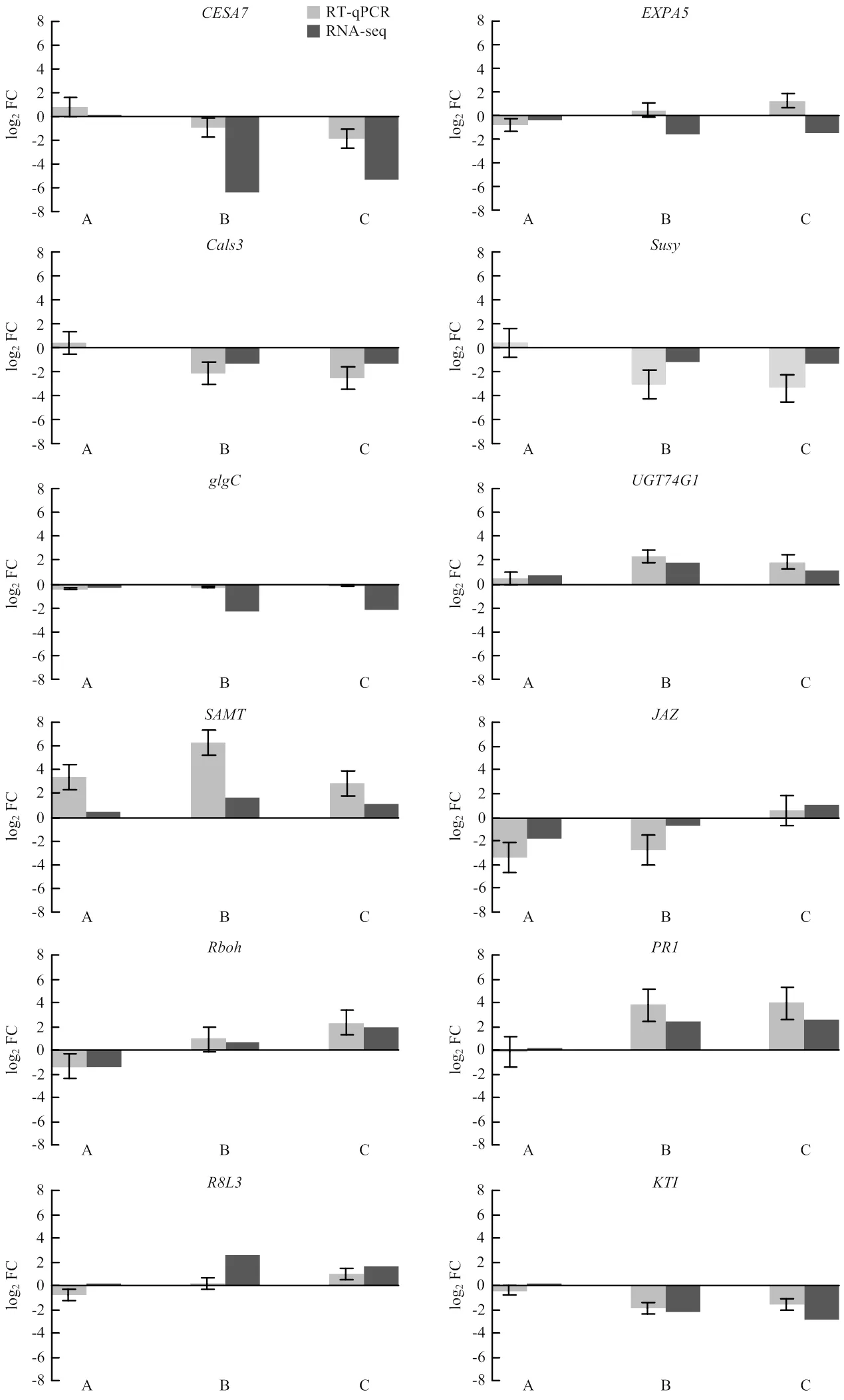
从不同的基因功能分类中挑选了12个基因进行RT-qPCR验证,10个基因RT-qPCR结果与RNA-seq测序结果的相对表达量变化趋势基本保持一致,证明RNA-seq测序结果具有较高的准确性。其中细胞壁代谢相关的在前期二者趋势一致;在后期RNA-seq结果中下调1.6倍,而RT-qPCR结果则轻微上调,后期与前期相比上调幅度较大。胼胝质沉积相关的和抗病相关的在前期RT-qPCR结果与RNA-seq测序结果有细微偏差,但后期变化趋势保持一致。值得关注的是:蔗糖和淀粉代谢相关的,激素代谢相关的以及抗病相关的的RT-qPCR结果均高于RNA-seq测序结果(图5)。
3 讨论
3.1 马蜂柑响应CLas早期侵染的耐病机制
在感病柑橘的叶片中脉、茎和根中观察到不同程度的淀粉积累和韧皮部堵塞现象[5,27]。Folimonova等[8]研究了30 种不同基因型的柑橘对黄龙病的响应,根据症状发展和持续生长的能力,将不同基因型分为敏感、中度耐受和耐受3类。对耐受型粗柠檬与敏感型甜橙的叶、茎和根组织进行解剖学比较分析,发现在粗柠檬中观察到的破坏性解剖结构变化(韧皮部细胞塌陷、淀粉沉积、韧皮部纤维缺乏)比甜橙少。同样的现象在Fan等[28]的研究中也得到了印证。Deng等[29]比较观察敏感型‘Valencia’甜橙和耐病型‘LB8-9 Sugar Belle’杂柑、‘Bearss’柠檬的叶片和叶中脉显微结构,发现与敏感型‘Valencia’甜橙的韧皮部相比,耐病型‘LB8-9 Sugar Belle’杂柑、‘Bearss’柠檬的韧皮部有大量的再生;韧皮部分裂程度越低,韧皮部再生能力越强,是影响不同柑橘品种HLB耐受性的两个关键因素。马蜂柑感病前期、后期均未明显的黄龙病症状;比较观察马蜂柑健康和感病样品的中脉组织切片,二者结构无明显异常,且到感病后期所受影响依旧较小,表明马蜂柑韧皮部结构稳定,使其对CLas具有一定的耐病性。
A: CH-M-VS-CH-HLB-E; B: CH-M-VS-CH-HLB-L; C: CH-HLB-E-VS-CH-HLB-L
CLas的侵染可导致韧皮部损伤和筛孔堵塞,这可能限制矿物质营养素和各种有机化合物从根际到植物或从老叶到新芽的吸收和运输[13]。纤维素酶、扩张蛋白和果胶酯酶均与细胞壁的破坏有关,这些基因的高表达可能是导致敏感寄主表现症状的原因之一[30]。甜橙感染黄龙病后,多个编码CESA、CSLA和COBL蛋白的基因显著下调表达,使得寄主的适应能力减弱,从而有利于病原菌的侵染[26]。扩张蛋白、PP2和胼胝质与CLas感染引起的韧皮部损伤有关[31-32]。相关研究表明扩张蛋白可能导致CLas影响的叶片种类变硬,韧皮部细胞壁扭曲[32]。Wang等[30]研究发现编码该蛋白的基因在感病品种‘Marsh’葡萄柚中表达水平高于耐病品种‘Jackson’葡萄柚,推测其可能与品种对黄龙病的敏感性相关。本研究中,相关基因的下调表达比例、数量随病原菌侵染时间的推移而不断增加,说明马蜂柑细胞壁对CLas侵染的限制能力随时间的推移在不断减弱。而在马蜂柑感病后期,扩张蛋白和木葡聚糖内糖基酶的表达下调,推测可能与抵抗病原菌侵染相关,但其具体调节模式有待进一步研究。
韧皮部坏死导致运输受阻是蔗糖、淀粉等碳水化合物在叶片中大量积累的主要原因[33]。早期研究发现,甜橙感染黄龙病后,与淀粉合成有关的酶基因上调表达[27]。本研究中,蔗糖分解在感病前期受到抑制且随病原菌侵染时间的推移而不断加强;而淀粉合成途径在感病前期不受影响、随病原菌侵染时间的推移开始抑制;光合作用中光的吸收在马蜂柑侵染过程中会受到持续的干扰,但差异表达相关基因较少。由此推测在蔗糖分解和淀粉合成通路上相关基因的下调表达和光合作用所受影响较小,是马蜂柑对CLas侵染作出的耐病性调节反应。
3.2 马蜂柑响应CLas后期侵染的主要耐病机制
植物通过激活病原物相关分子模式(pathogen- associated molecular pattern,PAMP)诱发免疫反应(PTI)或效应蛋白触发免疫反应(ETI),保护自身免受病原体的攻击[34-35]。植物PAMP的信号在细胞膜表面,而CLas存在于细胞内,由于这种物理隔离的存在,推测寄主对CLas进行防御反应时可能无PTI的参与[36-37]。Shi等[38]通过对耐病型‘Sun Chu Sha’杂柑和敏感型‘Duncan’葡萄柚的研究表明,两种基因型间PTI水平的差异与HLB耐受性水平相关。高度或中度耐病的柑橘基因型中没有发现PTI反应的迹象,由此推测其耐病性可能与抗性相关基因的表达、病程相关蛋白(PRs)的分泌和防御型植物激素(如水杨酸、茉莉酸)的激活相关[39]。本研究中,随病原菌侵入时间的增加PTI系统中相关的上游调控基因种类和数目不断增加,差异表达也由原来的下调表达转变为上调表达模式,但未发现其下游调控基因的变化。因此,推测马蜂柑在响应CLas的侵染过程中PTI免疫系统未能被激活。随着侵染时间延长,在后期3种抗性蛋白的相关基因均出现了上调表达,且上调幅度较大,说明ETI系统参与了马蜂柑后期防御CLas的过程。
植物激素在植物与病原菌互作的过程中扮演重要角色,参与植物抗病机制。以水杨酸、茉莉酸和乙烯为代表的免疫反应得到了广泛的讨论。植物受到病原菌侵染时,水杨酸介导产生的过敏性反应(HR)和系统获得性抗性(SAR)使植物获得一定的抗/耐病能力[40]。水杨酸羧甲基转移酶(SAMT)是植物在远端叶片累积水杨酸或水杨酸葡糖糖苷(SAG),转化水杨酸的关键基因[41]。MeSA与柑橘黄龙病的耐受性有关,CsSAMT1和CsSABP2-1参与了MeSA与水杨酸的相互转化,与耐病酸柚中MeSA的累积有关,耐病酸柚具有较强的SAR反应[42]。水杨酸依赖的通路,通常导致SAR标记致病相关(PR)基因(和编码基因等)在局部和系统植物组织中的诱导表达[43]。根部中的上调表达使得施文格枳柚(×)与Cleopatra桔()相比,其能更有效地抵抗CLas[44]。马蜂柑感病后期,水杨酸羧甲基转移酶基因()的上调表达与甲基化水杨酸,远距离传输防御信号,触发相关防御反应;UDP葡萄糖基转移酶基因()的上调表达将水杨酸糖基化转化为非生理活性的水杨酸酰葡萄糖酯(SGE)和SAG两种水杨酸苷储存在液泡中,为后续持续激活水杨酸触发的反应做储备;水杨酸途径的标志基因的上调表达与抵抗CLas、提高马蜂柑抗性相关。
不同类别的病程相关蛋白在CLas侵染后被诱导差异表达,包括受体蛋白激酶、含TIR-NBS-LRR、CC-NBS-LRR和NB-ARC等结构域的抗性蛋白、Kunitz家族胰蛋白酶和蛋白酶抑制剂蛋白等[16,18,45-46]。在本研究中,从前期抗病蛋白的下调表达,再到后期抗病蛋白表达的回升和新增抗病蛋白的上调,表明马蜂柑后期防卫反应更强烈。研究表明,在CLas侵染柠檬后,某些防御蛋白反而下调表达,推测该类蛋白不是CLas诱导的特异蛋白,而是参与非寄主抗性的蛋白,这些蛋白的降低表达有助于CLas侵染下的寄主保留能量[19]。因此,在马蜂柑中下调表达的病程相关蛋白,是否与马蜂柑耐病性相关有待进一步研究。
Martinelli等[47]通过比较感病品种脐橙和耐病品种‘Volkameriana’柠檬感染黄龙病后的蛋白组学差异,发现与植物解毒途径有关的4个谷胱甘肽-S-转移酶(GSTs)仅在耐病品种‘Volkameriana’柠檬上调表达,推测解毒途径可能在提高黄龙病抗性中发挥重要作用,并提出的高表达是HLB耐受基因型的潜在候选标记。本研究中,在马蜂柑感病后期,5个均上调表达,可能与提高马蜂柑对CLas的耐受性相关。
4 结论
通过比较耐病品种马蜂柑在感染黄龙病不同时期的生物学和转录组学差异,发现马蜂柑响应CLas早期侵染主要表现为韧皮部结构稳定,细胞壁代谢、淀粉合成和光合作用等途径不受干扰;而水杨酸介导的抗性信号、效应蛋白触发免疫反应激活病程相关蛋白、谷胱甘肽转移酶参与的解毒作用是感病后期的主要耐病机制。
[1] BOVÉ J M. Huanglongbing: a destructive, newly-emerging, century-old disease of citrus., 2006, 88(1): 7-37.
[2] 胡燕,王雪峰,周常勇.柑橘黄龙病菌亚洲种、虫媒及植物寄主互作研究进展.园艺学报,2016,43(9):1688-1698.
HU Y, WANG X F, ZHOU C Y. Recent advances in interactions among ‘Liberibacter asiaticus’, insect vector and plant host.,2016,43(9):1688-1698. (in Chinese)
[3] Reinking O A. Diseases of economic plants in Southern China.,1919, 8(4): 109-134.
[4] Schneider H. Anatomy of greening-diseased sweet orange shoots., 1968, 58(1): 1155-1160.
[5] Etxeberria E, Gonzalez P, Achor D, ALBRIGO G. Anatomical distribution of abnormally high levels of starch in HLB-affected Valencia orange trees., 2009, 74(1):76-83.
[6] Albrecht U, Bowman K D. Transcriptional response of susceptible and tolerant citrus to infection with‘Liberibacter asiaticus’., 2012, 185/186:118-130.
[7] Boava L P, Cristofani-yaly M,Machado M A. Physiologic, anatomic, and gene expression changes in,and their hybrids after ‘Liberibacter asiaticus’ infection., 2017, 107(5):590-599.
[8] Folimonova S Y, Robertson C J, Garnsey S M, GOWDA S, DAWSON W O. Examination of the responses of different genotypes of citrus to huanglongbing (citrus greening) under different conditions., 2009, 99(12):1346-1354.
[9] SHOKROLLAH H,ABDULLAH T L, SIJAM K, ABDULLAH S NA, ABDULLAH NAP. Differential reaction of citrus species in Malaysia to Huanglongbing (HLB) disease using grafting method., 2009, 4(1): 338.
[10] Martinelli F, URATSU S L, Albrecht U, REAGAN R L, PHU M L, Britton M, Buffalo V, Fass J, Leicht E, Zhao W, Lin D, D’Souza R, Davis C E, Bowman K D, DandekarA M. Transcriptome profiling of citrus fruit response to huanglongbing disease., 2012, 7(5): e38039.
[11] ALBRECHT U, BOWMAN K D. Gene expression in(L.) Osbeck following infection with the bacterial pathogen ‘Liberibacter asiaticus’ causing Huanglongbing in Florida., 2008, 175(3): 291-306.
[12] KIM J S, SAGARAM U S, BURNS J K, LI J L, WANG N. Response of sweet orange () to ‘Liberibacter asiaticus’ infection: microscopy and microarray analyses., 2009, 99(1): 50-57.
[13] FAN J, CHEN C, BRLANSKY R H, GMITTER F G, LI Z G. Changes in carbohydrate metabolism ininfected with ‘Liberibacter asiaticus’., 2010, 59(6): 1037-1043.
[14] Fan J, Chen C, Yu Q, BRLANSKY R H, LI Z G, GMITTER F G. Comparative iTRAQ proteome and transcriptome analyses of sweet orange infected by ‘Liberibacter asiaticus’.,2011, 143(3): 235-245.
[15] Albrecht U, Fiehn O, BOWMAN K D. Metabolic variations in different citrus root stock cultivars associated with different responses to Huanglongbing., 2016, 107: 33-44.
[16] ARITUA V, ACHOR D, Gmitter F G, ALBRIGO G, WANG N. Transcriptional and microscopic analyses of citrus stem and root responses to ‘Liberibacter asiaticus’ infection., 2013, 8(9):e73742.
[17] Martinelli F, Reagan R L, Uratsu S L, PHU M L, ALBRECHT U, ZHAO W, DAVIS C E, BOWMAN K D, DANDEKAR A M. Gene regulatory networks elucidating huanglongbing disease mechanisms., 2013, 8(9):e74256.
[18] Zhong Y, Cheng C Z, Jiang B, JIANG N H, ZHANG Y Y, HU M L, ZHONG G Y. Digital gene expression analysis of Ponkan mandarin (Blanco) in response to Asia citrus psyllid-vectored Huanglongbing infection., 2016, 17(7):1063.
[19] Fan J, Chen C, Yu Q, Khalaf A, Achor D S, Brlansky R H, Moore G A, Li Z G, Gmitter F G. Comparative transcriptional and anatomical analyses of tolerant rough lemon and susceptible sweet orange in response to ‘Liberibacter asiaticus’ infection., 2012, 25(11):1396-1407.
[20] Zhong Y, Cheng C Z, Jiang N H, JIANG B, ZHANG Y Y, WU B, HU M L, ZENG J W, YAN H X, YI G J, ZHONG G Y. Comparative transcriptome and iTRAQ proteome analyses of citrus root responses to ‘Liberibacter asiaticus’ infection., 2015,10(6):e0126973.
[21] Liao H L, Burns J K. Gene expression infruit tissues harvested from huanglongbing-infected trees: comparison with girdled fruit., 2012, 63(8):3307-3319.
[22] Duan Y P, Zhou L J, Hall D G, LI W B,Doddapaneni H, Lin H, Liu L, Vahling C M, Gabriel D W, Williams K P, Dickerman A, Sun Y J, COTTWALD T. Complete genome sequence of citrus huanglongbing bacterium, ‘Liberibacter asiaticus’ obtained through metagenomics., 2009, 22(8):1011-1020.
[23] Lu H, Zhang C, Albrecht U, Shimizu R, Wang G, BOWMAN K D. Overexpression of a citrus NDR1 ortholog increases disease resistance in., 2013, 4:157.
[24] Rosales R, Burns J K. Phytohormone changes and carbohydrate status in sweet orange fruit from Huanglongbing-infected trees., 2011, 30(3):312-321.
[25] Nehela Y, Hijaz F, Elzaawely A A, EL-ZAHABY H M, KILLINY N. Citrus phytohormonal response to ‘Liberibacter asiaticus’ and its vector., 2018, 102: 24-35.
[26] Hu Y, Zhong X, Liu X L, LOU B H, ZHOU C Y, WANG X F. Comparative transcriptome analysis unveils the tolerance mechanisms ofin response to ‘Liberibacter asiaticus’ infection., 2017, 12(12):e0189229.
[27] Koh E J, Zhou L, Williams D S, PARK J, DING N, DUAN Y P, KANG B H. Callose deposition in the phloem plasmodesmata and inhibition of phloem transport in citrus leaves infected with ‘Liberibacter asiaticus’., 2012, 249(3):687-697.
[28] Fan J, Chen C, Achor D S, BRLANSKY R H, LI Z G, GMITTER F G. Differential anatomical responses of tolerant and susceptible citrus species to the infection of ‘Liberibacter asiaticus’., 2013, 83:69-74.
[29] Deng H, Achor D S, Exteberria E, Yu Q, Du D, Stanton D, Liang G, Gmitter FG. Phloem regeneration is a mechanism for Huanglongbing-tolerance of ‘Bearss’ lemon and ‘LB8-9’ sugar Belle® mandarin., 2019, 10: 277.
[30] Wang Y S, Zhou L J, Yu X Y, STOVER E, LUO F, DUAN Y P. Transcriptome profiling of Huanglongbing (HLB) tolerant and susceptible citrus plants reveals the role of basal resistance in HLB tolerance., 2016, 7: 933.
[31] Lionetti V. PECTOPLATE: the simultaneous phenotyping of pectin methylesterases, pectinases, and oligogalacturonides in plants during biotic stresses.,2015, 6: 331.
[32] Owens R A, Blackburn M, Ding B. Possible involvement of the phloem lectin in long-distance viroid movement., 2001, 14(7):905-909.
[33] Folimonova S Y, Achor D S. Early events of citrus greening (Huanglongbing) disease development at the ultrastructural level., 2010, 100(9):949-958.
[34] Chisholm S T, Coaker G, Day B, STASKAWICA B J. Host-microbe interactions: shaping the evolution of the plant immune response., 2006, 124(4):803-814.
[35] Jones J D, Dangl J L. The plant immune system., 2006, 444(7117): 323-329.
[36] Zou H, GOWDA S, Zhou L, HAJERI S, CHEN G, DUAN Y. The destructive citrus pathogen, ‘Liberibacter asiaticus’ encodes a functional flagellin characteristic of a pathogen-associated molecular pattern., 2012, 7(9):e46447.
[37] Hao G X, Boyle M, Zhou L J, DUAN Y P. The intracellular citrus huanglongbing bacterium, ‘Liberibacter asiaticus’ encodes two novel autotransporters., 2013, 8(7):e68921.
[38] Shi Q C, Febres V J, Zhang S J, YU F H, MCCOLLUM G, HALL D G, MOORE G A, STOVER E. Identification of gene candidates associated with huanglongbing tolerance, using ‘Liberibacter asiaticus’ flagellin 22 as a proxy to challenge citrus., 2017, 31(2): 200-211.
[39] Da GRACA J V, Douhan G W, Halbert S E, KEREMANE M L, LEE R F, VIDALAKIS G, ZHAO H. Huanglongbing: An overview of a complex pathosystem ravaging the world’s citrus., 2016, 58(4):373-387.
[40] Zhang Y, Li X. Salicylic acid: Biosynthesis, perception, and contributions to plant immunity., 2019, 50: 29-36.
[41] ZHU F, Xi D H, YUAN S, XU F, ZHANG D W, LIN H H. Salicylic acid and jasmonic acid are essential for systemic resistance againstin., 2014, 27(6):567-577.
[42] Zou X, Bai X, Wen Q, XIE Z, WU L, PENG A, he y, xu l, chen s. Comparative analysis of tolerant and susceptible citrus reveals the role of methyl salicylate signaling in the response to Huanglongbing., 2019, 38:1516-1528.
[43] Van Loon L C, Rep M, Pieterse C M J. Significance of inducible defense-related proteins in infected plants., 2006, 44(1): 135-162.
[44] Wu J, Alfrez F M, JOHNSON E G, GRAHAM J H. Up-regulation of PR 1 and less disruption of hormone and sucrose metabolism in roots is associated with lower susceptibility to ‘Liberibacter asiaticus’., 2018, 67(6): 1426-1435.
[45] Fu S, Shao J, Zhou C, HARTUNG J S. Transcriptome analysis of sweet orange trees infected with ‘Liberibacter asiaticus’ and two strains of., 2016, 17: 349.
[46] Nwugo C C, Duan Y,Lin H. Study on citrus response to Huanglongbing highlights a down-regulation of defense-related proteins in lemon plants upon ‘. Liberibacter asiaticus’ infection., 2013, 8(6):e67442.
[47] Martinelli F, Reagan R L, Dolan D, FILECCIA V, DANDEKAR A M. Proteomic analysis highlights the role of detoxification pathways in increased tolerance to Huanglongbing disease., 2016, 16(1):167.
Biologic and Transcriptomic Analysis ofResponses to ‘Liberibacter asiaticus’ at Different Infection Stages
TENG CaiLing1, ZHONG Xi1, WU HaoDi1, HU Yan2, ZHOU ChangYong1, WANG XueFeng1
(1National Citrus Engineering Research Center, Citrus Research Institute, Chinese Academy of Agricultural Sciences, Chongqing 400712;2Ganzhou Bureau of Fruit Industry, Ganzhou 341000, Jiangxi)
【】Citrus Huanglongbing (HLB), associated with phloem-colonized ‘Liberibacter asiaticus’ (CLas), severely impedes worldwide citrus production. The objective of this study is to analyze the biological symptoms, microstructures and transcriptomes ofin response to CLas infection at different stages, to reveal the tolerance mechanism of, and to provide a basis for further screening of resistance genes and HLB-tolerant/resistant citrus breeding. 【】The budwoods ofgrafted on two-year-old Carrizo citrange rootstocks (×) used in this study were graft-inoculated with budwoods from a CLas (strain GZBJT)-infected Guanximiyou pummelo maintained in a greenhouse at Citrus Research Institute. The budwoods used as inoculum were tested CLas positive and free of other potential phloem-limited pathogens, such as(CTV) or Citrus tatter leaf virus (CTLV) by PCR before grafting. Inoculated plants were kept in greenhouse along with mock-inoculated healthy control plants. Real-time quantitative PCR (qPCR) was performed every 15 days after inoculation. Four months after inoculation (the earliest establishment of CLas by qPCR) and 14 months after inoculation were defined as the early infection stage and the late infection stage, respectively.The biological symptoms and microstructures were observed to analyze the structural changes of different infection stages. combined with comparative transcriptome and RT-qPCR validation, the response mechanism ofagainst HLB was explored.【】No typical symptom was observed inat the early and late stages of infection. Light microscopy observation from the midribs of HLB-affected and uninfectedrevealed that no significant structure change was found at the early infection stage and only a few sieves in the phloem were blocked at the late stage. By comparing the RNA-seq data, 181 and 1 384 genes were found to be differentially expressed at the early stage and late stage, respectively. Differentially expressed genes (DEGs) mainly involved incell wall metabolism, host defense response, starch and sucrose metabolism, callose synthesis and signal transduction. Comparative transcriptome analysis showed that the expression of related genes in starch and sucrose metabolism and cell wall metabolism was down-regulated at the early infection stage, and the expression of related genes in salicylic acid metabolism, salicylic acid signal transduction pathway, pathogenesis-related protein and glutathione-S-transferases was up-regulated at the late infection stage.【】The early response ofto CLas infection is mainly characterized by stable physical structure, undisturbed pathways such as starch synthesis and photosynthesisSalicylic acid-mediated resistance signals, effector-triggered immunity (ETI), and glutathione-S-transferases mediated detoxification contribute to the tolerance ofagainst CLas at the late infection stage.
citrus Huanglongbing; ‘Liberibacter asiaticus’ (CLas);; disease tolerance; transcriptome

10.3864/j.issn.0578-1752.2020.07.007
2019-09-01;
2019-10-15
国家重点研发计划(2018YFD0201500)、国家自然科学基金(31871925,31671992)
滕彩玲,E-mail:864569130@qq.com。钟晰,E-mail:767911863@qq.com。滕彩玲和钟晰为同等贡献作者。通信作者王雪峰,E-mail:wangxuefeng@cric.cn
(责任编辑 岳梅)

