肥煤自燃全过程热动力学特征参数研究
刘傲 刘梦华 李珂 赵鸿儒
(中国矿业大学(北京)应急管理与安全工程学院 北京 100083)
0 引言
煤自燃是煤矿安全生产面临的主要灾害之一,据有关数据统计,全国具有自燃倾向的煤炭约占煤炭总量的2/3,在我国现有煤矿中有54.9%的国有重点煤矿会有自燃发火的危险[1]。研究煤自燃热动力学特征参数对了解煤自燃机理及提出煤自燃预防措施具有十分重要的意义。
目前,国内外诸多学者采用不同的方法研究了煤自燃宏观动力学特性和活化能的变化规律[2-8],但相关研究主要集中在低温氧化阶段各指标变化规律的测量分析,针对煤自燃全过程的热动力学参数的研究甚少。本文利用同步热分析技术(STA)对煤自燃的热失重和放热过程进行了分析,借助煤自燃标志气体测定系统,测定了各标志气体的浓度随煤温变化的规律,并运用了活化能拟合分析方法对煤自燃的临界温度与阶段特征进行了分析。
1 实验
1.1 实验测试系统
煤自燃标志气体测定实验系统由中国矿业大学(北京)自主搭建,主要仪器为程序升温炉,见图1。STA-DSC同步热分析实验采用德国耐驰公司STA449F3型同步热分析仪,温度控制范围为-150~1 550 ℃,如图2所示。

图1 标志气体测定实验系统

图2 同步热分析仪
1.2 煤样制备及实验过程1.2.1 煤样制备
(1)将林西矿原始肥煤煤样筛分处理,形成1.25~1.6 mm,1.6~2 mm,2~3.5 mm,3.5~5 mm,5~7 mm 5种粒径的实验样品。
(2)将实验样品置于105 ℃的真空干燥箱内干燥24 h,取上述5种粒径煤样各40 g,充分混合后倒入洁净干燥的玻璃瓶内,用石蜡密封保存,防止肥煤煤样再次氧化。
1.2.2 实验过程
(1)煤自燃标志气体测定实验。将玻璃瓶内煤样置于绝热反应器中,设置空气流量为60 mL/min,升温炉以0.5 ℃/min升温,煤温每升高10 ℃采集指标气体,并进入气相色谱仪进行指标气体分析,记录采样时间和指标气体浓度。当炉温和煤温达到同一温度时,记录下交叉点温度Tcpt。煤温上升到410 ℃实验结束。
(2)STA-DSC同步热分析实验。取混合的肥煤煤样10 mg置于样品干锅中,将N2和O2以体积比4∶1通入同步热分析仪,流量设为100 mL/min,进行实验。待仪器升温至设定温度30 ℃,之后以10 ℃/min的升温速率加热煤样至900 ℃。
实验流程如图3所示。

图3 实验流程
2 实验结果与分析
2.1 工业分析
肥煤煤样的工业分析如表1所示。

表1 煤样工业分析结果 %
2.2 TG-DTG热失重分析
通过STA实验[9]研究,找到肥煤煤样在程序升温过程中发生自燃的各特征温度点T1~T8,如图4所示。煤样脱水结束前DTG达到最大值的温度为临界温度T1(45 ℃),水分完全蒸发结束时的温度为干裂温度T2(122 ℃),此时TG值在煤样着火前达到最小,TG从保持不变到开始增大的温度为活性温度T3(195 ℃),着火前增重速率最大点对应的温度为增速温度T4(265 ℃),TG曲线达到峰值的温度为质量极大值温度T5(342 ℃),煤氧开始燃烧的温度为着火温度T6(465 ℃),煤样失重最大时的温度为最大热失重速率温度T7(515 ℃),煤样重量不变时温度为燃尽温度T8(690 ℃),到达燃尽温度之后,TG值基本保持稳定。其中,质量极大值温度T5和最大热失重速率温度T7代表煤自燃的危险程度,T5越小代表煤样越容易与氧气反应,煤氧复合速率越快,煤样更容易自燃,T7越提前,煤自燃的危险性越大。
由图4可见,根据上述8个特征温度点将煤受热自燃过程分为6个阶段:水分蒸发及脱附阶段(T0~T2)、动态平衡阶段(T2~T3)、吸氧增重阶段(T3~T5)、受热分解阶段(T5~T6)、燃烧阶段(T6~T8)及燃尽阶段(>T8)。各阶段煤氧的质量变化具体如表2所示。
在T0~T2阶段,TG值的变化主要与水分有关,随着煤温的升高,煤样中的水分逐渐蒸发使得质量有下降的趋势,共减小了0.185%;从T2升至T3的过程中,煤中水分和气体进一步脱附,同时煤与氧结合发生化学吸附,两者达到动态平衡,TG值基本不变;煤温超过T3后,煤氧反应的速率逐渐增大,使得化学吸附量略微超过脱附量,整体上呈现增重的趋势,但增量不大,仅为3%左右,T4时煤氧复合速率最大,到T5质量达到极大值;在T5~T6温度段,煤受热发生分解释放出指标气体,质量降低了15%左右,同时产生大量热使温度快速升高,达到着火点T6;T6之后,煤样剧烈燃烧,不断释放出气体产物,TG值急剧下降,直至T8达到燃尽温度,样品中可燃物消耗殆尽,之后TG值基本不变,最终残余质量约为13%,反应结束。

图4 煤样TG-DTG曲线

表2 煤样在受热过程中不同阶段的质量变化
2.3 DSC释热参数分析
如图5所示,DSC曲线向下为放热方向,DSC值由正值转为负值的温度点为初始放热温度Tf0(60 ℃),曲线最低点代表煤氧复合过程中最大热释放速率所对应的温度Ts1(511 ℃),燃尽温度T8之后曲线不再波动,DSC值在0左右保持不变。煤氧在升温过程中的热量变化过程可分为两个阶段,即吸热阶段和放热阶段,分界点为Tf0[2],各特征温度点具体释热速率见表3。与TG曲线数据对比发现,Ts1与T7数值接近,由此可以得出在煤自燃过程中失重速率最大时其热释放速率同样最大的结论。

图5 煤样DSC曲线

表3 煤样在放热阶段不同特征温度点的释热速率
2.4 煤自燃标志气体产生规律
2.4.1 碳氧型标志气体产生规律
随着煤温的升高,CO和CO2体积分数整体呈上升趋势。由图6所示,升温初期,两者体积分数增加均比较缓慢,肥煤煤体本身吸附的CO2在升温初期释放使得CO2含量远高于CO。130 ℃之后,CO体积分数呈指数形增加,煤样进入快速氧化阶段,同时CO2体积分数加速升高。330 ℃之后,煤体中吸附的氧气大量释放,发生完全氧化反应,CO含量开始有下降的趋势并在一定范围波动。210 ℃以后CO和CO2增加速度较之前均有所减慢。

(a)CO

(b) CO2
2.4.2 烷烃标志气体产生规律
CH4,C2H6体积分数随煤温变化趋势大致相同(见图7):由于煤大分子结构内部吸附的部分气体解吸[9],升温实验开始阶段(煤温30 ℃)便有CH4,C2H6气体产生,CH4体积分数为93.679 8×10-6,C2H6体积分数为14.848 3×10-6。煤温从30 ℃升至120 ℃,CH4,C2H6体积分数几乎趋于平稳;到达拐点温度130 ℃时,CH4,C2H6体积分数均出现了暂时下降的现象;130 ℃至250 ℃,CH4,C2H6含量持续增加,且析出速度明显加快,由于在此阶段占主导地位的是煤氧化产生的CH4,C2H6,煤温达到拐点温度后,煤的氧化迅速加剧,产生指标性气体体积分数迅速增加,开始进入深度氧化阶段[10]。随着煤温继续升高,250 ℃至350 ℃,CH4,C2H6体积分数再次趋于平稳。
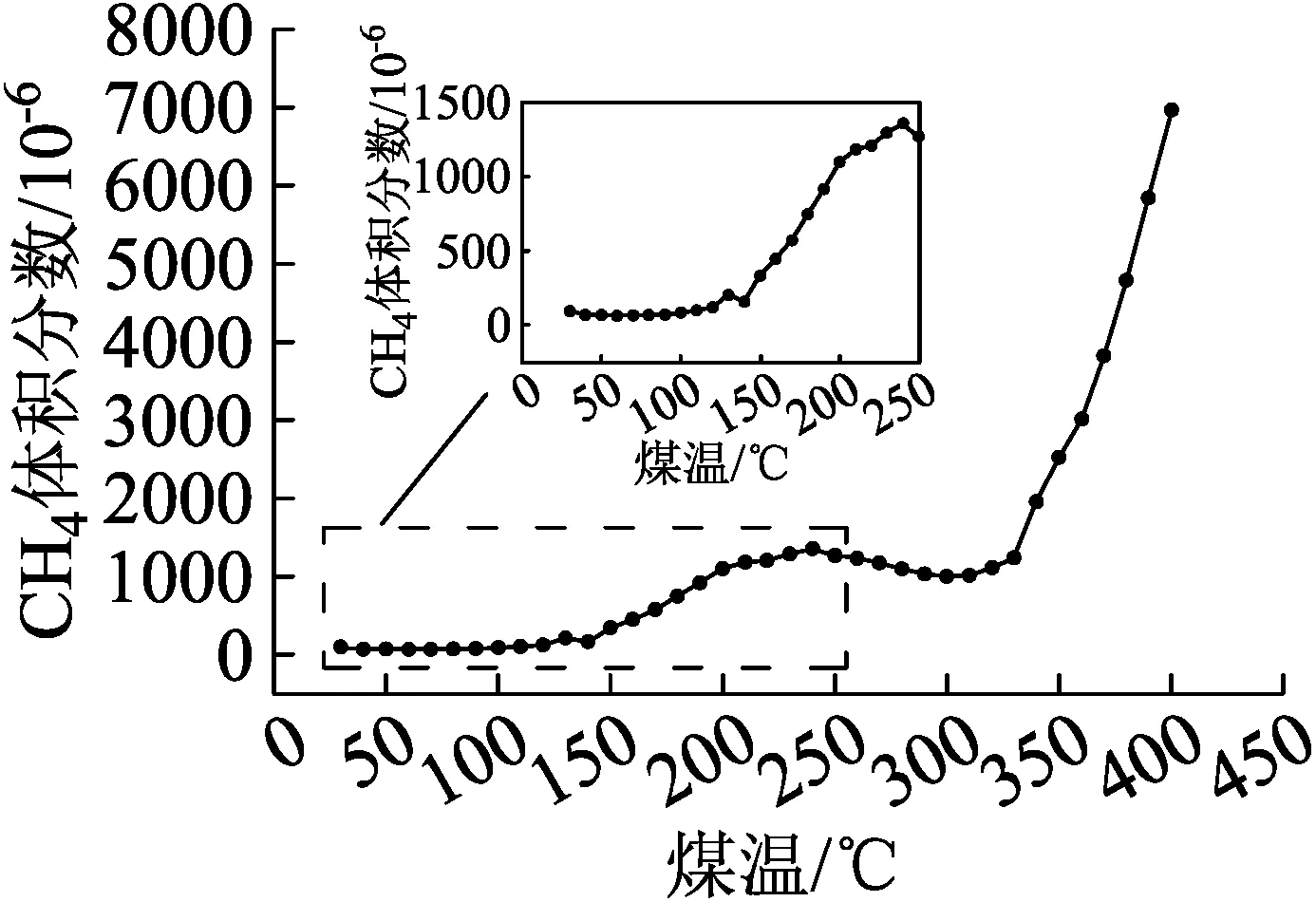
(a)CH4

(b)C2H6
2.4.3 烯烃标志气体产生规律
如图8所示,煤温为130 ℃时,开始有C2H4气体产生,体积分数为0.325×10-6,标志煤自燃进入剧烈氧化阶段。150 ℃至350 ℃,C2H4体积分数增长相对缓慢,其总体与温度呈现正相关的增长趋势,350 ℃之后,C2H4体积分数开始急剧增大。一方面是因为随着温度不断升高,氧化反应加剧进行,另一方面,煤样发生了低温热解反应,煤分子内部结构发生变化生成CH4[11]。
2.4.4 链烷比值分析
从开始升温到150 ℃,C2H6/CH4比值呈现平稳增长的规律,到150 ℃时出现一个较大的峰值0.8,之后继续保持增长。在300 ℃到350 ℃,C2H6/CH4比值下降,350 ℃左右降至最小值0.4,此后又急剧增大,随着煤温继续升高,该比值变化规律性不明显,具体见图9所示。

图8 烯烃标志气体随煤温变化曲线

图9 C2H6/CH4比值随煤温变化曲线
2.4.5 烯烷比值分析
如图10所示,在对煤样进行程序升温的过程中,C2H4/C2H6比值除在190~360 ℃有较强的规律性、呈上升趋势且上升速度较快外,其余范围内表现的规律性较差。

图10 C2H4/C2H6比值随煤温变化曲线
2.4.6 烯烃与碳氧化合物比值分析
C2H4/CO与C2H4/CO2变化趋势大致相同(见图11),130 ℃时C2H4开始出现,在130~350 ℃时C2H4/CO与C2H4/CO2比值增幅不明显,350 ℃后比值呈指数形式上升,短短数十摄氏度内比值增加到原来的十倍左右。主要是由于随着温度的持续升高,煤大分子内部结构发生变化,一部分大分子逐渐裂解生成C2H4[11],导致C2H4含量大量增加。
2.5 活化能与阶段特征分析
活化能是反映煤自燃倾向性的主要动力学特征参数之一,通过程序升温氧化实验得出活化能E,可以反映煤自燃低温氧化的内在反应特征,并且相较于绝热氧化法,程序升温实验在精确度相似的情况下大大缩短了实验时间。

图11 烯烃与碳氧化合物比值随煤温变化曲线
根据反应速率公式和阿累尼乌斯方程,得到煤与氧气不同反应阶段煤样罐出口CO体积分数与煤温T之间存在关系式为
通过上式可以看出,在通气量恒定的情况下,lnCout与1/T呈线性关系,通过实验测得煤与氧气不同反应阶段煤样罐出口CO体积分数,并做出lnCout-1/T的曲线图进行直线拟合,通过斜率的计算即可求得煤样不同反应阶段的表观活化能。
根据程序升温实验数据做出lnCout-1/T曲线,用Origin软件对其进行直线拟合,依据斜率的分布情况,拟合为五段,结果如图12所示。330 ℃后活化能变化较大,不再对该段数据进行分析。40~330 ℃内的四段拟合直线R2值均在0.9以上,代表直线拟合效果较好,由此得出的不同温度段煤样的活化能准确性较高。根据拟合结果得到3个表观活化能的突变点:70,180,220 ℃。

图12 煤样氧化过程活化能变化曲线
在40~70 ℃,根据斜率可知该阶段对应的煤的活化能较低,此时煤氧化反应所需能量较低,反应容易发生,是煤自燃氧化反应的初始阶段,70 ℃之后煤样活化能迅速升高,70 ℃可确定为实验用肥煤煤样的临界温度,该阶段属于煤氧化自燃的潜伏期。在实际生产中,此方法可以简化煤自燃临界点的确定过程,临界点越低,自燃发火危险性越大,对于采空区煤自燃防灭火的预警工作具有重要意义。
在70~180 ℃,活化能明显增大,一方面,该阶段开始生成C2H4,需要更多的能量积累;另一方面,随温度升高,煤样分子结构中的不稳定态官能团被分解成稳定官能团[7],需要提供更多的能量。实验测得的交叉点温度为179.8 ℃,与180 ℃相吻合。交叉点温度是煤自燃反应进入自热阶段的标志,该值越低表明煤自然倾向性越大。
在190~330 ℃,达到交叉点温度之后,进入快速氧化阶段,煤氧反应剧烈,生成大量热,依靠自身生成热量向反应提供热量,所需外界能量减少,活化能降低。随着温度的不断升高,反应更加剧烈,大量热生成并积聚,活化能进一步降低。煤样的活性温度是195 ℃,之后煤样开始增重,煤氧复合速率增大,与190 ℃大致吻合。
温度越低,煤自燃的危险性越高,临界温度的确定对于煤自燃预警工作具有重要意义;180 ℃与实验测得的交叉点温度179.8 ℃相吻合,此后煤氧化反应进入自热阶段,活化能显著降低,该阶段反应剧烈,各指标气体产生速率均增大,并且C2H4也在该阶段内开始产生,加速达到着火点。
3 结论
(1)在同步热分析过程中,30~900 ℃内,煤样的质量变化可以分为4个阶段,465 ℃发生着火,690 ℃燃尽,最终质量仅存13%,与其灰分的含量大致吻合。综合分析煤样的DTG曲线和DSC曲线,发现整个过程中,煤温为515 ℃时质量衰减最快,511 ℃时热释放速率最快,两个温度基本契合,此时燃烧速率最大,该结论主要运用于煤在高温段的燃烧机理。
(2)肥煤自燃过程中产生大量含碳类气体,其中CO,CO2生成量随温度升高整体呈上升趋势,在130 ℃均大幅度增加。CH4和C2H6释放规律相似,在30~410 ℃时出现两个突增点:130 ℃和350 ℃,尤其在350 ℃出现近似指数增长;C2H4在130 ℃开始出现,之后生成量变化不大,直至350 ℃开始以指数形式增长。质量极大值温度342 ℃是煤与氧气结合使煤样质量达到最大值的温度,之后煤样进入较快的失重阶段,与各指标气体大量生成的温度350 ℃大致吻合。
(3)在氧化过程中,C2H6/CH4比值规律性不明显,对研究肥煤自燃规律参考意义不大;C2H4/C2H6比值在190~360℃规律性较强,呈现明显的上升趋势,在360℃达到最大值0.32;C2H4/CO与C2H4/CO2变化规律趋于一致,350℃之前平稳增长,350℃之后呈指数增长,主要由于该阶段煤氧反应剧烈,C2H4含量大增,该节点反映在TG-DTG曲线上即为质量极大值温度T5(342℃)之后煤样质量急剧下降。综上,C2H4/C2H6,C2H4/CO和C2H4/CO2都可以较好地反映肥煤自燃过程的规律性。
(4)在40~330 ℃内,共出现3个肥煤煤样表观活化能的突变点:70,180,220 ℃。其中70 ℃是活化能由低到高的转折点,该温度越低,煤自燃发火的危险性越高,因此其值的确定对于煤自燃预警工作具有重要意义;180 ℃与实验测得的交叉点温度179.8 ℃相吻合,此后煤氧化进入自热阶段,活化能显著降低,反应剧烈,各指标气体产生速率均增大,同时开始产生C2H4,加速达到着火点。

