鲜榨山茶油食用安全性毒理学评价
陈劲松,谭传波,杨耀学,赖琼玮,周刚平,张 帆,卢芳国,吴苏喜
(1.湖南大三湘茶油股份有限公司,湖南 衡阳 421141; 2.湖南中医药大学 医学院,长沙 410208;3.长沙理工大学 化学与生物工程学院, 长沙 410114)
油茶(OilCamellia),又名茶子树、茶油树、白花茶等,为山茶科(Theaceae)山茶属(Camellia)中常绿大灌木或小乔木。油茶已有2 300多年的栽培历史,集经济、生态和社会效益于一身,是我国特有的优质木本油料树种。油茶与油棕、油橄榄、椰子并列被称为世界四大木本油料植物[1-2]。
山茶油取自油茶籽,富含不饱和脂肪酸,油酸含量高达75%~80%,因其理化性质与“植物油皇后”橄榄油相似而享有“东方橄榄油”的美誉[3-5]。山茶油中含有油酸、亚油酸、亚麻酸、生育酚、植物甾醇和角鲨烯等营养物质,长期食用,具有降低胆固醇、预防心血管疾病的作用[6-8]。最近开发的鲜榨山茶油含有丰富的天然活性物质,其品质媲美特级初榨橄榄油[9-11],而有关鲜榨山茶油的毒理学评价还未见报道。
本研究依据GB 15193—2014《食品安全性毒理学评价程序和方法》对鲜榨山茶油的食用安全性进行毒理学评价,为鲜榨山茶油的开发应用提供安全性指导。
1 材料与方法
1.1 试验材料
1.1.1 试验原料
鲜榨山茶油,采用湖南大三湘茶油股份有限公司鲜榨工艺所得[9];玉米油,压榨一级,市购。
1.1.2 试验动物
SPF级昆明种小鼠、SPF级SD大鼠,均购自湖南斯莱克景达试验动物有限公司,动物生产许可证号为SCXK(湘)2016-0002,动物检疫期为3~5 d。辐照灭菌清洁级大鼠饲料,由北京科澳协力饲料有公司提供,饲料生产许可证号为SCXK(京)2014-0010。
1.1.3 试验试剂
环磷酰胺(CP),由江苏盛迪医药有限公司提供;大鼠肝微粒体酶(S-9),实验室自制;氧化型辅酶Ⅱ;2-氨基芴,批号为252361689,Fluka公司;敌克松,标准号为HG2318-92,上海金桥化工厂;叠氮钠,批号为A0345092,ACROS公司;1,8-二羟基蒽醌,批号为 200808054,上海晶纯试剂有限公司。
生化试剂盒,由四川新健康成生物股份有限公司提供;血液学试剂盒,由深圳迈瑞生物医疗电子股份有限公司提供。
鼠伤寒沙门氏菌组氨酸缺陷型TA97a、TA98、TA100、TA102、TA1535 5株标准突变型菌株,由美国MOLTOX公司提供,经鉴定符合要求。
中国仓鼠肺(CHL)细胞株,购自中国科学院细胞库。
1.1.4 仪器与设备
JA3003型电子分析天平,奥林巴斯生物显微镜,BECKMAN COULTER全自动生化分析仪,BC-5300Vet兽用全自动血液细胞分析仪,超净工作台等。
1.2 试验方法
1.2.1 急性经口毒性试验
采用SD大鼠20只,雌、雄各半,设10 000 mg/kg 1个剂量组,动物隔夜禁食但不禁水。取适量的鲜榨山茶油,用玉米油配制成质量浓度为666.7 mg/mL的混悬液,按1.5 mL/100 g(以大鼠体重计)一次性经口灌胃。观察动物染毒后14 d内的中毒症状及死亡情况。
1.2.2 遗传毒性试验
1.2.2.1 Ames试验
采用经鉴定符合要求的鼠伤寒沙门氏菌组氨酸缺陷型TA97a、TA98、TA100、TA102、TA1535 5株标准突变型菌株进行试验,并以多氯联苯(PCB)诱导的大鼠肝微粒体酶(S-9)作为体外代谢活化系统。根据预试验结果,试验设312.5、625.0、1 250.0、2 500.0、5 000.0 μg/皿 5个剂量,同时设自发回变、溶剂(玉米油)对照组(100 μL/皿)和阳性突变剂对照组(100 μL/皿)。首先配制受试液:准确称取0.5 g受检样品,加玉米油定容至10 mL混匀即为最高剂量所用受试液,质量浓度为50 mg/mL,以该质量浓度受试液为基础,用玉米油 2倍依次往下稀释,即得2 500.0、1 250.0、625.0、312.5 μg/皿剂量组所用受试液,质量浓度分别为25、12.5、6.25、3.125 mg/mL,经0.103 MPa灭菌20 min,静置至室温备用。试验采用平板掺入法,在加与不加S-9的条件下进行测试。试验时取各受试液0.1 mL加入平皿,每个剂量3个平皿,37℃培养48 h后,计数每皿回复突变菌落数。
1.2.2.2 小鼠骨髓细胞微核试验
采用昆明种小鼠50只,体重26.0~30.0 g,雌、雄各半,试验设2.5、5.0、10 g/kg(以小鼠体重计,下同)3个剂量组,另设溶剂(玉米油)对照组(20 mL/kg)及阳性(环磷酰胺)对照组(40 mg/kg)。取16.0 mL受检样品加玉米油至30 mL混匀即得质量浓度为0.5 g/mL受试液,供10 g/kg剂量组动物使用,然后分别取该受试液4.0、8.0 mL加玉米油至16 mL,即得0.125、0.25 g/mL受试液供2.5、5.0 g/kg 剂量组动物使用;取环磷酰胺200 mg加注射用氯化钠溶液10 mL配得母液,取该母液按1∶9的比例用注射用氯化钠溶液稀释成质量浓度为2 mg/mL的环磷酰胺溶液,供阳性对照组动物使用。灌胃量为20 mL/kg,试验采用30 h两次灌胃法,间隔24 h,于末次给样后6 h颈椎脱臼处死动物,取胸骨骨髓按GB 15193—2014《食品安全性毒理学评价程序和方法》中骨髓细胞微核试验的规定进行制片,固定,Giemsa染色后,在油镜下每只小鼠计数2 000个嗜多染红细胞(PCE)中含微核细胞数,计算微核率。计数200个嗜多染红细胞,计算嗜多染红细胞与成熟红细胞比值(PCE/NCE)。
1.2.2.3 体外哺乳类细胞染色体畸变试验
选用中国仓鼠肺(CHL)细胞株进行试验。预试验结果显示,在加与不加S-9的条件下,5 000 μg/皿剂量组均不影响细胞相对生长率,故正式试验设1 250、2 500、5 000 μg/mL 3个剂量组,另设溶剂(DMSO)对照组及阳性(不加S-9:甲磺酸甲酯(MMS),10 μg/mL。加S-9:环磷酰胺,10 μg/mL)对照组。准确称取5 g受检样品,加DMSO定容至10 mL混匀即得质量浓度为0.5 g/mL受试液,供5 000 μg/mL剂量组使用,然后分别取该受试液5、2.5 mL加DMSO至10 mL,即得0.25、0.125 g/mL受试液,供2 500、1 250 μg/mL剂量组使用;分别取甲磺酸甲酯10 mg和环磷酰胺10 mg加无菌蒸馏水定容至10 mL,配得质量浓度均为0.001 g/mL溶液供阳性对照组使用。调整细胞密度至5×105个/mL,每瓶5 mL,置37℃、5%CO2培养箱内培养24 h后吸去培养瓶中的培养液,加入相应质量浓度的受试物50 μL,4 mL不含血清的培养液和1 mL S-9(不加S-9时,用培养液补足),37℃培养4 h。吸去含受试物的培养液,换入新鲜含胎牛血清的培养液5 mL,继续于37℃培养24 h。培养结束前4 h向培养瓶中加入秋水仙素(终质量浓度为1 μg/mL)。秋水仙素作用4 h后,用0.25%胰蛋白酶液消化,离心并收获细胞,常规制片。Giemsa染色后,在高倍镜下每组镜检100个中期分裂相细胞,观察记录畸变细胞数和畸变类型等,计算染色体畸变率。
1.2.3 大鼠28 d经口毒性试验
选用断乳SD大鼠100只,雌、雄各半,雌鼠体重为75~ 92 g,雄鼠体重为79~91.5 g。因溶媒为玉米油,最大灌胃量为4 mL/kg,故高剂量组的剂量为3.752 g/kg。试验设0.938、1.876、3.752 g/(kg·d)(分别相当于人拟用剂量的5.2、10.5、21倍)3个受试物剂量组,1个对照组,每组20只大鼠,雌、雄各半。另设对照组和高剂量卫星组,每组10只大鼠,雌、雄各半,做恢复期观察。试验采用灌胃法,灌胃量为4 mL/(kg·d)。受试液每天新鲜配制,根据设计剂量,第1周每天分别取5.0、10.0、20.0 mL受检样品加玉米油至20 mL混匀即得质量浓度分别为234.5、469.0、938.0 mg/mL受试液,供0.938、1.876、3.752 g/(kg·d)剂量组动物使用;随后每周根据动物体重增长情况配制相应体积的受试液,配制方法及受试液质量浓度同第1周。溶剂对照组给予等体积的玉米油。每天定时灌胃1次,连续灌胃28 d。卫星组动物于染毒停止后继续观察14 d。试验动物单笼喂养,自由饮水、进食。每天观察动物的一般表现、行为、中毒症状及死亡情况。每周末称1次体重及食物摄入量(第1~4周每周称2次体重)。染毒结束后,各剂量组和对照组动物隔夜禁食约16 h,经腹主动脉采血检测血清天冬氨酸氨基转换酶(AST)、血清丙氨酸氨基转换酶(ALT)、碱性磷酸酶(ALP)、尿素(Urea)、肌酐(Cre)、总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、总胆固醇(TC)、甘油三酯(TG)、谷氨酰转酞酶(GGT)、钾、钠、氯等血液生化指标。试验结束时将动物处死,解剖动物观察内脏改变,称心、胸腺、肝、脾、肾、肾上腺、睾丸质量并计算其脏体比。
1.2.4 数据处理
小鼠骨髓细胞微核试验用泊松分布和卡方检验进行统计学处理,大鼠28 d经口毒性试验采用IBM SPSS Statistics 20统计软件对各项检测数据作单因素方差分析,秩和检验或t检验对各项检测数据进行统计分析。显著性水平α=0.05。
2 结果与分析
2.1 急性经口毒性试验
鲜榨山茶油大鼠急性经口毒性试验结果表明,动物染毒后活动如常,未出现明显中毒症状,观察期内未发生死亡。7 d和14 d称重动物体重均有增长。雌、雄大鼠急性经口LD50均大于10 000 mg/kg,按照剂量分级评定鲜榨山茶油雌、雄大鼠急性经口毒性级别均属实际无毒级。
2.2 遗传毒性试验
2.2.1 Ames试验
鲜榨山茶油细菌回复突变试验结果见表1。
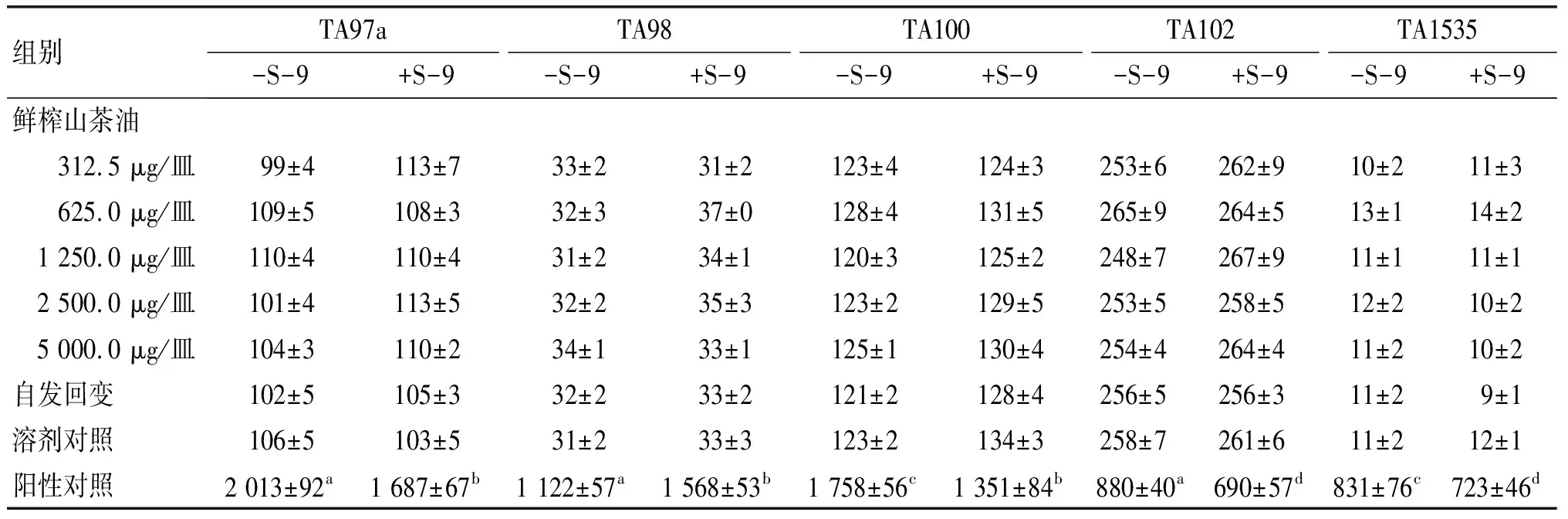
表1 鲜榨山茶油细菌回复突变试验结果
注:a为敌克松,50 μg/皿;b为2-氨基芴,10 μg/皿;c为叠氮钠,1.5 μg/皿;d为1,8-二羟基蒽醌,50 μg/皿。
由表1可见,受检样品各剂量组对各试验菌株在加与不加S-9代谢活化系统条件下,回复突变菌落数均未超过自发回变的2倍,亦无剂量反应关系,而阳性对照组的平均回复突变菌落数均超过对照组2倍,呈现明显阳性反应,上述结果表明该受试样品未诱导5种菌株回复突变菌落数增加。因上述试验结果为阴性,故整套Ames试验重复1次,重复试验设8、40、200、1 000、5 000 μg/皿5个剂量,其他试验条件保持不变。重复试验亦未见受试样品诱导5种菌株回复突变菌落数增加。
2.2.2 小鼠骨髓细胞微核试验
鲜榨山茶油对小鼠骨髓嗜多染红细胞微核率的影响见表2。
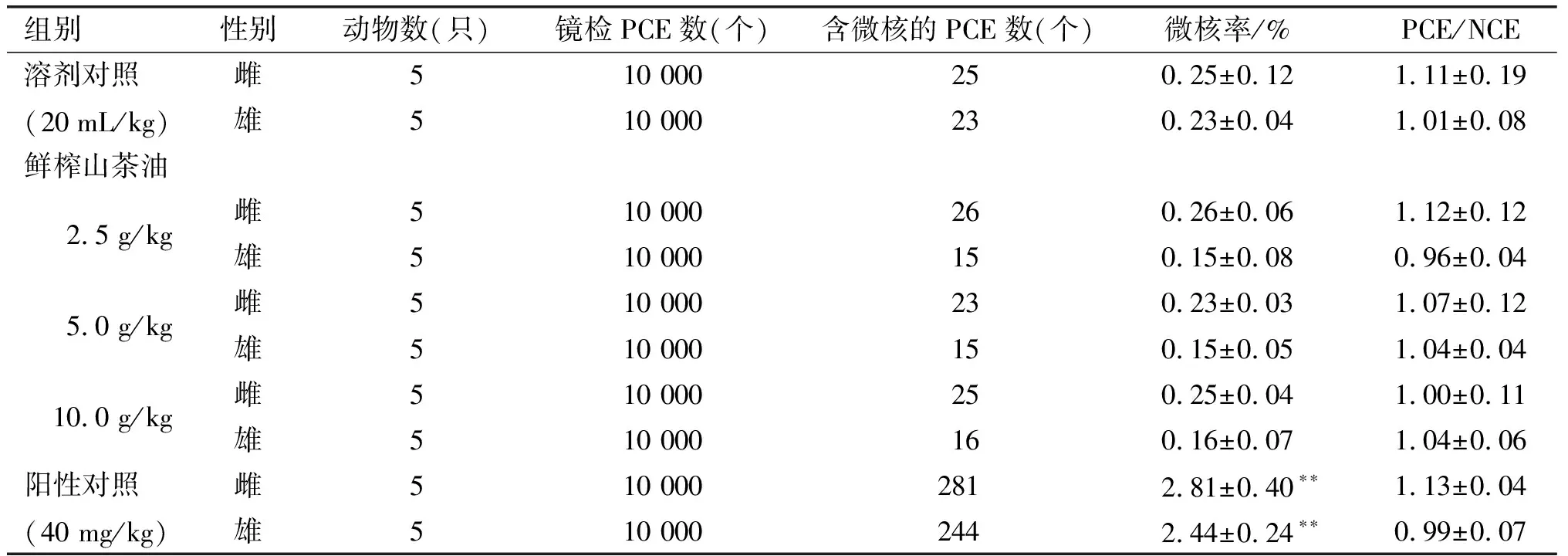
表2 鲜榨山茶油对小鼠骨髓嗜多染红细胞微核率的影响
注: **表示与溶剂对照组比较,差异有统计学意义,P<0.01。下同。
由表2可见,各剂量组PCE/NCE比值正常,未见受检样品对昆明种雌、雄小鼠骨髓细胞增殖有抑制作用。溶剂对照组昆明种雌、雄小鼠骨髓PCE微核率分别为0.25%和0.23%。各剂量组昆明种雌、雄小鼠骨髓PCE微核率分别为0.23%~0.26%和0.15%~0.16%,与溶剂对照组比较,差异无统计学意义(P>0.05)。阳性对照组昆明种雌、雄小鼠骨髓PCE微核率分别为2.81%和2.44%,与溶剂对照组比较,差异有统计学意义(P<0.01)。上述结果表明未见受试样品诱发小鼠骨髓嗜多染红细胞微核率增高。
2.2.3 体外哺乳类细胞染色体畸变试验
鲜榨山茶油对CHL细胞染色体畸变率的影响(4 h)见表3。
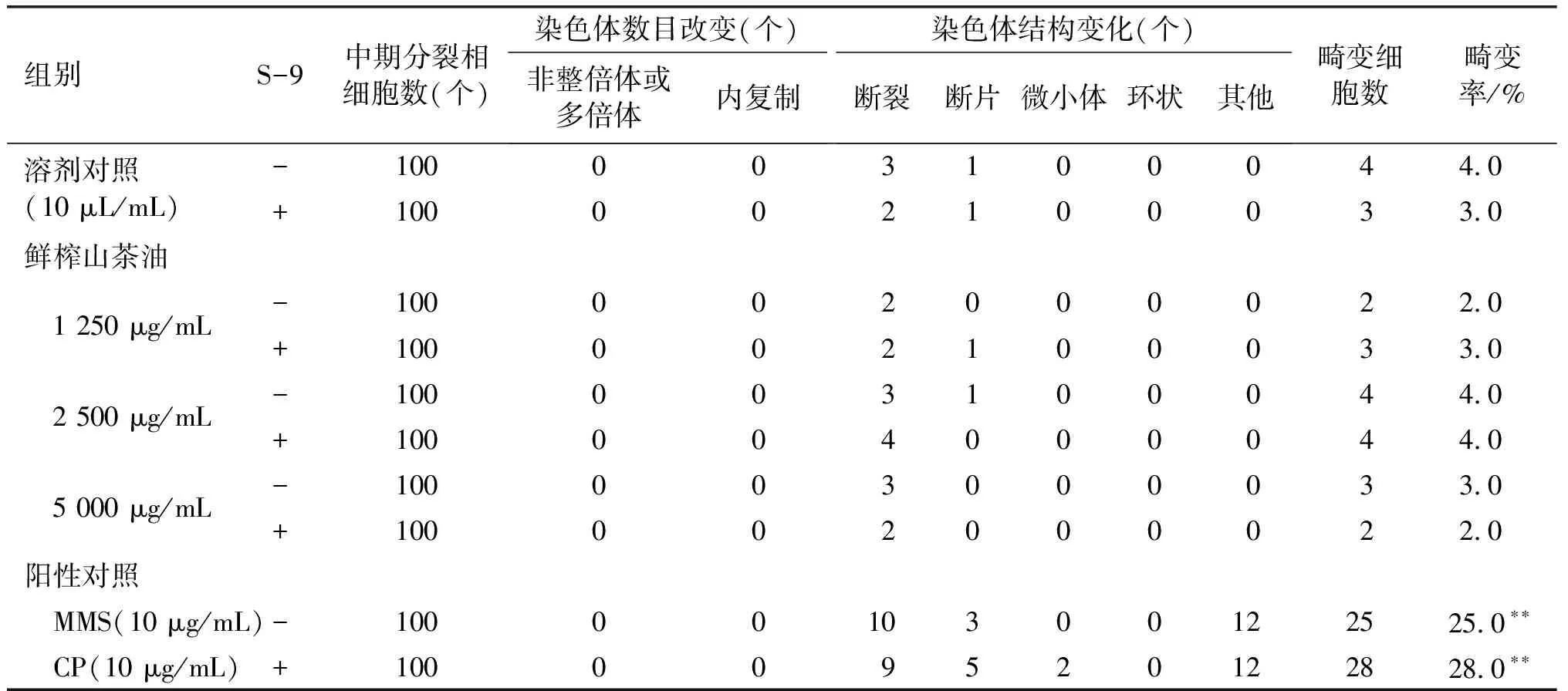
表3 鲜榨山茶油对CHL细胞染色体畸变率的影响(4 h)
由表3可见:在不加S-9与加S-9的条件下接触受试物4 h,溶剂对照组CHL细胞染色体畸变率分别为4.0%和3.0%;鲜榨山茶油各剂量组CHL细胞染色体畸变率分别为2.0%、4.0%、3.0%和3.0%、4.0%、2.0%,与相应的溶剂对照组比较,差异均无统计学意义(P>0.05)。阳性对照组(MMS和CP)CHL细胞染色体畸变率分别为25.0%和28.0%,与相应的溶剂对照组比较,差异有统计学意义(P<0.01)。因上述试验结果为阴性,故另设不加S-9的试验,将受试物接触时间延长至24 h,重复体外哺乳类细胞染色体畸变试验1次。鲜榨山茶油对CHL细胞染色体畸变率的影响(24 h)见表4。由表4可见:在不加S-9条件下,受试物染毒时间延长至24 h,溶剂对照组CHL细胞染色体畸变率为3.0%;鲜榨山茶油各剂量组CHL细胞染色体畸变率分别为2.0%、3.0%、4.0%,与相应的溶剂对照组比较,差异均无统计学意义(P>0.05)。阳性对照组(MMS)CHL细胞染色体畸变率为31.0%,与相应的溶剂对照组比较,差异有统计学意义(P<0.01)。在本试验条件下,鲜榨山茶油未引起CHL细胞染色体畸变率增高。

表4 鲜榨山茶油对CHL细胞染色体畸变率的影响(24 h)
2.3 大鼠28 d经口毒性试验
试验发现各剂量组雌、雄大鼠在整个试验期间的活动、进食、饮水基本正常,粪便性状正常,亦未见明显行为改变和中毒表现。鲜榨山茶油28 d经口毒性试验各组SD大鼠体重及总增重见表5。
表5 鲜榨山茶油28 d经口毒性试验各组SD大鼠体重及总增重
由表5可见,各剂量组雌、雄大鼠试验期间各周体重、总增重与对照组比较,差异均无统计学意义(P>0.05)。
鲜榨山茶油28 d经口毒性试验末期各组SD大鼠血液生化指标测定结果见表6。
由表6可见:试验末期高剂量组雌性大鼠尿素(Urea)、甘油三酯(TG)和中剂量组雌性大鼠血糖(GLU)、尿素(Urea)均高于对照组,差异有统计学意义(P<0.05或P<0.01);试验末期高剂量组雄性大鼠血糖(GLU)、氯(Cl)均高于对照组,差异有统计学意义(P<0.05或P<0.01);以上几个指标值均在本实验室正常范围内,没有生物学意义;各剂量组雌、雄大鼠其他各项血液生化学指标与对照组比较,差异无统计学意义(P>0.05)。
鲜榨山茶油28 d经口毒性试验各组SD大鼠脏器质量与脏体比测定结果见表7。
由表7可见,各剂量组雌、雄大鼠各项脏器质量、脏体比及禁食后体重与对照组比较,差异无统计学意义(P>0.05)。试验中未见器官组织形态的异常变化。恢复期观察表明高剂量卫星组亦未见动物健康状况、血液生化指标和器官组织形态的异常变化。

表6 鲜榨山茶油28 d经口毒性试验末期各组SD大鼠血液生化指标测定结果
注:与对照组比较*P<0.05,**P<0.01差异有统计学意义。
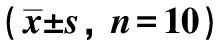
表7 鲜榨山茶油28 d经口毒性试验各组SD大鼠脏器质量与脏体比测定结果
3 结 论
通过小鼠急性毒性试验、遗传毒性试验和亚急性毒性试验对鲜榨山茶油进行毒理学研究, 并对其做安全性评价。鲜榨山茶油对大鼠的急性经口LD50大于10 000 mg/kg,判属实际无毒级;遗传毒性试验(Ames试验、小鼠骨髓细胞微核试验和体外哺乳类细胞染色体畸变试验)结果均为阴性;在大鼠 28 d喂养试验中未见动物健康状况和器官组织形态的异常变化,大鼠体重、TP、ALB、AST、ALT、GGT、ALP、Cre、TC、Na、K、脏器质量、脏体比与对照组相比均无显著差异,Urea、TG、GLU、Cl均在实验室正常范围内。恢复期观察表明高剂量卫星组亦未见动物健康状况、血液生化指标和器官组织形态的异常变化。鲜榨山茶油无急性毒性、遗传毒性和亚急性毒性,具有较高的食用安全性。

