空心菜对水中3种除草剂的去除作用
黄晓丽,黄丽,高磊,陈中祥,王鹏,覃东立,2,*
1. 中国水产科学研究院黑龙江水产研究所,哈尔滨 150070 2. 农业农村部水产品质量安全控制重点实验室,北京 100141
除草剂(herbicide)是一类用于选择性地消灭或抑制植物生长的农药。目前农业生产中常用的除草剂具有毒性低和半衰期短的特点,但由于其使用量大且使用频率高,导致了其在环境中的“持续性”存在。除草剂类污染物已成为全球最普遍的有机污染物之一,主要来自于农田退水、地表径流和生产除草剂的工厂废水排放等。不同区域的土壤/沉积物、地表水和地下水中均检测到了这类污染物的存在[1-3],而此类污染物导致的环境问题是当前国际上环境污染防治的焦点。三嗪类(阿特拉津、扑草净等)、酰胺类(乙草胺、丙草胺等)和取代杂环类(恶草酮等)农药是我国用量较大的除草剂。我国东辽河流域旱田区地表水体中阿特拉津的浓度为9.71 μg·L-1,非旱田区地表水体中的浓度为8.85 μg·L-1[4];东北地区水源水中乙草胺的最大浓度为1 054.90 ng·L-1[5];我国重点流域地表水2013—2014年间检测到的乙草胺最大残留浓度为579.90 ng·L-1,恶草酮最大残留浓度为32.60 ng·L-1[6],某地淡水养殖池塘表层水体中阿特拉津、丙草胺、丁草胺和乙草胺的检出率为100%,最大残留量为1 671.30 ng·L-1[7]。除草剂类污染物对水生生态环境中的鱼类、浮游生物及水生植物等具有一定毒性,例如,高浓度酰胺类除草剂会抑制铜绿微囊藻的生长,且该影响存在明显的滞后效应和剂量-效应关系[8];10%恶唑酰草胺乳油和13%恶草酮乳油对斑马鱼和羊角月牙藻的毒性分别为中毒和高毒[9];阿特拉津胁迫60 d对菹草和穗花狐尾藻的生长均具有显著抑制作用[10]。总体而言,上述除草剂在我国地表水环境中普遍存在并具有潜在生态风险。
水体中的有机污染物可通过水生植物转移或吸收固定、根系微生物作用等方式被去除。湿地植物或水生植物的吸附和吸收作用在缓解和消除农药面源污染的过程中发挥着重要的作用[11]。湿地植物的存在能够吸附甲基对硫磷[12]和毒死蜱[13],限制其从水相转移至固相中。国内外学者对水生植物去除农药的能力进行了相关的研究,证实凤眼莲可提高水溶液中甲基对硫磷、乙硫磷、三氯杀螨醇和三氟氯氰菊酯的降解速度[14-15];水葱、香蒲和石菖蒲均能显著促进水溶液中乐果的降解,去除能力为水葱>香蒲>石菖蒲[16];水生鸢尾、水葱和菖蒲水培系统中毒死蜱的去除率显著高于无植物对照[17];虉草[18]、香蒲[19]和芦苇[20]等水生植物均被证明可以吸附和吸收农药;菹草和穗花狐尾藻体内的谷胱甘肽对阿特拉津及其产生的活性氧具有一定去除作用,并通过合成共轭物来缓解阿特拉津对沉水植物的毒害[10]。
蕹菜,俗称空心菜,其耐受性强、生长迅速、根系发达,对土壤或水体中氮、磷、重金属和有机物等污染物去除效果显著[21-22],已被广泛应用于污染土壤或水体的修复。本研究结合实际情况,以目前国内普遍使用的丙草胺、丁草胺和恶草酮3种除草剂为研究对象,采用静态水培法,考察了3种除草剂水溶液中空心菜的生长状况,监测了空心菜-水体系中3种除草剂浓度的梯度变化。在此基础上,研究了空心菜促进除草剂去除的动力学过程,旨在为有机污染水体修复提供参考数据及科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
实验植物为大叶白梗空心菜,空心菜种子在无污染物的温室条件下土培培养4周以上。选取长势一致、生长良好的土培植株(径高15.62 cm±3.43 cm),用去离子水洗净根部,然后移入无污染的霍格兰氏营养液中预培养7 d,待长出新根后开始实验[23]。
7890A-5975C气相色谱-质谱联用仪(安捷伦科技有限公司,美国);N-EVAPTM 112氮吹仪(Organomation Associate公司,美国);PB 602-N电子天平(梅特勒-托利多仪器(上海)有限公司,中国);KQ 700E超声波清洗器(昆山市超声仪器有限公司,中国);Syncore多样品定量浓缩/平行蒸发仪(瑞士步琦有限公司,瑞士)。XEVO TQ-S超高效液相色谱-串联三重四级杆质谱仪(沃特世科技有限公司,美国),配有ESI离子源;Infinity 5010氮气发生器(毕克气体仪器贸易有限公司,英国);ASE350加速溶剂萃取仪(赛默飞世尔科技有限公司,美国);Milli-Q超纯水机(密理博有限公司,美国)。丙草胺和丁草胺标准品均购自国家标准物质研究中心;恶草酮标准品溶液浓度为100 μg·mL-1,购自农业农村部环境保护科研监测所。二氯甲烷、乙腈、正己烷、环己烷、乙酸乙酯和甲醇均为质谱纯,购自上海安谱实验科技股份有限公司;无水硫酸钠(650 ℃烘烤2 h)和霍格兰氏营养液配制所用的试剂均为分析纯,购自国药化学试剂有限公司。
1.2 实验设计
根据除草剂在田间施用浓度,农药浓度设置50、100、250、500和1 000 μg·L-1。在烧杯中加入2.0 L含不同浓度农药的霍格兰氏营养液,移入经过预培养长势一致的水培空心菜植株,在室内临窗自然光条件下培养。为了避免微生物对实验结果的影响,培养液中加入10 mg·L-1氨苄青霉素。每个浓度设置不加植物只加农药的空白对照,考察水溶液中受试农药的自然降解情况,对比分析植物对水溶液中受试农药的去除情况;设置不加农药只加植物的对照组,以对比植物在有无农药条件下的生长状况,每个处理组设3个平行。调节各实验组营养液初始pH为6.8±0.3。每24 h向各处理组添加配制好的营养液并混合均匀,保持培养液体积不变。实验过程中,分别在培养0、1、2、3、5、7、10和16 d采集水体样品,测定水体中农药残留浓度,比较空心菜对不同农药的去除效果并进行动力学分析。在培养第17天取出植物,测定空心菜不同组织部位中3种农药的残余量。
1.3 水溶液中除草剂残留分析
取5 mL采集的水样,过膜,稀释,使用PEP小柱富集。PEP小柱依次用5 mL甲醇和超纯水活化。富集好的小柱使用10 mL丙酮和5 mL二氯甲烷洗脱,洗脱液经无水硫酸钠脱水后氮吹,正己烷定容至1 mL,过0.22 μm滤膜,利用气相色谱-质谱联用仪对溶液中的乙草胺和丙草胺定量分析[24]。取1 mL采集的水样,稀释后滤纸过滤,使用HLB固相萃取小柱富集。HLB固相萃取小柱依次用2 mL甲醇和超纯水活化。富集好的小柱使用1.0 mL的体积分数为3%的甲醇水溶液和1.0 mL乙腈洗脱,氮吹,定容至1 mL,过0.22 μm滤膜,利用液相色谱串联质谱分析恶草酮的浓度[25]。
1.4 空心菜体内除草剂残留分析
称取剪碎的空心菜样品5 g(精确至0.001 g),与5 mL超纯水、2 g NaCl和10 mL乙腈混匀,旋涡2 min后超声萃取2 h,再加入10 mL二氯甲烷,旋涡2 min后离心收集上清液。使用弗罗里硅土固相柱富集,10 mL二氯甲烷和正己烷混合液(V∶V=1∶9)洗脱,洗脱液经旋转蒸发至约0.5 mL,加正己烷定容至1 mL,过0.22 μm滤膜,用气相色谱-质谱联用仪定量分析乙草胺和丙草胺的浓度。准确称取剪碎的空心菜样品5 g(精确至0.001 g),加20 mL环己烷和乙酸乙酯混合液(V∶V=1∶2),涡旋2 min后超声萃取10 min。采用C18固相萃取柱对样品进行净化处理,流动相定容,利用液相色谱串联质谱分析恶草酮的浓度。
1.5 质量控制
为保证监测数据的可靠性和真实性,从玻璃仪器的清洗、采样介质前处理到样品的采集、保存和萃取等全过程都严格按照美国环境保护局(US EPA)的质量保证和质量控制(QA/QC)要求进行操作和监控。检测过程中加入平行样品和溶剂空白样品,进行加标回收率检测。经检验,溶剂空白样品中目标化合物浓度绝大多数低于检测限;水体中农药的平均回收率为72%~114%,相对标准偏差(RSD)为4.0%~13.5%;植物中农药的平均回收率为70%~119%,RSD为1.5%~14.6%。方法对水体中农药的检出限:丙草胺2 ng·L-1,丁草胺2 ng·L-1,恶草酮0.15 ng·L-1。植物中农药的检出限:恶草酮、丙草胺和丁草胺均为0.5 μg·kg-1。
1.6 数据统计与分析
采用相对生长速率(RGR)(d-1)来衡量空心菜经不同浓度农药培养前后的生长状况[26]。
RGR=(lnW2-lnW1)/t
式中:W1和W2分别为第1次和第2次测定时的植物干重(g),t为2次测定间隔的时间。
数据采用平均值±标准差表示,运用SPSS 20.0中的单因素方差分析(One way ANOVA)对不同浓度除草剂对空心菜生物量变化及其吸收累积差异性进行统计分析。
2 结果(Results)
2.1 空心菜在3种除草剂溶液中的生长情况
水培条件下,在不同浓度的丙草胺和丁草胺溶液中空心菜均能正常生长,在16 d的培养中长势良好,生长旺盛(表1),单株植物的平均茎叶生物量和总生物量均在50 μg·L-1水溶液中达到最高值。其中,平均茎叶生物量分别为1.73 g和2.23 g,平均总生物量分别为2.34 g和2.96 g。不同浓度的丙草胺和丁草胺溶液培养下,空心菜的平均茎叶生物量、根生物量和总生物量均具有显著性差异(P<0.05)。在50~100 μg·L-1丙草胺溶液中培养下,空心菜3种生物量均高于对照组,但不具有显著性差异(P>0.05);较高浓度(250~1 000 μg·L-1)丙草胺溶液抑制了空心菜的生长,平均根生物量和总生物量均显著低于对照组(P<0.05)。低浓度(50~100 μg·L-1)丁草胺溶液促进了空心菜的生长,3种生物量均显著高于对照组(P<0.05);高浓度(500~1 000 μg·L-1)丁草胺溶液抑制了空心菜的生长,3种生物量均低于对照组,其中根生物量与对照组具有显著性差异(P<0.05)。
在50 μg·L-1恶草酮水溶液中,单株植物的平均茎叶生物量和总生物量达到最大值,分别为1.74 g和1.89 g。较高浓度恶草酮溶液(≥250 μg·L-1)培养下,空心菜在实验初期就出现枯黄现象,并逐渐枯萎死亡;在较低浓度(≤100 μg·L-1)的恶草酮溶液中,空心菜初期能够正常生长,但实验末期出现枯黄现象,部分死亡。在不同浓度(50 μg·L-1和100 μg·L-1)恶草酮溶液培养下,空心菜的平均茎叶生物量、根生物量和总生物量均具有显著性差异(P<0.05)。低浓度(50~100 μg·L-1)恶草酮溶液即可抑制空心菜的生长,根生物量和总生物量均显著低于对照组(P<0.05)。相同除草剂浓度下,空心菜的总生物量由大到小的顺序为丁草胺>丙草胺>恶草酮。
相同浓度条件下,空心菜的RGR由大到小的顺序为丁草胺>丙草胺>恶草酮。空心菜在的丙草胺和丁草胺溶液培养中长势较快,在50 μg·L-1浓度下达到最高RGR,分别为0.13 d-1和0.14 d-1。空心菜的RGR随着除草剂浓度的增加而逐渐降低。在50 μg·L-1和100 μg·L-1恶草酮溶液中,空心菜的生长均比在其他2种除草剂溶液中的生长慢,RGR分别为0.11 d-1和0.092 d-1,显著低于同浓度下的丙草胺和丁草胺溶液中的RGR(P<0.05)。

表1 不同除草剂对空心菜生长的影响Table 1 Effect of different herbicides on the growth of water spinach
在16 d的培养中,不同除草剂及不同浓度培养条件下,空心菜的根系生长情况不同。在所有浓度的丙草胺和丁草胺溶液中,空心菜根系生长旺盛,较发达,产生了大量不定根。在较低浓度(≤100 μg·L-1)恶草酮溶液中,空心菜的根系也有所生长,但有部分根出现腐烂死亡,这可能与其恶草酮对空心菜的毒性有关。总体上,空心菜的根能够在丙草胺、丁草胺和低浓度恶草酮溶液中生长,单株根系的平均生物量在50 μg·L-1浓度下达到最大值,分别为0.51、0.62和0.24 g。在相同除草剂浓度下,根生物量由大到小的顺序为丁草胺>丙草胺>恶草酮,且差异达到显著水平(P<0.05)。
2.2 空心菜对水溶液中3种农药去除效果的比较
经过16 d的培养(图1(a)),空心菜对丙草胺、丁草胺和恶草酮的平均去除率分别为87.37%、97.09%和33.47%,显著高于无植物对照组(P<0.05),丙草胺、丁草胺和恶草酮的光解和水解贡献率分别为22.19%、26.60%和22.97%(图1(a))。随着水溶液中丙草胺和丁草胺浓度的增加,两者去除率逐渐降低(图1(a)~图1(d))。在500 μg·L-1浓度下,空心菜对丙草胺的去除率显著降低(P<0.05),当溶液浓度达到1 000 μg·L-1时,去除率仅为65.15%。丁草胺的去除率在1 000 μg·L-1浓度下为86.52%,与50~500 μg·L-1培养浓度下的去除率相比显著降低(P<0.05)。空心菜对3种除草剂的去除效果由大到小依次为:丁草胺>丙草胺>恶草酮。结合植物生长情况分析,空心菜去除这3种除草剂的能力与植物的生长状况密切相关。在相同除草剂浓度条件下,丁草胺溶液中的空心菜生长状况最好,相应的除草剂去除效率最高。
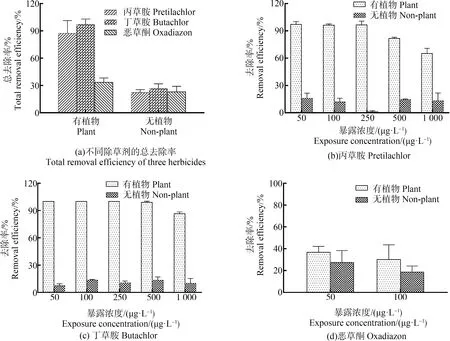
图1 空心菜对3种除草剂的去除率Fig. 1 Removal efficiency of three herbicide cultivated with water spinach
2.3 水溶液中3种除草剂的去除动力学过程
水溶液中3种除草剂浓度下降过程如图2所示。在不同起始浓度条件下,水溶液中的丙草胺和丁草胺在前72 h去除速率较快。空心菜对3种除草剂的去除效率由大到小的顺序为丁草胺>丙草胺>恶草酮。在实验浓度范围内,一级动力学反应方程ct=c0e-kt能够较好地模拟丙草胺和丁草胺在水溶液中的去除过程,拟合参数如表2所示。水溶液中恶草酮的去除速率较慢,浓度起伏变化较大,无明显趋势,其去除过程拟合结果不符合一级动力学反应方程。起始浓度对水溶液中3种除草剂的去除有一定的影响,反应速率常数呈先上升后下降的趋势。当低于某浓度时(丙草胺≤250 μg·L-1,丁草胺≤100 μg·L-1),反应速率常数逐渐上升,当超过一定浓度时(≥500 μg·L-1)则相反。起始浓度为250 μg·L-1时,丙草胺反应速率常数达到最大值0.0357;起始浓度为1 000 μg·L-1时,丙草胺反应速率常数达到最小值0.0032。丁草胺反应速率常数在100 μg·L-1起始浓度下达到最大值0.148,1 000 μg·L-1时达到最小值0.0302。

图2 培养空心菜的水溶液中丙草胺和丁草胺浓度变化图Fig. 2 The concentrations of pretilachlor and butachlor in water cultivate with water spinach
2.4 空心菜对3种农药的吸收与累积
在不同浓度除草剂溶液培养下,空心菜的根、茎和叶中除草剂残留情况如图3所示。3种除草剂在空心菜中残留浓度由大到小的顺序为丙草胺>丁草胺>恶草酮。丙草胺和丁草胺在空心菜不同组织中残留量均表现出相同的规律,主要集中在根系,茎和叶中较少,按从大到小的顺序为:根>茎>叶。培养16 d后,不同浓度下的丙草胺在空心菜的根、茎和叶中的残留浓度范围分别为9.46~284.80、1.092~24.83和0.64~1.24 μg·kg-1。不同浓度下的丁草胺在空心菜的根、茎和叶中的残留浓度范围分别为0.90~114.00、0.51~6.46和0.097~0.670 μg·kg-1。在实验浓度范围内水溶液中的丙草胺和丁草胺浓度变化对吸收富集量影响较大,处理浓度越高,空心菜根和茎中的残留浓度越大,但叶片中的残留浓度变化不大,且根系中残留浓度显著大于茎和叶(P<0.05)。恶草酮在空心菜的根、茎和叶中的残留浓度也表现为根>茎>叶,残留浓度范围分别为4.92~3.60、3.56~3.79和1.05~2.48 μg·kg-1,根与叶中的残留浓度差异显著(P<0.05),且随处理浓度增加而无明显变化。
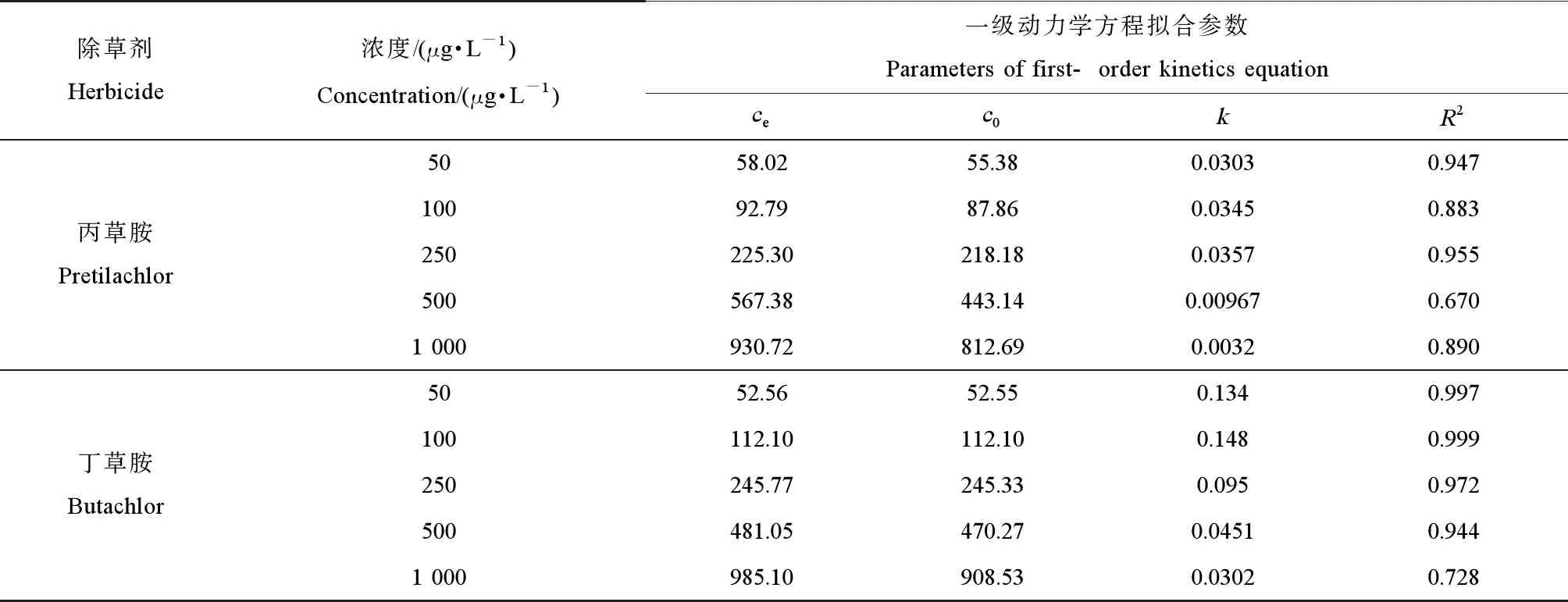
表2 不同处理下2种除草剂去除曲线一级动力学方程拟合参数Table 2 Parameters of removal kinetics of two herbicides in different treatments

图3 空心菜中3种除草剂的残留浓度Fig. 3 Residual concentration of three herbicides in water spinach
3 讨论(Discussion)
不同种植物对除草剂的敏感性差异较大[27]。丙草胺和丁草胺为内吸传导性氯代酰胺类除草剂,此类除草剂的选择性较高,对稗草等禾本科杂草有特效,对水稻等其他作物安全[28]。在本研究实验浓度下,虽然与水稻等生长特性存在一定差异,但空心菜在不同实验浓度的丙草胺和丁草胺溶液中生长状态良好,根系发达,成活率为100%。恶草酮为触杀型有机杂环类除草剂,空心菜对其较为敏感,在较高恶草酮浓度(≥250 μg·L-1)下全部死亡,只能在≤50 μg·L-1条件下正常生长。尽管除草剂对其他植物的作用较小,但由于施用剂量、环境条件等因素的影响,仍会对植物的生长产生负面影响,造成植株矮化、生长缓慢和根系活力降低等[29-31]。在本研究中,低浓度(50~100 μg·L-1)的丙草胺和丁草胺溶液促进了空心菜的生长,但随着丙草胺和丁草胺实验浓度的升高,空心菜茎叶和根的生长量逐渐降低,生长受到抑制。这一结果与丁草胺对湿地芦苇与水稻的影响相似,随着丁草胺处理浓度的增加(360~1 440 μg·L-1),芦苇植株增长量降低[29],丁草胺在6.88 μmol·L-1浓度时引起水稻根生长抑制和总植株干重下降[30]。丁草胺暴露(>5 mg·L-1)会破坏黑麦草幼苗细胞和妨碍细根的生长,进而导致植物发育迟缓[31]。
本研究添加了氨苄青霉素来抑菌,且高浓度农药对微生物的活性有一定的抑制作用[29,32-33],因此,分析时忽略了体系内微生物的作用。考虑到氨苄青霉素并不能抑制所有微生物的生长,本研究中微生物仍会起到一定作用。其他水生植物对除草剂去除的研究结果表明[17],非抑菌条件下微生物对农药的降解贡献率相对较小,植物仍起主导作用。本实验中空心菜处理组的除草剂去除效率显著高于无植物对照组,表明空心菜的吸附、吸收、代谢与富集作用的确可以加速水溶液中3种除草剂的去除,缩短其在水溶液中的半衰期。已有研究表明,植物生长能够增强丁草胺在小麦根围区域的降解[34];芦苇、茭白和菖蒲被证实可用于丁草胺降解,且菖蒲的降解效率最高[27]。
与恶草酮相比,空心菜对丙草胺和丁草胺的敏感性较低,具有一定耐药性,但耐药程度有限,这在空心菜对丙草胺和丁草胺的去除反应速率常数与除草剂浓度关系上体现较为明显。高浓度下(≥1 000 μg·L-1),空心菜的相对生长速率和对除草剂的去除反应速率常数均受到显著影响。水溶液中除草剂的去除主要通过植物的吸收与代谢来实现,根系受损将影响体系内除草剂的去除。研究证实,高浓度丁草胺暴露下,植物细根生长会受到抑制进而影响其生长与发育[31]。除草剂的选择性及植物对不同除草剂的敏感性差异可归因于对除草剂的代谢机制不同。代谢能力较强的植物,除草剂在其体内的半衰期更短,如小麦(wheat)、燕麦(oats)和大麦(barley)能够快速代谢绿磺隆;水稻具有较高的代谢乙氧苯草胺和苯噻酰草胺的能力[35]。丙草胺和丁草胺在空心菜体内代谢可能是导致其茎叶中残留量较低的主要原因。
在同一浓度下,丁草胺溶液中培养的空心菜的根生长量高于丙草胺溶液中培养的,与除草剂的去除效率趋势相同。这表明,植物的吸收、吸附和富集作用与植物的生长状况和根系发达程度有关[23,36]。与溴化1-丁基-3-甲基咪唑离子[37]和重金属[38]等污染物相同,丙草胺、丁草胺和恶草酮在空心菜体内积累的主要器官也是根系,主要是因为在水溶液中,根系直接接触除草剂,根是其进入空心菜体内的首要门户[38]。除草剂由根系向茎、叶传递过程中,含量越来越低,这与化合物在水中和在富含脂质的细胞膜中的溶解性[39]和茎的吸收与转运能力有关[38]。此外,除草剂在空心菜茎叶中的残留量也与植株和茎叶形态等因素有关,相同施药条件下,叶片结构不同可导致水稻植株中的农药残留差异[40]。
综上所示,本研究结果表明:
(1)低浓度(50~100 μg·L-1)丙草胺和丁草胺溶液能够促进空心菜的生长,而高浓度(500~1 000 μg·L-1)培养下,空心菜茎叶和根的生长量逐渐降低。恶草酮对空心菜毒性较大,只能在≤50 μg·L-1条件下正常生长。
(2)空心菜明显提高了水溶液中丙草胺、丁草胺和恶草酮的去除率,分别提高了65.19%、70.49%和10.50%。空心菜对3种除草剂的去除效果由大到小依次为:丁草胺>丙草胺>恶草酮。丙草胺和丁草胺的去除过程符合一级动力学反应方程,其去除反应速率常数受除草剂浓度影响显著。
(3)空心菜-水体系中,植物代谢、吸收与根系吸附在农药去除过程中占主导作用。3种除草剂在空心菜中残留浓度由大到小的顺序为丙草胺>丁草胺>恶草酮,主要积累器官为根系。空心菜在丁草胺溶液中的根生长量高于丙草胺溶液中培养的,与除草剂的去除效率趋势相同,表明植物的吸收、吸附和富集作用与植物的生长状况和根系发达程度有关。

