3种碳纳米材料对斑马鱼生长发育、氧化应激及代谢的影响
孙晶,欧阳少虎,胡献刚,周启星
南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071
近几年,碳纳米材料(carbonaceous nanomaterials, CNMs)因其具有卓越的导电性、光学性质、磁性和反应活性等性质被广泛应用于在医学、物理学、化学、生物和环境保护等研究领域中,尤其是在细胞成像、药物传递、生物传感器和储能等方向上[1-4]。随着CNMs的快速发展与应用,很多与之相关的工业领域都产生了革命性的变化,因而CNMs也被认为是一种未来革命性的材料[2-4]。而氧化石墨烯(graphene oxide, GO)、碳纳米管(carbon tube, CNT)和氧化石墨烯量子点(graphene oxide quantum dot, GOQD)作为CNMs家族重要组成成员,是其中的“佼佼者”且商业价值巨大[5-6]。预计到2027年,仅石墨烯类产品的年生产量有望达到3 800 t,年产值达30亿美元。随着CNMs在消费产品中的生产和使用日益增加,其释放到生态环境且导致人类暴露的风险越来越大,了解其环境归趋和潜在的健康和生态风险已成为人们关注的焦点[7]。
目前,在自然水体、土壤、沉积物和生物体中均已检测出CNMs的存在[7]。生物体很可能会接触释放到环境中的CNMs,了解这些暴露的影响很重要。目前,已经有大量的文献报道了CNMs对藻、鱼、细菌和细胞的纳米毒性效应[8-11]。通常而言,纳米材料的自身性质,如尺寸、分散性、形状、表面电荷和化学成分,会极大影响其生物效应[12]。但是,GO、CNT和GOQD这3种CNMs哪种材料的生态健康风险更低和更安全?对于这个问题还存在着大量的未知,而这对CNMs在未来的设计、生产和应用至关重要。斑马鱼是一种常用的模式生物,也是国际标准化组织(ISO)认可的5种鱼类实验动物之一,已经成为发育生物学、遗传学和毒理学等研究常用的模式生物[13-14]。因此,本研究选取GO、CNT和GOQD作为CNMs代表纳米材料,比较了其对斑马鱼胚胎生长发育毒性的影响。其次,因为目前仍缺乏环境当量浓度下CNMs的毒理数据资料及详细的致毒机理。在本研究中,根据Jia等[8]的工作,选取一个环境痕量浓度(0.01 mg·L-1)对斑马鱼成鱼进行了长达21 d的亚急性毒性测试,并利用代谢组学技术对CNMs亚急性毒性机理进行了阐释,为今后详细阐述CNMs纳米毒性机理提供新思路和技术支撑。
1 材料与方法(Materials and methods)
1.1 CNMs与受试生物
1.1.1 CNMs来源
GO(货号XF002-1)、CNT(货号S07)和GOQD(货号XF042),均购自中国南京先丰纳米材料科技有限公司,其基本产品性质如表1所示,具体形貌如图1所示。
1.1.2 受试生物
6月龄的成年野生型斑马鱼(Daniorerio),购自国家斑马鱼资源中心(China Zebrafish Resource Center, CZRC)。
1.2 CNMs形貌表征
取少量GO和CNT粉末分别分散于40 mL无水乙醇(分析纯,中国天津市康科德技术有限公司)中,冰浴超声30 min,即为GO乙醇分散液和CNT乙醇分散液。取10 μL GOQD悬浮原液至40 mL无水乙醇中,冰浴超声30 min后,即得到GOQD乙醇分散液。为测定材料的形貌,分别取10 μL GO、CNT和GOQD乙醇分散液滴于电镜载网(AZH200,中国北京中镜科仪技术有限公司)上,使用透射电子显微镜(TEM)(HT7700,日本Hitachi公司)观察,电镜工作电压为80 kV;为观察和测定材料的厚度,分别取10 μL GO、CNT和GOQD乙醇分散液滴在云母片上,使用原子力电子显微镜(AFM)(Dimention Icon,美国Bruker公司)进行观察。AFM图片用NanoScope Analysis 1.8软件进行分析。
1.3 斑马鱼的培养与CNMs暴露实验
1.3.1 斑马鱼培养
斑马鱼饲养条件为:循环水箱培养,培养水为海盐浓度60 mg·L-1的人工海水,水温为(28±0.5) ℃,光照周期为14 h光照∶10 h黑暗,每日投喂丰年虾2次。斑马鱼胚胎的获得:挑选个体大小相同雌雄斑马鱼于前一天晚上按照雌雄比1∶1放入产卵盒中,将雌鱼和雄鱼使用隔板隔开后,将产卵盒放入人工气候培养箱中(SPX-300I-C,中国上海博迅医疗生物仪器股份有限公司)。次日,在斑马鱼光照周期开始时取出产卵盒中的隔板,雌雄斑马鱼自然交配,1 h后,收集鱼卵,得到斑马鱼胚胎。使用斑马鱼胚胎培养液E3溶液清洗干净,其中,E3溶液组分为:5 mmol·L-1NaCl,0.17 mmol·L-1KCl,0.33 mmol·L-1CaCl2,0.33 mmol·L-1MgSO4,pH = 7.4。以上试剂均为分析纯,购自中国天津市康科德科技有限公司。胚胎清洗干净后将健康斑马鱼胚胎转移到E3培养液中,置于人工气候培养箱中培养至2.5 hpf(hours post fertilization),用于后续实验研究。
1.3.2 斑马鱼幼鱼CNMs暴露
准确称取100 mg GO,使用E3培养液将其分散并定容至1 L,制成100 mg·L-1的GO分散液母液,冰浴超声30 min至其充分分散后备用;取50 mL 100 mg·L-1的GO分散液使用E3稀释至500 mL,得到10 mg·L-1的GO培养液,再次将其使用E3培养液逐级稀释,得到1、0.1和0.01 mg·L-1的GO-E3培养液。CNT-E3与GOQD-E3培养液的配制方法与GO-E3培养液的配制方法步骤相同。将2.5 hpf斑马鱼胚胎暴露于E3培养液(空白对照组)以及0.01、0.1、1和10 mg·L-13种CNMs E3分散液中120 h。暴露实验在96孔板中进行,每孔一枚受精卵。每隔24 h更换一次纳米材料分散液。整个胚胎染毒实验均在人工气候培养箱中进行,培养箱温度为(28±1) ℃,光照周期为光暗比14 h∶10 h。
1.3.3 斑马鱼成鱼CNMs暴露
0.01 mg·L-1CNMs斑马鱼成鱼暴露液的配制方法同1.3.2,但其分散系为60 mg·L-1海盐人工海水。体型相近、性别随机的斑马鱼成鱼被随机分为4组,每组6条,置于1 L烧杯中,烧杯中暴露液体积为1 L。对照组与暴露组均被置于人工气候培养箱中,培养箱温度为(28±1) ℃,光照周期为光暗比14 h∶10 h。每日投喂2次商业鱼饲料(中国惠州市寸金饲料有限公司)。对照组与暴露组培养液每隔一天更换一次,参考Jia等[8]的工作,斑马鱼成鱼暴露总时长为21 d。
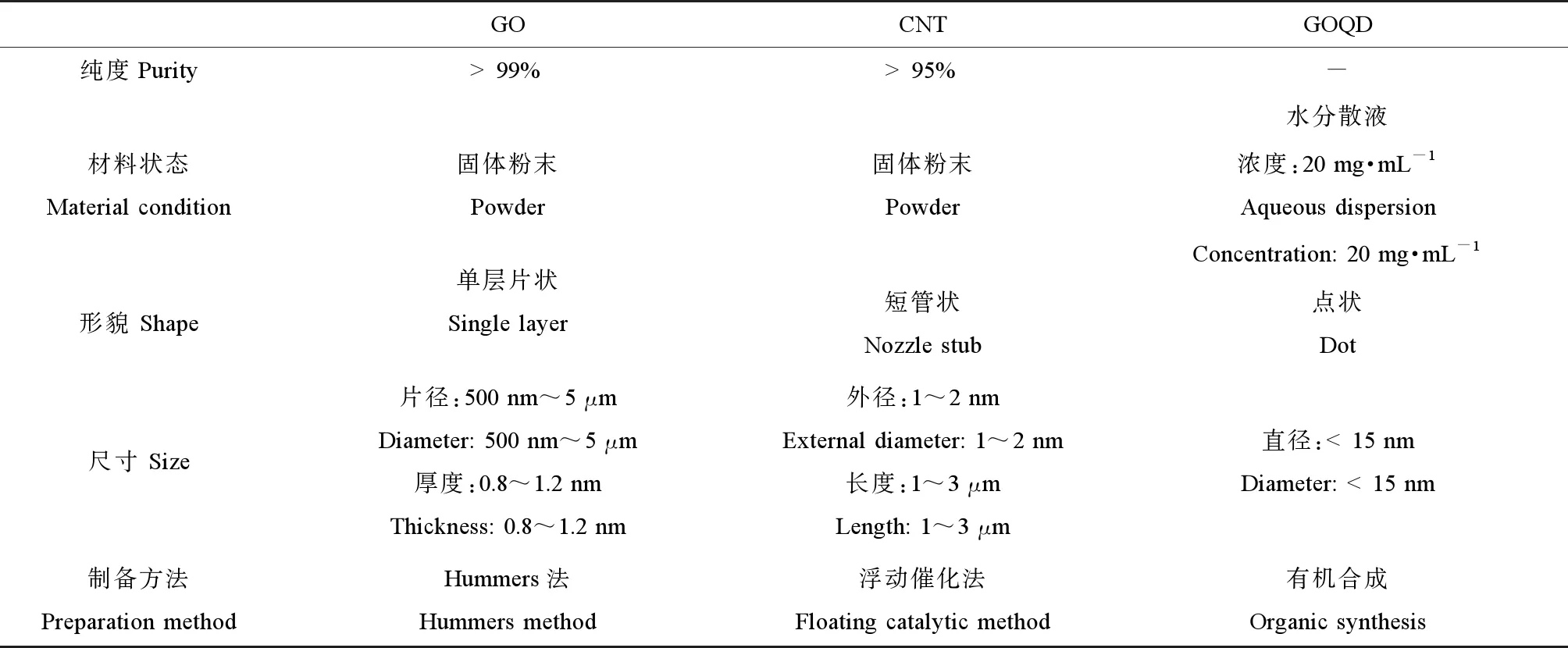
表1 3种碳纳米材料(CNMs)基本信息Table 1 The basic properties of three carbonaceous nanomaterials (CNMs)
1.4 斑马鱼幼鱼生长发育毒性观察
1.4.1 斑马鱼幼鱼死亡和畸形观察
每个浓度取90尾2.5 hpf斑马鱼胚胎于96孔板中进行120 h的暴露实验,设置3个生物重复,即每组包含30个斑马鱼胚胎。使用体视镜(ZL 61,日本Olympus公司)观察记录斑马鱼胚胎/幼鱼,以不运动、无心跳和血液不流动(因斑马鱼幼鱼周身组织透明,体视镜下可观察到活体斑马鱼心脏跳动和血液流动,斑马鱼心脏区域如图2所示)作为死亡标准统计暴露120 h后斑马鱼死亡率;每天在体视显微镜下观察斑马鱼幼鱼的畸形情况,以心包/卵黄囊水肿、尾/脊椎弯曲和面部畸形等标准进行判断,最终统计各组发育至120 hpf的斑马鱼幼鱼的畸形率。
1.4.2 斑马鱼幼鱼活性氧簇观察
斑马鱼幼鱼活性氧簇(reactive oxygen species, ROS)的测定可以通过测定2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)(中国北京索莱宝科技有限公司)通过细胞膜后生产DCF的荧光强度来实现。每个CNMs浓度组取24条发育至2.5 hpf斑马鱼胚胎于96孔板中暴露120 h,设置3个生物重复。暴露结束后,每组随机取出4条斑马鱼幼鱼,用E3培养液冲洗干净后,在含5 μmol·L-1DCFH-DA的E3培养液中避光孵育0.5 h。染色结束后,用新鲜E3培养液冲洗幼鱼6次,染色完成的斑马鱼在0.03%三卡因(纯度99%,美国Sigma公司)中麻醉后,于倒置荧光显微镜(X71,日本Olympus公司)下观察拍照,激发波长和发射波长分别为488 nm和535 nm。利用Image J软件对斑马鱼平均荧光强度进行定量分析。
1.4.3 斑马鱼幼鱼线粒体膜电位观察
JC-1是检测线粒体膜电位的理想荧光探针。JC-1(美国Adipogen公司)红色荧光到绿色荧光的转变显示线粒体膜电位下降。每个CNMs浓度组取24条发育至2.5 hpf斑马鱼胚胎于96孔板中暴露120 h,设置3个生物重复,即每组包含8条斑马鱼幼鱼。暴露结束后,每组随机取出4条斑马鱼幼鱼,用E3溶液冲洗干净后,在含4 μmol·L-1JC-1的E3溶液中避光孵育1 h。染色结束后,用新鲜E3溶液冲洗幼鱼6次,染色完成的斑马鱼在0.03%三卡因中麻醉后,于倒置荧光显微镜(X71,日本Olympus公司)下观察拍照,激发波长分别为488 nm和535 nm。利用Image J软件对斑马鱼的平均荧光强度进行定量分析。
1.5 斑马鱼成鱼亚急性毒性测试
1.5.1 鱼腮和肾组织石蜡切片的制作及β-半乳糖苷酶染色
斑马鱼成鱼暴露于CNMs分散液21 d后,将其取出,使用0.06%三卡因溶液安乐死后迅速于冰上解剖,取出斑马鱼成鱼的腮和肾脏置于4%多聚甲醛溶液(中国鼎国生物科技有限公司)固定,并将其置于4 ℃冰箱过夜。过夜后组织使用自来水流水冲洗24 h,之后进行脱水浸蜡,其过程为:70%乙醇,30 ℃,30 min;85%乙醇,30 ℃,10 min;95%乙醇,30 ℃,10 min;100%乙醇Ⅰ,30 ℃,10 min;100%乙醇Ⅱ,30 ℃,30 min;二甲苯/乙醇,30 ℃,30 min,二甲苯Ⅱ,30 ℃,15 min;二甲苯Ⅲ,30 ℃,15 min;石蜡Ⅰ,60 ℃,20 min;石蜡Ⅱ,60 ℃,10 min;石蜡Ⅲ,60 ℃,10 min。浸蜡后的组织块使用包埋机(EG1150H,德国LEICA公司)包埋,手动切片机(RM2235,德国LEICA公司)将组织切为5 μm切片后,展片烘干备用。斑马鱼组织切片β-半乳糖苷酶活性使用细胞衰老β-半乳糖苷酶染色试剂盒(C0602,中国上海碧云天生物技术有限公司)检测,检测过程严格按照试剂盒说明书进行。
1.5.2 丙二醛(MDA)含量测试
斑马鱼成鱼暴露于CNMs分散液21 d后,将其取出,使用0.06%三卡因溶液安乐死后,将斑马鱼表面清洗干净,迅速于冰上将斑马鱼分割,置入玻璃匀浆器制成10%生理盐水匀浆后使用冷冻离心机(5804 R,德国Eppendorf公司)在4 ℃下3 000 r·min-1离心10 min后取上清,随后使用MDA测试试剂盒(A003-1-2,中国南京建成生物工程研究所)进行测定,上清液蛋白浓度使用蛋白质含量试剂盒(A045-4-2,中国南京建成生物工程研究所)测定。试剂盒测定过程严格按照试剂盒说明书要求进行。
1.5.3 总超氧化物歧化酶(T-SOD)活性测定
斑马鱼成鱼暴露于CNMs分散液21 d后,将其取出,使用0.06%三卡因溶液安乐死后,将斑马鱼表面清洗干净,迅速于冰上将斑马鱼分割,置入玻璃匀浆器制成10%生理盐水匀浆后使用冷冻离心机(5804 R,德国Eppendorf公司)在4 ℃下3 000 r·min-1离心10 min后取上清,随后使用T-SOD测试试剂盒(A001-1-2,中国南京建成生物工程研究所)进行测定,上清液蛋白浓度使用蛋白质含量试剂盒(A045-4-2,中国南京建成生物工程研究所)测定。
1.6 代谢组学分析
斑马鱼成鱼暴露于CNMs分散液21 d后,将其取出,迅速置于液氮中5 min后取出,在液氮上的研钵中将组织研磨成粉末后进行代谢物提取。代谢物提取过程为:(1)在研磨好的样品中加入15 mL提前保存于-20 ℃的提取混合溶液Ⅰ(V(甲醇)∶V(氯仿)∶V(水)=2.5∶1∶1);(2)微波辅助萃取,40 ℃,30 min,萃取完成后离心,收集上清液,然后加入15 mL提前保存于-20 ℃的提取混合溶液Ⅰ(V(甲醇)∶V(氯仿)∶V(水)=2.5∶1∶1) (用量与步骤(1)相同),微波辅助萃取,40 ℃,15 min;(3)收集第二次上清液,并与第一次收集的上清液混合于50 mL离心管中。加入500 μL灭菌后的去离子水,4 000 r·min-1离心5 min;(4)完成以上步骤后将离心管静置,上层溶液是甲醇/水相,下层为氯仿相。甲醇/水相冷冻干燥,用氮气吹干氯仿相;(5)样品干燥后,采用两步法进行衍生化。首先加入50 μL用吡啶溶解的甲氧氨基盐酸盐(20 mg·mL-1),密封、涡旋、短暂离心,30 ℃温浴90 min;(6)加入80 μL硅烷化试剂N-甲基-N-(三甲基硅烷)-三氟乙酰胺(MSTFA)(中国上海安谱实验科技有限公司),37 ℃温浴30 min;(7)转移衍生化好的样品到适合气相质谱(GC-MS)分析的内衬管中。
斑马鱼代谢物使用GC-MS(6890A/5977A,美国Agilent公司)进行分析。测试参数如下。(1)气相色谱进样参数:进样量1 μL,进样口温度230 ℃,调整分流进样模式(1∶50),载气为氦气,流速2 mL·min-1,使用自动进样器进样。气相色谱参数:MDN-35毛细管色谱柱(30 m),温度程序为80 ℃恒温2 min,然后以15 ℃·min-1的速率升温到330 ℃,持续6 min,传输线(transfer line)温度设定为250 ℃。(2)质谱参数:离子源温度设定为250 ℃,质量扫描范围是m/z70~600,采集速率每秒20个扫描,质谱电子轰击源灯丝开启时间在色谱溶剂延迟170 s后,检测器电压1 700~1 850 V,质谱亏损设置为0,灯丝偏置电流为70 V,仪器自动调谐。谱图解卷积参数:力可公司自带的商业软件Chroma TOF,基线消除(baseline offset)设置为1(0.5~1);谱图平滑(smoothing)为5数据点(3~7),峰宽(peak width)3 s(3~4 s);信噪比S/N(signal-to-noise ratio)为10(2~15)。
1.7 数据统计分析
所有的实验组均设置3个或3个以上生物重复,结果用平均值±标准偏差表示。所得实验数据使用SPSS 20.0统计软件进行单因素方差(ANOVA)分析,当P<0.05时,认为在统计学上具有显著性。代谢物热图使用软件MeV 4.9绘制,同时将筛选出的代谢物数据导入SIMCA-P11.5软件包进行多元统计分析,数据先用无监督统计模型主成分分析(principal components analysis, PCA),得出对照组和处理组之间代谢物的离散趋势。使用有监督统计模型的正交最小二乘法判别分析(orthogonal partial least squares discriminate analysis, OPLS-DA)[15-16],将差异代谢物与斑马鱼的T-SOD活性变化建立相关性,选择定义变量权重重要性排序(variable importance in projection, VIP)>1的变量进行研究。
2 结果与讨论(Results and discussion)
2.1 3种CNMs材料的表征
纳米材料的毒性与其自身的理化性质(如形貌和尺寸)紧密相关。3种CNMs的形貌用TEM和AFM观察,结果如图1所示。如图1(a)和图1(d),GO的形貌为单层片状,片径范围为(1.5±0.50) μm,厚度范围(1.15±0.25) nm;CNT的形貌为长度在微米级别的细长管状结构,管外径约为2.58 nm,内径约为0.8~1.6 nm。而GOQD为成不规则的点状形貌,其粒径大小约为(20±5) nm,高度范围为(7.8±1.1) nm。傅里叶变换红外光谱仪(FTIR)和X射线光电子能谱(XPS)可以用来表征纳米材料的表面化学官能团。根据我们之前FTIR表征的结果可知,GO、CNT和GOQD表面都具有丰富的官能团,包括—OH、—COOH和—O—。XPS的结果表明,GO主要由67.2% C 1s、30.4% O 1s和2.4% S 2p组成,CNT由62.7% C 1s、29.4% O 1s、7.2% Na 1s和0.7% Cl 2p组成,而GOQD则由78.2% C 1s、16.5% O 1s和5.3% Na 1s组成[17]。其中,Na、Cl和S等元素都是合成CNMs过程中引入的杂离子。

图1 3种碳纳米材料的透射电子显微镜(TEM)和原子力电子显微镜(AFM)的形貌表征注:(a)、(b)和(c)分别为GO、CNT和GOQD的TEM图片;(d)、(e)和(f)分别为GO、CNT和GOQD的AFM图片。Fig. 1 The morphology of three carbonaceous nanomaterials characterized by emission electron microscope (TEM) and atomic force electron microscope (AFM)Note: (a), (b) and (c) are TEM images of GO, CNT and GOQD; (d), (e) and (f) are AFM images of GO, CNT and GOQD.
2.2 3种CNMs对斑马鱼幼鱼生长发育的影响
纳米材料对斑马鱼胚胎/幼鱼的生长发育毒性是常规的纳米毒性指标。在此,考察了3种CNMs短时间暴露(120 hpf)对斑马鱼胚胎/幼鱼生长发育的影响,包括死亡率、畸形率、线粒体膜电位损伤和ROS等毒性指标。如图2(a)所示,斑马鱼幼鱼暴露于GO、CNT和GOQD组的死亡率约为3.4%~9.1%,略高于空白对照组(2.3%),但是都没有显著差异(P>0.05)。类似的趋势出现在斑马鱼幼鱼畸形率方面。如图2(b)所示,空白对照组的畸形率约为0,而GO、CNT和GOQD组的畸形率都在5%以下,无显著性差异(P>0.05)。以上结果表明,在0.01~10mg·L-1的浓度下短期暴露(120 hpf)于这3种CNMs均不会对斑马鱼幼鱼的存活和致畸方面产生显著性的影响。
氧化应激是已知的纳米材料对鱼类致畸机制之一[18]。斑马鱼幼鱼暴露于不同浓度的GO、CNT和GOQD 120 hpf后,斑马鱼幼鱼体内总ROS含量的变化如图3所示。荧光强度的水平与斑马鱼体内ROS含量成正比,其结果如图3(a)~图3(d)所示,具体统计结果如图3(e)所示。其中,GO组虽然在4个浓度上对斑马鱼幼鱼体内的ROS影响并不显著,但其在平均值上,尤其是在浓度为1 mg·L-1和10 mg·L-1时,斑马鱼幼鱼ROS含量平均值相对于对照组有上升;CNT和GOQD在0.01 mg·L-1和0.1 mg·L-1浓度下对斑马鱼幼鱼的ROS影响与GO类似,即没有产生显著影响,但当CNT和GOQD的浓度为1 mg·L-1和10 mg·L-1时,斑马鱼幼鱼体内ROS含量显著升高(P<0.05)。Chen等[19]的研究表明,GO可通过升高生物体内的ROS水平诱发斑马鱼的发育。本研究的结果表明,1 mg·L-1和10 mg·L-1的CNT和GOQD均会引起斑马鱼幼鱼体内发生显著的氧化应激,且10 mg·L-1GOQD处理组斑马鱼幼鱼体内ROS含量较对照组显著上升,该结果与斑马鱼发育毒性实验观察到的畸形率上升趋势相一致(图2(b))。GO、CNT和GOQD低浓度(0.01 mg·L-1和0.1 mg·L-1)暴露均不会引起斑马鱼幼鱼体内ROS含量的显著上升,而1 mg·L-1和10 mg·L-1的CNT和GOQD会诱导斑马鱼幼鱼体内ROS含量显著上升,从而产生氧化损伤。由此可知,在引起斑马鱼幼鱼ROS含量上升,造成斑马鱼幼鱼氧化应激方面,3种CNMs的毒性影响排序为GOQD>CNT>GO。

图3 GO、CNT和GOQD暴露120 hpf后对斑马鱼幼鱼体内活性氧簇(ROS)的影响注:(a)、(b)、(c)和(d)分别为空白对照组、10 mg·L-1 GO暴露组、10 mg·L-1 CNT暴露组和10 mg·L-1 GOQD暴露组的ROS荧光的代表性照片;(e)为暴露120 hpf后斑马鱼幼鱼体内ROS的荧光强度;黑色的*表示实验组与空白对照组有显著性差异P<0.05。Fig. 3 Effects of GO, CNT and GOQD on the reactive oxygen species (ROS) of zebrafish larvae after 120 hpf exposureNote: (a), (b), (c) and (d) are representative images of the ROS fluorescence in control group, 10 mg·L-1 GO exposure group, 10 mg·L-1 CNT exposure group and 10 mg·L-1 GOQD exposure group; (e) fluorescence intensity representing the ROS content in zebrafish larvae after exposure to nanoparticles until 120 hpf; the black asterisks denote significant differences at P<0.05 level compared with the control groups.
线粒体膜电位损失是纳米材料诱导产生氧化应激压力的重要途径[20]。斑马鱼幼鱼暴露在GO、CNT和GOQD 120 hpf后的线粒体膜电位损失如图4(a)~图4(d)所示,图中红色荧光显示健康线粒体膜,绿色荧光代表受损伤的线粒体膜,其红/绿荧光的平均强度比值为衡量斑马鱼线粒体膜电位健康程度的指标。红/绿荧光的平均强度比值越大,代表斑马鱼受到线粒体膜电位的损伤越小,反之则受到的损伤越大。从图4(e)中可以看出,与空白对照组(红/绿荧光比值=3.8)相比,GO、CNT和GOQD暴露组斑马鱼幼鱼体内红/绿色荧光的比值范围分别为2.1~3.0、2.1~2.7和1.8~2.3。值得注意的是,3种CNMs能诱导斑马鱼幼鱼线粒体膜电位值下降,但是不同浓度的同种CNMs组别中斑马鱼线粒体膜电位的变化并未出现明显的剂量-效应关系。与空白对照组相比,在最低浓度0.01 mg·L-1的3种CNMs暴露下,斑马鱼幼鱼线粒体膜电位损伤并不显著(P>0.05)。GO与CNT在0.1 mg·L-1和1 mg·L-1暴露时能引起了斑马鱼幼鱼线粒体膜电位的显著下降(P<0.05)。在10 mg·L-1的GO、CNT和GOQD暴露下,红/绿色荧光的比值分别下降了18.9%(P>0.05)、27.1%(P<0.05)和52.3%(P<0.05)。以上结果表明,3种CNMs暴露均会对斑马鱼幼鱼造成一定的线粒体损伤,但在不同种类和浓度CNMs的作用下这种损伤的大小是有差异的。3种CNMs对斑马鱼幼鱼线粒体膜电位损伤影响排序为GOQD>CNT>GO,这结果与对ROS的影响是一致的(图3)。
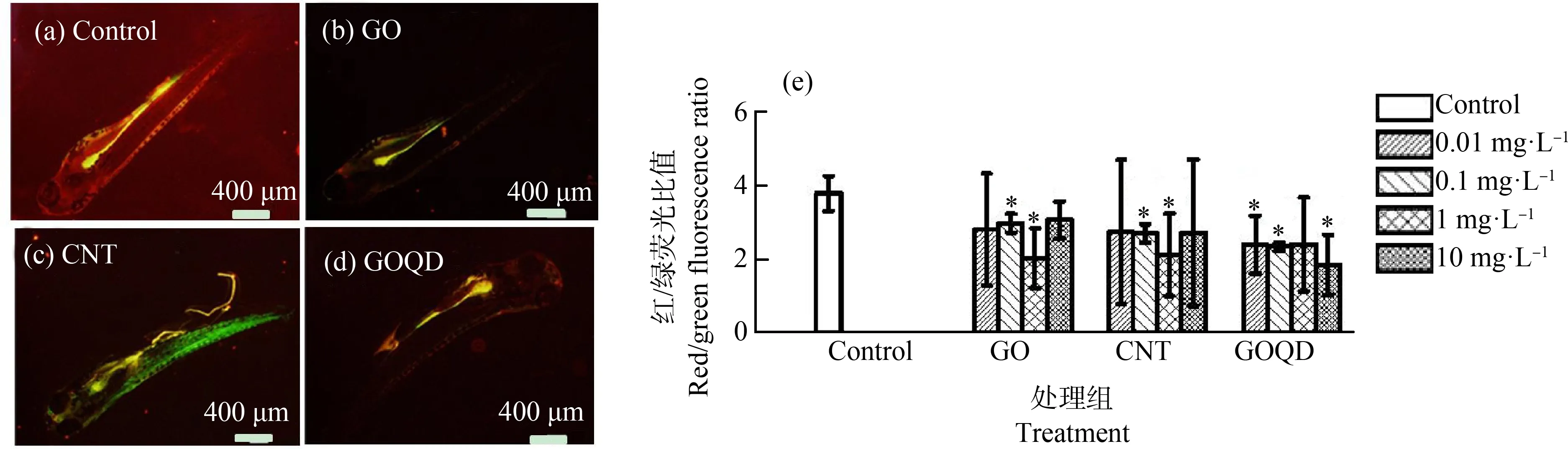
图4 GO、CNT和GOQD暴露120 hpf后对斑马鱼幼鱼线粒体膜电位损伤的影响注:(a)、(b)、(c)和(d)分别为空白对照组、10 mg·L-1 GO暴露组、10 mg·L-1 CNT暴露组和10 mg·L-1 GOQD暴露组的线粒体膜电位损伤的代表性照片;(e)为暴露120 hpf后斑马鱼幼鱼体内线粒体膜电位损伤红/绿荧光的比值的统计;黑色的*表示实验组与空白对照组有显著性差异P<0.05。Fig. 4 Effects of GO, CNT and GOQD on the mitochondrial membrane potential loss of zebrafish larvae after 120 hpf exposureNote: (a), (b), (c) and (d) representative images of the mitochondrial membrane potential loss in control group, 10 mg·L-1 GO exposure group, 10 mg·L-1 CNT exposure group and 10 mg·L-1 GOQD exposure group; (e) red to green fluorescence intensity ratios in zebrafish larvae after exposure to nanoparticles until 120 hpf; the black asterisks denote significant differences at P<0.05 level compared with the control groups.
综上所述,GO、CNT和GOQD在不同浓度短期暴露(120 hpf)下并未对斑马鱼幼鱼的存活和致畸造成特别显著的影响,但是GO、CNT和GOQD会诱导斑马鱼幼鱼产生ROS和线粒体膜电位损伤。此外,相比GO和CNT,GOQD能诱导产生更多的ROS和更强的线粒体膜电位损伤。
2.3 3种CNMs对斑马鱼成鱼的亚急性毒性
目前,关于纳米材料对斑马鱼毒性的研究多集中于斑马鱼幼鱼的发育毒性和高浓度(mg·L-1级)纳米材料的急性毒性[19,21-22]。但环境中CNMs在自然水体和土壤等环境介质中的检出或预测浓度大约在ng·L-1~μg·L-1级别[23-24]。鉴于生态环境中生物的暴露模式,研究长期的、低浓度的CNMs的水生生物暴露毒性机理必不可少[13,17]。就本研究而言,在斑马鱼幼鱼的毒性暴露实验中,0.01 mg·L-1浓度相对于其他浓度对斑马鱼存活率、畸形率、线粒体损伤和ROS含量的影响最小,但是0.01 mg·L-1也会引起死亡率上升,且0.01 mg·L-1GOQD能诱导产生明显的线粒体膜损伤。基于以上因素的考虑,选取CNMs对斑马鱼成鱼亚急性毒性暴露的浓度为0.01 mg·L-1,暴露时间为21 d。通过斑马鱼β-半乳糖苷酶、MDA及T-SOD等毒性指标的测定来比较探索3种CNMs对斑马鱼成鱼的亚急性毒性效应。
β-半乳糖苷酶是一种典型的细胞衰老标志物,其含量越高表明细胞衰老越快[25-26]。斑马鱼腮和肾β-半乳糖苷酶表达结果分别如图5(a)~图5(d)和图5(e)~图5(h)所示,细胞蓝色的点为β-半乳糖苷酶表达。对照组与处理组的β-半乳糖苷酶表达通过Image J统计出表达细胞个数来衡量,其统计结果如图5(i)~图5(j)所示。结果表明,3种纳米材料均会引起斑马鱼成鱼的腮部和肾脏β-半乳糖苷酶表达显著升高(P>0.05),这说明,GO、CNT和GOQD均会引起斑马鱼的腮和肾脏细胞的衰老。鱼类的腮和肾是斑马鱼重要的呼吸和代谢器官,其作用涉及斑马鱼呼吸和血液代谢等,其细胞活性对于斑马鱼生理代谢有着重要作用[27-28]。因而,斑马鱼腮和肾的细胞衰老可能诱导斑马鱼产生潜在的健康风险。
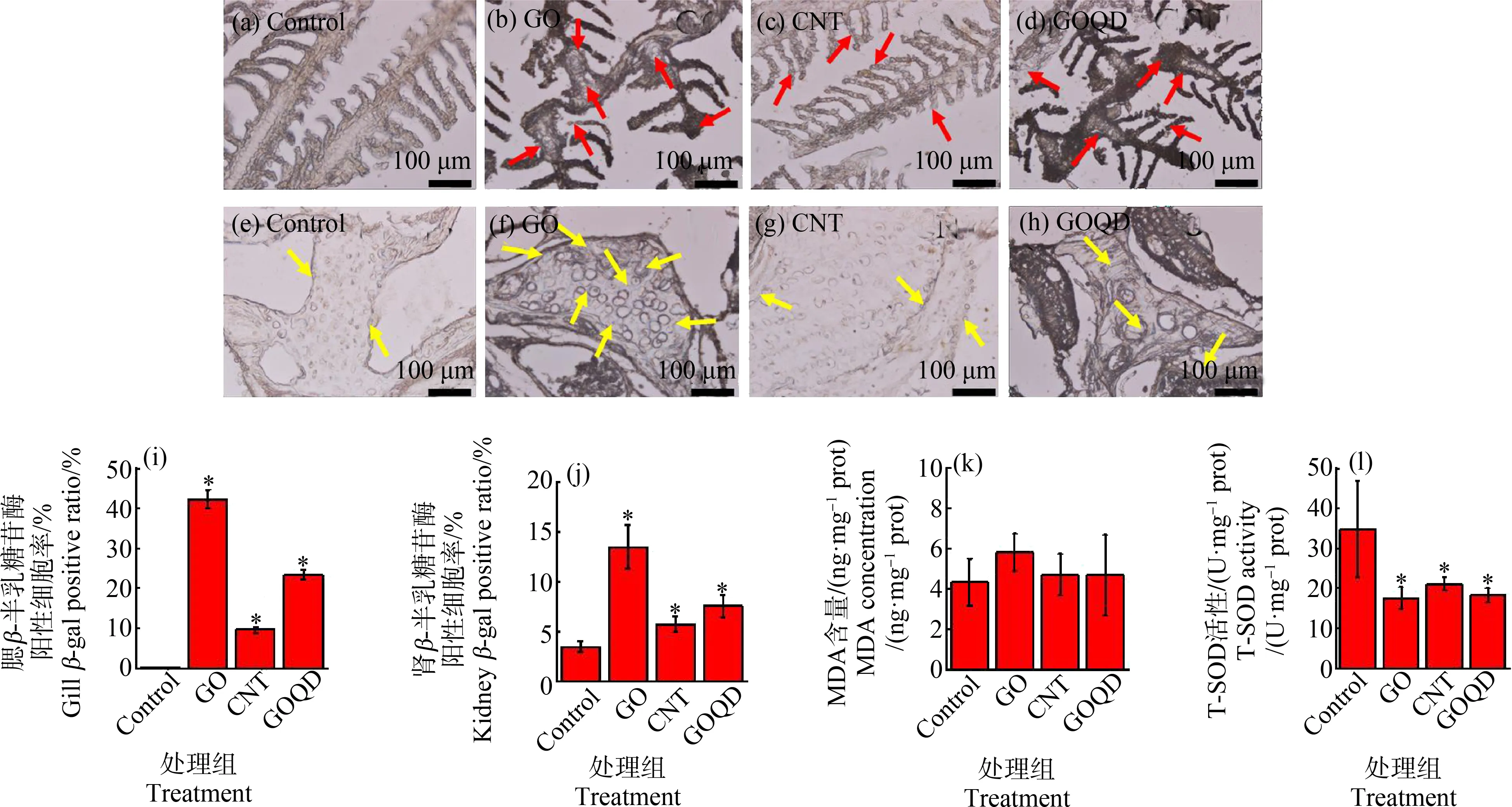
图5 低浓度3种碳纳米材料对斑马鱼成鱼亚急性毒性影响注:(a)、(b)、(c)和(d)分别为空白对照组、0.01 mg·L-1 GO暴露组、0.01 mg·L-1 CNT暴露组和0.01 mg·L-1 GOQD暴露组中对斑马鱼腮β-半乳糖苷酶活性影响代表性图片;(e)、(f)、(g)和(h)分别为空白对照组、0.01 mg·L-1 GO暴露组、0.01 mg·L-1 CNT暴露组和0.01 mg·L-1 GOQD暴露组中对斑马鱼肾脏β-半乳糖苷酶活性影响代表性图片;(i)~(j)分别为3种碳纳米材料对斑马鱼腮和肾脏细胞β-半乳糖苷酶阳性率的统计;(k)~(l)分别为3种碳纳米材料对斑马鱼总超氧化物歧化酶(T-SOD)活性和丙二醛(MDA)含量的影响;(b)~(d)中红色箭头以及(e)~(h)中黄色箭头所指区域分别为斑马鱼腮和肾脏中部分β-半乳糖苷酶阳性点;黑色的*表示实验组与空白对照组有显著性差异P<0.05。Fig. 5 Subacute toxicity induced by three low concentration carbonaceous nanomaterials in adult zebrafishNote: (a), (b), (c) and (d) are typical pictures of effects on β-galactosidase (β-gal) activity of adult zebrafish gill in control group, 0.01 mg·L-1 GO exposure group, 0.01 mg·L-1 CNT exposure group and 0.01 mg·L-1 GOQD exposure group; (e), (f), (g) and (h) are typical pictures of β-gal activity of adult zebrafish kidney in control group, 0.01 mg·L-1 GO exposure group, 0.01 mg·L-1 CNT exposure group and 0.01 mg·L-1 GOQD exposure group; (i)~(j) statistical analysis of positive cell ratio of β-gal activity in adult zebrafish gill and kidney after exposure to three carbonaceous nanomaterials; (k)~(l) influence induced by three carbonaceous nanomaterials on total superoxide dismutase (T-SOD) activity and malondialdehyde (MDA) concentration of adult zebrafish; red arrows in figure (b)~(d) and yellow arrows in figure (e)~(h) represent partial dots with positive β-gal activity in adult zebrafish gill and kidney; the black asterisks denote significant differences at P<0.05 level compared with the control groups.
由图3和图4结果可知,1 mg·L-1和10 mg·L-1的3种CNMs(GO、CNT和GOQD)均会对斑马鱼氧化应激和线粒体膜电位造成影响。生物组织MDA含量和T-SOD活性是衡量生物组织氧化应激的重要指标[29]。为研究低浓度长期暴露对斑马鱼抗氧化系统的影响,选取斑马鱼MDA含量和T-SOD活性来衡量0.01 mg·L-1的3种CNMs对斑马鱼成鱼氧化应激的影响,其结果如图5(k)和图5(l)所示。与对照组相比,0.01 mg·L-1的GO、CNT和GOQD处理组斑马鱼成鱼体内MDA含量均无显著差异(P>0.05)。但是0.01 mg·L-1的GO、CNT和GOQD中暴露21 d后的斑马鱼成鱼体内T-SOD活性较对照组有显著差异(P<0.05)。具体而言,GO、CNT和GOQD处理组的T-SOD活性较空白对照组分别降低了49.7%、39.3%和47.5%。但是3种材料处理组之间T-SOD活性无显著性差异(P>0.05)。T-SOD作为研究生物氧化应激的重要指标,其活性的降低也意味着生物氧化应激反应,这与本研究幼鱼的研究结果具有一致性,而其背后机理需要我们进一步研究。
2.4 3种CNMs对斑马鱼成鱼代谢组的影响
近年来,代谢组学以其对生物毒性的高灵敏度响应已经成为研究生物毒性机理的有效工具,尤其在揭示纳米材料诱导的生物毒性机制领域独具优势[13,17]。为探索斑马鱼成鱼在3种CNMs中亚急性暴露的分子机理,我们引入代谢组学对其进行分析。GC-MS测定经过衍生化的样品,测得代谢物中约有230个质谱峰出现,其中,64种代谢物被鉴定出来,将空白对照组和CNMs暴露组中这64种代谢物的相对含量归一化后用热图表示,如图6(a)所示。此外,对64种代谢物进行聚类分析和PCA分析,在PCA图中每点代表不同种类CNMs的代谢物组,点之间的距离与样品代谢物组成的相似程度成反比,即距离越远,其相似程度越低。如图6(b)所示,对照组与GO组的距离最近,而与GOQD组的距离最远,CNT组与对照组的距离介于GO和GOQD之间,说明GOQD组斑马鱼代谢物与对照组差异最大,而GO处理组对斑马鱼代谢物的影响最小,其结果与聚类分析的结果一致。
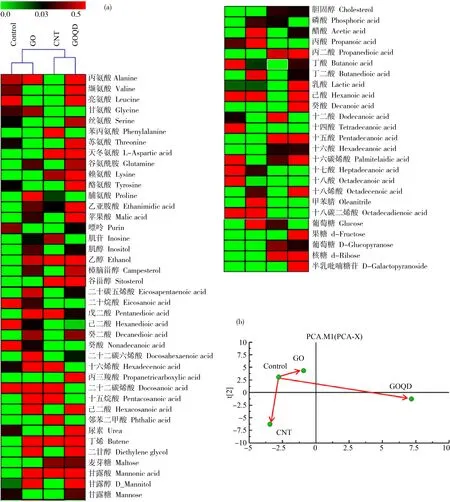
图6 斑马鱼成鱼空白对照组和3种碳纳米材料21 d暴露组代谢分析注:(a)为差异代谢物的热图;(b)为PCA聚类分析图。Fig. 6 Metabolic analysis of the control and three carbonaceous nanomaterials-exposed adult zebrafish groups at 21 dNote: (a) heat map of all the identified metabolites; (b) PCA cluster analysis.
为了在更深层次上研究3种CNMs对斑马鱼成鱼代谢物的具体影响,考察了3种CNMs对其有显著影响的代谢物。显著差异代谢物被定义为:当纳米材料处理组某代谢物的峰面积是对照组同一代谢物峰面积的1.5倍以上或0.67倍以下时,该代谢物被称为显著差异代谢物(significantly changed metabolite, SCM)。本研究中3种纳米材料的SCM的数量与种类如表2所示。将SCM分为了以下几个主要类型:氨基酸、脂肪酸、糖类及糖类衍生物和其他小分子差异代谢物等。氨基酸的变化在处理组中是十分显著的,在3种CNMs处理组中的氨基酸SCM中,CNT引起的氨基酸变化数量最多,为11种,GO与GOQD相近,分别为5种和6种。在以上不同类型的差异物中,脂肪酸是3种CNMs引起的SCM中占比最大的代谢物种类,GO、CNT和GOQD处理组中脂肪酸在总SCM的比例分别为55%、50%和56%。说明脂肪酸代谢是受3种CNMs影响最为显著。
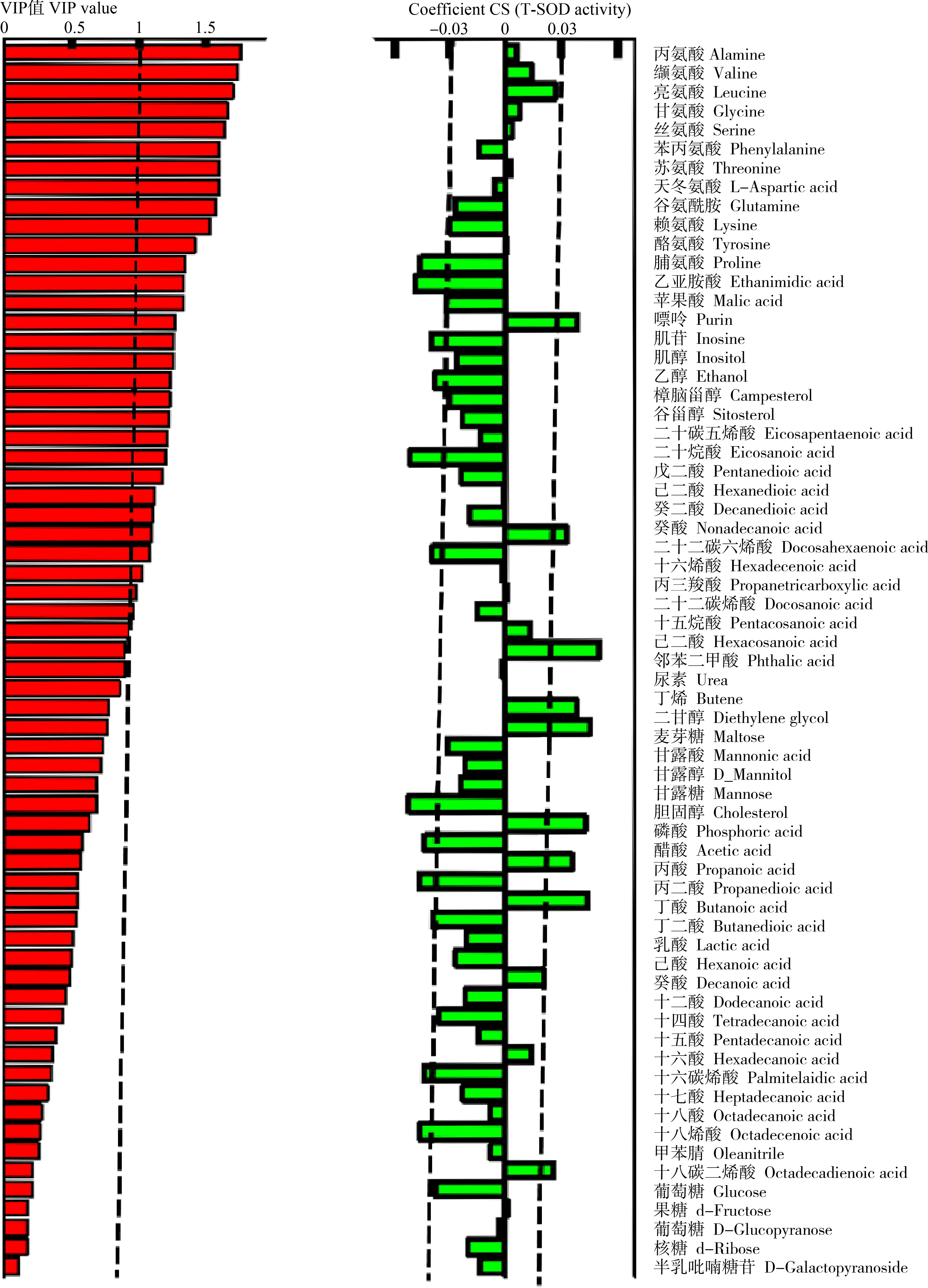
图7 代谢物的正交偏最小二乘判别(OPLS-DA)分析注:代谢物相关系数(Coefficient CS)和变量权重重要性排序(VIP)值分别为自变量,T-SOD活性为因变量的OPLS-DA分析。Fig. 7 The orthogonal partial least-squares discriminant analysis (OPLS-DA) of metabolitesNote: Coefficient CS and variable importance in projection (VIP) value with the metabolic levels as the independent variable and T-SOD activity as the dependent variable using OPLS-DA.
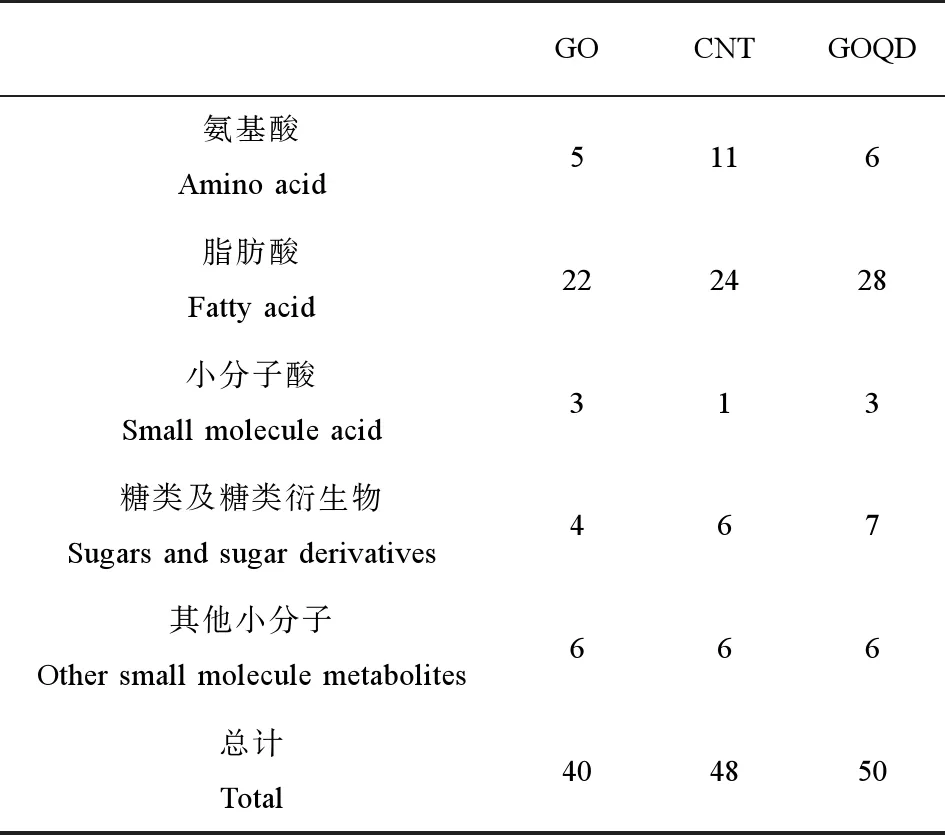
表2 3种纳米材料暴露组中斑马鱼成鱼体内显著差异代谢物类型统计Table 2 Type analysis of significantly changed metabolites (SCMs) induced by three carbonaceous nanomaterials in adult zebrafish
为进一步确认与斑马鱼成鱼氧化应激相关的代谢物的变化,利用OPLS-DA法进行斑马鱼代谢物与斑马鱼T-SOD活性相关性分析,Y变量是斑马鱼T-SOD活性,X变量是代谢物,分析结果如图7所示。64种代谢产物中有21种代谢物的Coefficients CS系数为正数,这表明细胞中这些代谢物对斑马鱼体内T-SOD的生成做出了积极贡献,而负相关代谢物有43种。此外,对代谢物进行了变量重要性投影,得到VIP>1的代谢物有24种。OPLS-DA分析表明,3种CNMs处理21 d后,28种代谢物的变化与斑马鱼T-SOD活性变化相伴发生,说明代谢物的变化可能是3种CNMs引起斑马鱼T-SOD活性变化的分子机制。其中,与T-SOD活性正相关且VIP>1的代谢物有8种,其中7种为脂肪酸,包含丁酸、二十烷酸和十四烷酸等,说明这些脂肪酸的变化与斑马鱼T-SOD活性的下降正相关;同时,与T-SOD活性负相关且VIP>1的代谢物有16种,其中包含一种氨基酸(脯氨酸)、7种脂肪酸、2种糖及糖类衍生物以及其他小分子化合物,这16种代谢物与斑马鱼T-SOD活性下降正相关。在与T-SOD活性负相关的代谢物中,脯氨酸作为精氨酸/脯氨酸代谢通路的重要一环,在处理组均显著上升。上述结果表明,代谢组学分析为了解3种CNMs对成年斑马鱼亚急性毒性效应的分子机制提供了新的思路和视角。
由以上研究内容可得出以下3点结论:
(1)3种CNMs在1 mg·L-1和10 mg·L-1浓度下会引起斑马鱼幼鱼线粒体损伤,损伤严重程度为GOQD>CNT>GO;同时,GOQD和CNT在1 mg·L-1和10 mg·L-1浓度下会引起斑马鱼幼鱼氧化应激,且在10 mg·L-1时GOQD对斑马鱼幼鱼的影响大于CNT。
(2)环境相关浓度下,3种CNMs亚急性暴露会引起斑马鱼成鱼腮和肾脏细胞衰老,同时抑制斑马鱼成鱼T-SOD活性,但是对斑马鱼成鱼MDA含量没有显著影响。
(3)代谢组学分析表明,3种CNMs对斑马鱼代谢组影响的顺序为GOQD>CNT>GO;T-SOD活性与代谢组学关联分析表明,脂肪酸和脯氨酸的变化是引起斑马鱼T-SOD活性变化的分子机理之一。
综上所述,即使3种CNMs对斑马鱼在抗氧化酶等指标上的影响无显著差异,但是其影响代谢的机理却是不同的,其中,CNT主要通过诱导斑马鱼体内氨基酸代谢物的变化(如脯氨酸、赖氨酸和亮氨酸等)造成氧化损伤,而GO和GOQD主要影响的代谢物则为脂肪酸(如十八碳烯酸、棕榈酸和十九烷酸等)。
通过3种典型CNMs对斑马鱼幼鱼急性毒性的研究,对3种CNMs的毒性做出了排序,同时在环境相关浓度下测定了3种CNMs对斑马鱼成鱼的亚急性毒性,揭示了其对斑马鱼抗氧化酶系统影响的分子机理,为后续CNMs的毒性评估和生态风险评价提供了重要的数据资料。

