有机磷系阻燃剂的环境分布及其在红树林系统中的行为
陈忠洋,裴男才,孙冰,施招婉,史欣,王丹薇,李志宏,孙毓鑫,李永,李健容
1. 河南农业大学林学院,郑州450002 2. 中国林业科学研究院热带林业研究所,广州510520 3. 广东省龙眼洞林场,广州510520 4. 中国科学院南海海洋研究所,广州510301 5. 中国科学院华南植物园,中国科学院植物资源保护与可持续利用重点实验室,广州510650
阻燃剂(flame retardants, FRs)是一类能够阻止聚合物材料引燃或者抑制火焰传播的添加剂,按照组成成分分为有机阻燃剂和无机阻燃剂两大类。无机阻燃剂有氢氧化铝(aluminum trihydroxide, ATH)、氢氧化镁(magnesium hydroxide, MIH)和三氧化二锑(antimony trioxide, ATO)等;有机阻燃剂按组成元素分为有机氯系阻燃剂(organochlorine flame retardants, OCFRs)、有机溴系阻燃剂(organic bromine flame retardants, OBFRs)和有机磷系阻燃剂(organophosphorus flame retardants, OPFRs)等。随着工业化和城市化的快速发展,高分子材料被广泛应用,由此引发的火灾也给人们的生活和人身安全造成严重影响,阻燃剂的开发和应用受到人们关注。近年来,溴系阻燃剂因具有生物蓄积性、持久性和毒性在欧美等国被逐渐禁用,OPFRs凭借优良的阻燃性能及低毒、少烟和低卤等特性成为其替代品,被广泛应用于纺织、塑料、橡胶、电子产品制造和家具等行业,使用量飞速增长,生产量逐年增加。据报道,2012年全球OPFRs消费量为55万t,2018年全球OPFRs的消费量增加为105万t[1];其中,中国、北美和西欧是世界范围内消耗阻燃剂最多的国家和地区,约占全球消耗量的60%[2]。由于在生产和使用的过程中,OPFRs主要通过物理手段加入外源材料而非与材料存在化学键结合,加上大多数OPFRs具有半挥发性,使其极易通过挥发、磨损和浸出等方式进入环境,使其广泛分布在土壤、沉积物、水体和大气等多种环境介质中,残留量与日俱增,对生态环境和人体健康潜在危害巨大,受到广泛关注[3]。环境中常见的OPFRs名称与理化性质如表1所示。
目前,在红树林沉积物中普遍检出OPFRs,其对环境造成的影响已经成为研究热点。本文对OPFRs在红树林生态系统的环境介质(水和沉积物)中的污染现状及生态风险,以及不同红树植物对其的吸附作用进行初步分析与评述,尝试为红树林湿地生态系统的保护与进一步研究提供科学依据。
1 OPFRs在红树林中的污染特征(Pollution characteristics of OPFRs in mangroves)
湿地生态系统位于陆地生态系统与水生生态系统的交界地带,是介于陆地生态系统与水生生态系统间的过渡生态系统,被人们称为“地球之肾”、物种贮存库和气候调节器等[4]。因湿地生态系统独特的自然环境与地理位置,使其蕴育了丰富的自然资源;湿地生态系统具有多种生态功能,在保护生态环境、保持生物多样性以及发展经济社会中,具有不可替代的重要作用。目前,中国拥有湿地面积6 600多万hm2,约占世界湿地面积的10%,包括浅海滩涂、珊瑚礁、河口水域、三角洲和红树林等湿地生态系统,主要分布于我国沿海的11个省(市、区)和我国港澳台地区[5]。红树林(mangrove)是中国湿地生态系统的一种重要类型,存在于陆地与海洋交界的滩涂地带,是陆地向海洋过渡的特殊生态系统,具有重要的社会经济价值和生态服务功能[6]。红树林生长在热带与亚热带海岸潮间带,受周期性潮水浸淹,以红树植物为主体的木本生物群落;组成物种包括乔木、灌木红树与伴生植物[7]。目前,全世界的红树植物共有16科24属84种,分布于南北纬32°之间的海岸,大致分为印度洋及西太平洋海岸的东方群系和美洲西印度群岛及西非海岸的西方群系两大群系[8]。我国共有红树植物22科26属38种,其中,真红树植物13科15属27种,半红树植物9科11属11种;伴生植物19科23种,主要分布在中国的海南、广东、广西、台湾、福建、浙江及港澳地区[9]。红树林湿地功能一直受到高度重视,但由于沿海地区工业化和城市化的飞速发展,它们经常受到人类活动造成的复合化学污染。红树林沉积物以其独特的有机碳含量高、碎屑丰富等特性被认为是各种污染物的重要储存库。然而,目前关于有机磷系阻燃剂(OPFRs)在红树林湿地的分布情况研究甚少[10]。
1.1 OPFRs在沉积物中的分布
沉积物中OPFRs的浓度在不同地区差异较大(表2)[11-22]。近年来,随着有机磷阻燃剂用量的增长,沉积物中OPFRs的污染程度显著升高[12]。比如,在日本,固体废物海洋填埋场沉积物中也检测到较高浓度的OPFRs,OPFRs的浓度范围为4~10 900 ng·g-1dw[13];在西班牙境内的纳瓦拉河、加西利亚河和阿斯图里亚斯河,沉积物样品中检测出了总浓度为3.8~824 ng·g-1的OPFRs,主要成分包括磷酸三(2-氯异丙基)酯(TCPP)、磷酸-2-乙基己基二苯基酯(EHDPP)、磷酸三甲苯酯(TCrP)和磷酸三酯(TEHP),浓度分别为4.5365、15~63、6.7~84、2.8~290 ng·g-1[14]。在我国,近年来也开展了系列沉积物中OPFRs的调查研究:在台湾近海,沉积物中OPFRs的总浓度为1.0~13 ng·g-1dw,磷酸三(2-氯乙基)酯(TCEP)、磷酸三(1,3-二氯异丙基)酯(TDCP)、TCPP和磷酸三苯酯(TPhP)为主要组分[15];在江苏太湖,沉积物中OPFRs总浓度为3.4~14 ng·g-1dw,磷酸三正丁酯(TnBP)、TCEP、TCPP、TDCP、TPhP和磷酸三(丁氧基乙基)酯(TBEP)为主要成分[16-17];在广东东江,表层沉积物中OPFRs总浓度为1.5~86.2 ng·g-1dw,TCPP、TPhP、TCEP和TDCP为主要成分[18],OPFRs浓度远高于中国太湖和中国台湾近海沉积物中的OPFRs含量,低于日本固体废物处置场沉积物中OPFRs浓度;在我国珠三角地区,发现TCEP和TBEP是沉积物中的主要化合物[19]。
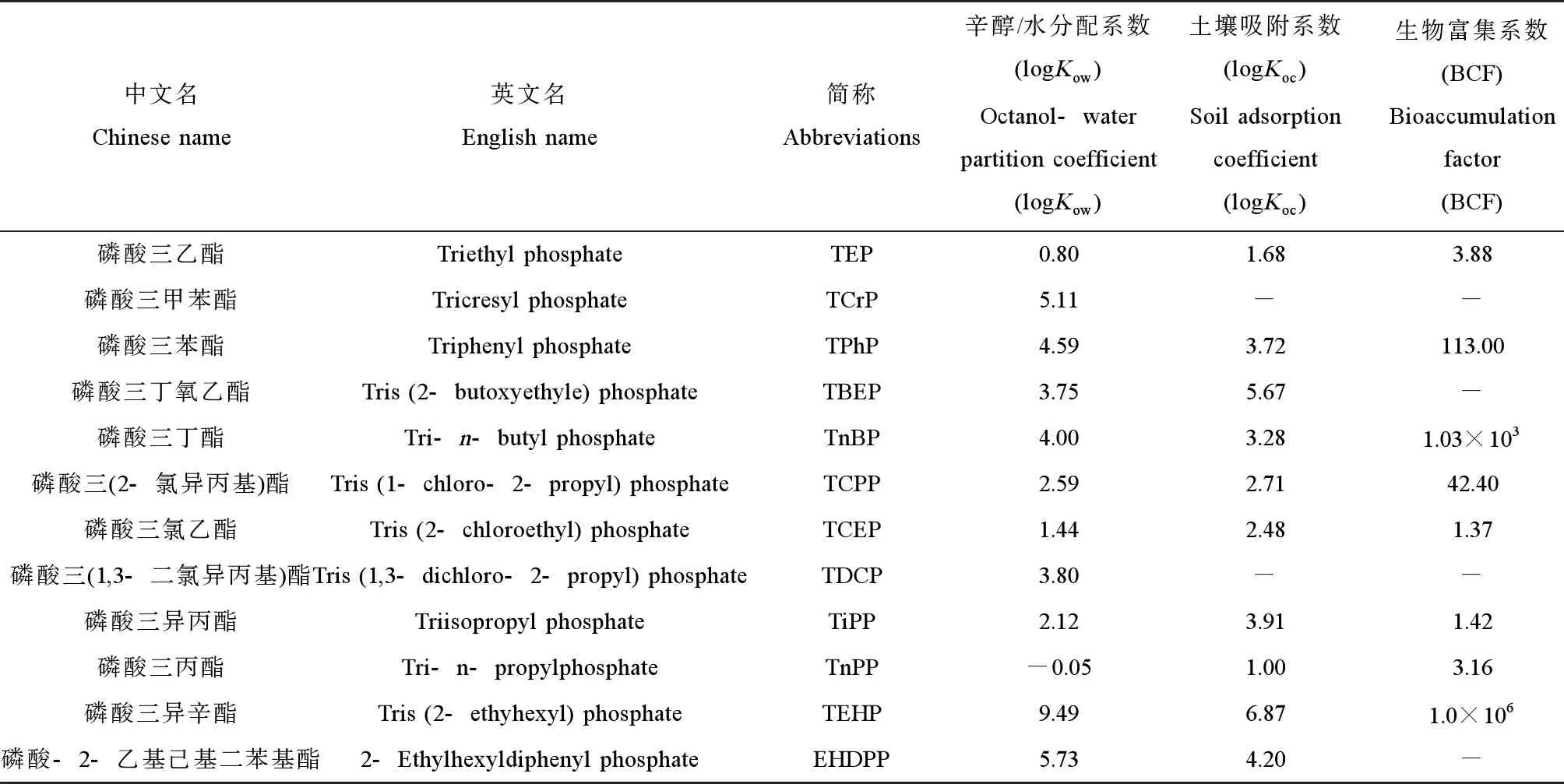
表1 环境介质中常见有机磷系阻燃剂(OPFRs)名称及理化性质Table 1 The names of common organophosphorus flame retardants (OPFRs) and physicochemical properties in environmental media
1.2 OPFRs在水体中的分布
水体是环境中覆盖面最广,对人类影响较大的一类环境介质,也是环境中OPFRs的重要聚集场所之一,其污染情况一直是人们关注的热点。近年来,国内外学者已经对部分国家和地区的天然水环境(河流、湖泊和地下水等)和人为水环境(污水和饮用水等)中OPFRs的残留状况进行了调查,Sheldon和Hites[23]从1976年8月到1977年3月,通过收集德拉韦尔河的水样并检测其中的OPFRs含量,首次发现水环境中存在有机磷阻燃剂,包括TBEP、磷酸三丁酯(TBP)和TPhP。此后随着OPFRs剂量的增加、检测方法的发展和检测限值的降低,OPFRs在水中越来越多被检出。目前,无论是在人工水环境(污水和饮用水等)还是自然水环境(河流、湖泊和地下水等)都能检测出OPFRs的存在,其中,浓度较高的有6种,分别是TCPP、TDCP、TCEP、TBEP、TPhP和TnBP[24],这需要政府、学界和民众更多的关注。
1.2.1 污水
现有研究普遍认为污水是地表水环境中OPFRs的主要来源,因此,污水处理过程中OPFRs的浓度状况引起了人们的高度关注[25]。在不同国家和地区,污水中OPFRs的组成各异[26-27],但污水中检出浓度较高的OPFRs均为TCPP、TBEP和TCEP[28]。Loos等[29]从欧洲90个污水处理厂(sewage treatment)采集的污水样品中检测出7种OPFRs,其中,TCPP、TBEP和TCEP的浓度分别为620、190和71 ng·L-1,与奥地利(580、130和74 ng·L-1)相似。梁钪等[30]调查了中国北京污水处理厂中OPFRs的含量,结果表明,污水处理厂入水、出水中都能检测出高浓度OPFRs,污水处理厂出水中的OPFRs总浓度在1 000 ng·L-1以上;TCEP在进水口和出水口分别为408 ng·L-1和179 ng·L-1,TBEP分别为254 ng·L-1和600 ng·L-1。与其他国家相比,OPFRs的浓度较高,TCPP的浓度较低,分别为431 ng·L-1和225 ng·L-1。此外,孙佳薇等[31]对中国苏州某污水处理厂的水样进行了检测,发现7种OPFRs,其中(1,3-二氯-2-丙基)磷酸三酯(TDCPP)的浓度最高,浓度为218 μg·L-1。不同国家和地区污水中OPFRs浓度如表3所示[27-28,32-33]。

表2 部分国家和地区沉积物中OFPRs的浓度Table 2 Concentration of OFPRs in sediments in selected countries and regions
1.2.2 饮用水
饮用水对人类健康影响巨大,饮用水中的OPFRs残留与污染状况也引起国内外学者的广泛关注。近年来,研究发现饮用水中OPFRs的浓度远远低于地表水和污水中OPFRs的浓度。在巴基斯坦,通过对工业区、农村和背景区域的饮用水OPFRs浓度检测,发现背景区域的OPFRs浓度范围为ND~0.08 ng·L-1,农村地区OPFRs浓度范围为ND~12.06 ng·L-1,工业区OPFRs浓度范围为ND~71.05 ng·L-1[34]。由于阻燃剂可能会从废水中渗出并与附近的饮用水混合,因而带来一定潜在健康风险。在韩国,通过对饮用水样品中OPFRs浓度检测,发现纯水、瓶装水和自来水中的OPFRs总浓度分别为101、104和34.9 ng·L-1[35]。在我国浙江杭州和衢州,对不同类型饮用水样品检测发现自来水OPFRs平均浓度为192 ng·L-1,显著高于纯净水平均浓度(59 ng·L-1)和瓶装水平均浓度(4.0 ng·L-1),且TBEP、TPP和TCPP是OPFRs的主要成分[36]。中国和美国饮用水中OPFRs浓度如表4所示[37-38]。
1.2.3 地表水
OPFRs在地表水(河流、湖泊、降雨、地表径流和生活污水等)普遍检出。由于TCEP和TCPP的辛醇/水分配系数(logKow)值较低,因而,在水体中经常检出,且为主要成分。研究发现英国的亚耳河表层水中OPFRs浓度最高,浓度范围是113~26 300 ng·L-1,主要成分为TCPP、TCEP和TDCP[14]。德国、奥地利、西班牙、意大利、美国和日本的地表水中,OPFRs的浓度范围是76~2 230 ng·L-1,主要成分为TBEP、TCPP、TCEP、TDCP和TnBP[39]。我国自来水中OPFRs浓度范围为123~338 ng·L-1,略高于美国的3.02~366 ng·L-1[40]。目前在多个国家的河流水中都检测出OPFRs[41],研究发现河流中OPFRs的浓度差异较小,其他地表水浓度差异较大。不同国家和地区地表水中OPFRs浓度如表5所示[33,41-45]。
1.2.4 海水
OPFRs主要通过河流的搬运作用进入到海水环境中,因而,海水中OPFRs浓度较高,目前已在海水中检出多种OPFRs。Bollmann等[44]在2012年对西地中海河口处海水检测发现海水中OPFRs浓度较高,其中,磷酸三异丁酯(TiBP)、TnBP和TCEP浓度均值分别为152、117和70.2 ng·L-1。此外对中国青岛、连云港、厦门附近的黄海、东海海域的海水样本研究发现,TCEP、TCPP、TDCPP和磷酸三(2,3-二溴丙基)酯(TDBPP)均被检出,且4种物质浓度的平均值分别为134.44、196.70、84.12和109.28 ng·L-1[45],表明海水样品中TCEP为最主要成分,浓度最高,其次是TDCPP和TDBPP,浓度较高。同时,研究表明,连云港是OPFRs污染最严重的区域,OPFRs的平均浓度为738.4 ng·L-1,高于厦门(227.7 ng·L-1)和青岛(129.5 ng·L-1)[46]。
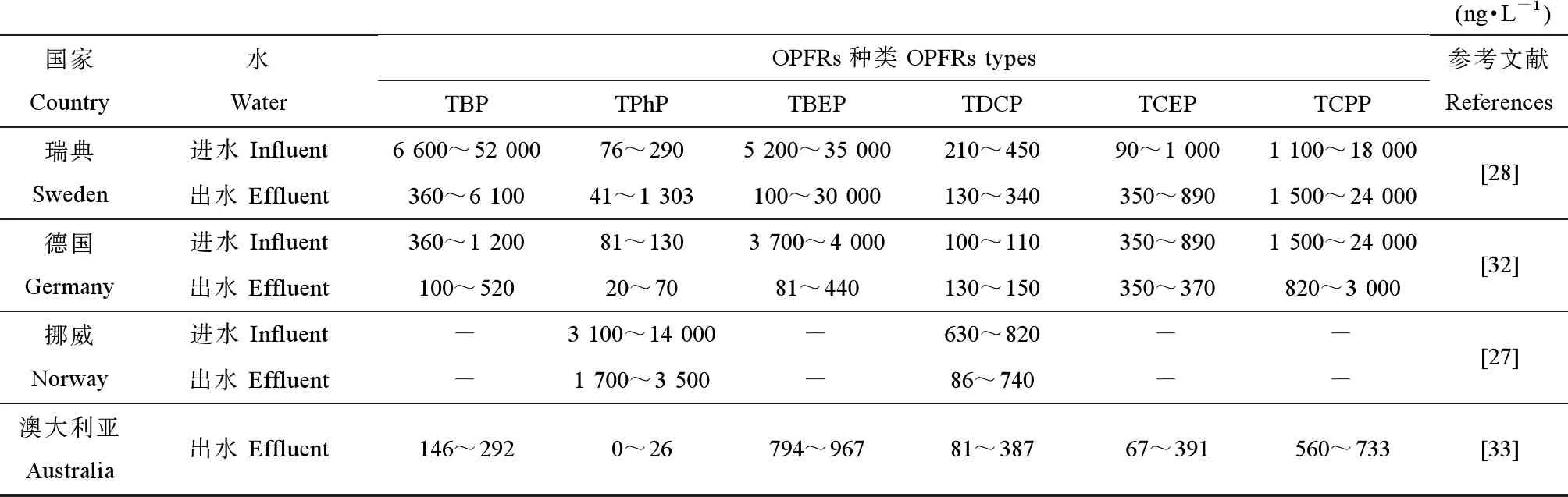
表3 不同国家污水处理厂进水和出水中OPFRs的浓度Table 3 OPFRs concentration in influent and effluent of sewage treatment in different countries
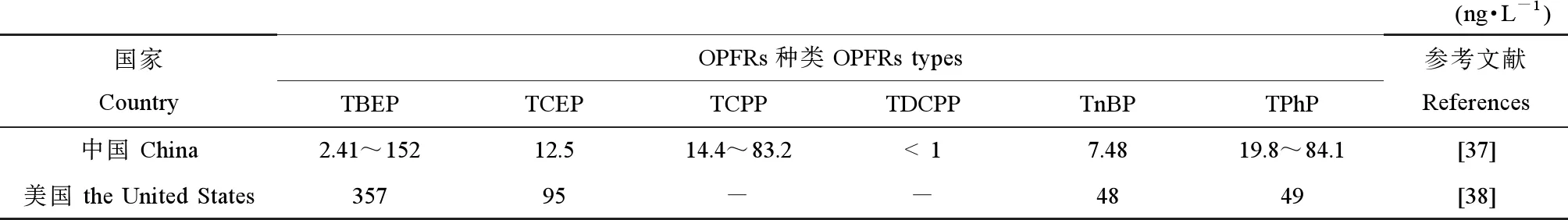
表4 中国和美国饮用水中OPFRs的浓度比较Table 4 OPFRs concentrations of drinking water in China and the United States
1.2.5 不同水体中OPFRs浓度
研究发现,水体中OPFRs主要成分为TCPP、TCEP、TDCP、TnBP、TPhP和TBEP,在不同水体中浓度差异较大,污水中OPFRs浓度最大,其中TBEP浓度最高,入水口浓度为35 000 ng·L-1;饮用水中OPFRs浓度最小,其中TCEP浓度最低,仅为485 ng·L-1;而地表水、地下水和海水中OPFRs浓度差别较小,水体中检出的OPFRs浓度极值如表6所示[22,39,44,46-48]。
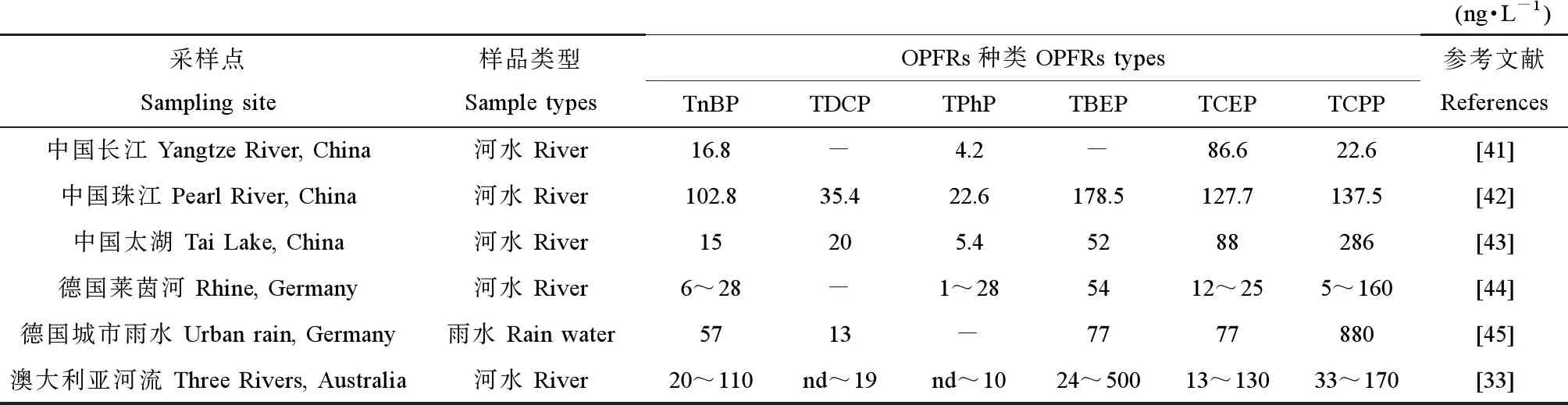
表5 不同国家和地区地表水中OPFRs的浓度Table 5 OPFRs concentrations of surface water in different countries and regions
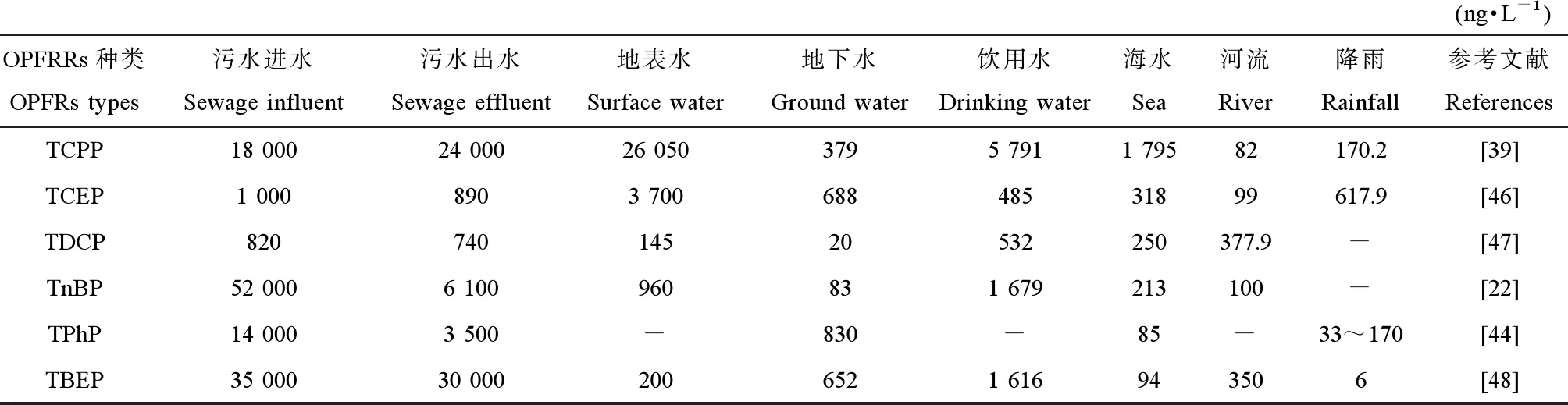
表6 不同水体中检出的OPFRs浓度Table 6 The concentrations of OPFRs detected in different water bodies
1.3 大湾区OPFRs污染现状
粤港澳大湾区是中国开放程度最高、经济活力最强的区域之一,是继纽约湾区、旧金山湾区和东京湾区之后的世界第四大湾区,包括中国的广州、深圳、珠海、佛山、中山、东莞、肇庆、江门、惠州9市和香港、澳门特别行政区,总面积约65 000 km2[49],总人口数超过7 000万。近年来随着人口总量的不断增加和城市化的飞速发展,粤港澳大湾区的湿地生态环境遭受严重损害。生长在亚热带及热带的海岸潮间带的红树林,是粤港澳大湾区湿地生态的重要组成部分,随着制造业的大力发展,化学品大量使用,OPFRs大量残留在环境中,并最终汇集到河口、海湾等区域,对红树林造成巨大破坏[50]。对华南珠江口红树林湿地中沉积物OPFRs检测发现珠海、深圳和广州3市红树林沉积物中OPFRs浓度分别是13.2~33.7、17.5~377.1和25.4~106.8 ng·g-1dw,深圳市和广州市OPFRs浓度明显高于珠海市,三地OPFRs的主要组分均是TCEP和TCPP[51]。
2 OPFRs的生物毒性效应与转化途径(Biological toxicity effects and transformation pathways of OPFRs)
2.1 OPFRs的生物毒性效应
OPFRs凭借着优良的阻燃和增塑特性,生产量和使用量飞速增加,由于OPFRs主要通过物理添加加入材料而并非与材料进行化学键结合,极易通过挥发、磨损和浸出等方式进入环境,导致OPFRs在环境中广泛存在。近年来,研究发现OPFRs不仅能够引起生物体的神经毒性、生殖与发育毒性、肝脏毒性、基因毒性与致突变性和内分泌干扰性,而且可以在不同介质中进行迁移转化,对生态环境和人体健康造成潜在危害。目前关于OPFRs的生物毒性效应研究如表7所示[37,52-57]。
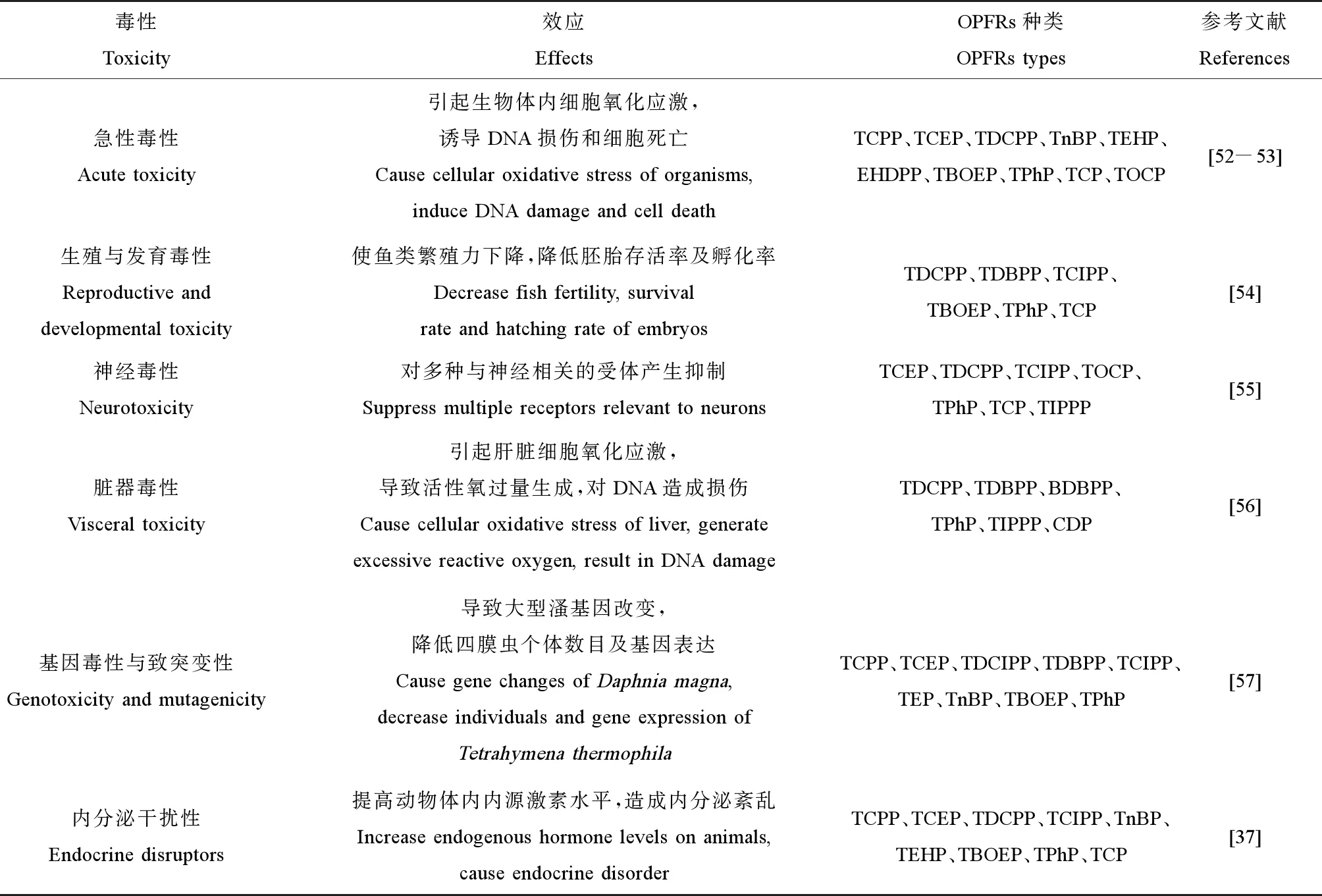
表7 OPFRs的生物毒性效应Table 7 A summary of OPFRs biological toxicity
2.2 有机磷阻燃剂在红树林环境中的转化途径
毒理学研究表明,多种OPFRs能在水体、空气和土壤等各种红树林环境介质中迁移,对生态环境和人体健康的潜在威胁较大;在环境中主要是通过物理转化、化学转化和生物转化3种途径去除。物理转化过程主要是沉淀等,化学转化过程主要是酸化水解和化学氧化等,而生物转化过程主要是微生物降解等[58]。目前针对物理转化和化学转化过程的研究较多,而生物转化过程的研究则较少。
OPFRs分子结构的不同、氧化剂的差异、阴阳离子的浓度和pH值的高低是影响其降解速率的主要因素[59]。在红树林环境中,主要有以下3个方面的转化方式。(1)光解作用。由于部分OPFRs侧链烷基缺乏发色团,没有吸收波峰的能力,不能直接光分解,因而使用H2O2、TiO2、过硫酸盐和腐殖酸等氧化剂在UV下对污染物进行降解[60]。OPFRs阻燃剂分子结构的不同,降解速率也不同,且降解速率表现出一定的规律[61],即烷烃的降解速率高于含氯烷烃,与水解时的规律相似。(2)水解作用。芳基类OPFRs稳定性差,容易降解;含氯烷烃类OPFRs稳定性高于芳基类OPFRs,降解较慢;烷基类OPFRs稳定性强,难以降解。分子量增大,OPFRs的logKow相应增大,但水溶解度和蒸汽压等会相应减小,即难溶于水也难挥发[62]。随着pH的升高,OPFRs的降解顺序为芳基类>含氯烷烃类>烷基类[63]。(3)微生物降解。芳基类OPFRs在好氧条件下能快速降解,如TCP在河水中5 d内就会被生物快速降解,TPhP在河流和沉积物中的半衰期为3~12 d[64]。烷基类OPFRs包括TnBP和TiBP能通过生物降解得到一定程度消除,而TEHP难以生物降解[65]。含氯类OPFRs(TCPP、TCEP和TDCP)在污水处理过程中不能被生物降解;非氯类OPFRs降解率在55%~89%之间[66]。
2.3 红树植物对OPFRs的吸收途径
红树林生态系统中普遍检测到OPFRs,其含量低于生物影响阈值最低值,不会对水生动物和红树植物产生明显毒性,但OFPRs难以降解且在环境中长期存在,对红树林生态系统和人体健康存在潜在威胁[67]。红树植物根系吸收OPFRs通过2种机制进行:对于疏水性较低的化合物,主要通过蒸腾作用吸收;对于疏水性更强的OPFRs,通过与红树植物根系中的蛋白质结合来吸收[68]。OPFRs可以从受污染的土壤和沉积物中转移到植物体内,并通过食物链进入人体,进而对人体健康造成潜在危害[69]。然而,OPFRs可与非特异性脂质转运蛋白结合,通过木质部和韧皮部运输到植物的地上部分,在红树植物中可食部位积累后被鸟类等动物取食,通过食物链作用可能会对人体健康产生负面反馈作用。对成年斑马鱼吸收转运OPFRs的过程研究发现,脂质在动物体OPFRs的积累中起关键作用,但蛋白质和脂质在植物吸收转运OPFRs过程中的具体作用不清楚[70]。
3 研究展望(Summary and prospects)
目前,国内外有关OPFRs的研究取得了较好的进展,但也存在许多不足或者研究深度不够,建议后续研究重点关注以下方面。
3.1 OPFRs的多元环境暴露与生物体转化研究
目前研究多集中于测量OPFRs在常规环境中暴露的含量及分布,对于OPFRs在更为多元的环境中尤其是在地下水、海水、沉积物和生物体等环境中的残留与污染等方面的数据报道较少,应加强对OPFRs在多元环境中的暴露研究。OPFRs可以在不同环境介质中迁移转化,且能通过食物链进入人体,对生态环境与人体健康造成影响[70]。然而,对其在环境中及生物体内转化机制研究较少,OPFRs在环境中或者生物体内的转化机制不明确,其物理降解、化学降解及微生物降解的条件、过程和机理鲜有研究,以后应加强关于OPFRs在环境中及生物体内转化机制研究。
3.2 OPFRs的环境效应与生态风险研究
OPFRs具备很好的阻燃效果,因而已经被广泛应用于各个行业,但它的大量使用造成了OPFRs在环境中的蓄积日益明显,对人类健康及生态环境造成巨大的潜在危害。已有研究表明,OPFRs能够对生物体产生神经毒性、生殖与发育毒性、肝脏毒性、基因毒性与致突变性和内分泌干扰性。然而,OPFRs对不同动植物及人体的具体影响不明确,导致的环境效应和生态风险不清晰,需对OPFRs的环境效应和生态风险进行更为详细的研究。
3.3 OPFRs的详细毒性数据与毒理分析研究
OPFRs可引起神经、生殖和基因等方面毒性,可致畸形、患癌等负面作用[45]。目前OPFRs在多数环境介质中尚未达到足以产生明显毒性效应的水平,但由于大多数OPFRs具有挥发性且极难在环境中降解以及较高的生物富集系数,表明OPFRs的危害应该引起人们的关注与重视。目前,关于OPFRs在不同环境介质中的毒性数据和效应已有一定研究,但其详细毒性数据和致毒机制研究不够完整,毒理分析不够完善。今后可结合OPFRs在多介质环境的迁移转化深入研究,进而寻找高效、快速、无害方法去除环境中OPFRs污染。

