基于显微图像识别的微流控液滴聚并研究
张皓,王凯
(清华大学化学工程系,化学工程联合国家重点实验室,北京100084)
引 言
微化工系统是化工学科的前沿方向,具有设备比表面积大、体系传递速率高、过程可控性强、系统本质安全等特点,不断在化学、生物、能源、材料等交叉领域受到关注[1-5]。微流控技术是微化工系统的重要组成部分,它以精密加工制造的微通道芯片为平台,实现液滴、气泡的生成、破碎、聚并等精密流动控制[6-8],具有物料消耗少、响应速度快、分散尺寸均一度高等优势,在化学合成、材料制备和生物检测等方向具有重要应用价值[9-12]。在化学工程领域,微流控技术可以精确控制液滴的大小、形状、运动速度和运动方式,为研究复杂乳液制备、化学反应和分离强化等提供了基础研究平台[13-15]。
微流控过程本质上是在微小空间内实施的多相流过程,其理论核心为微尺度下多相流动基本规律。由于微流控设备体积小,主要采用的研究方法为显微摄像,即将微通道负载于显微镜平台上,通过高速相机记录液滴的生产和运动过程[16-20]。这一方法直接且高效,能够清楚地记录液滴的运动过程。得益于此,近年来大量微流控实验结果获得了快速报道[8,21-22]。虽然显微摄像技术提供了良好的观察方法,但是对于显微摄像的深入分析还有待开展。当前研究者主要从实验录像中提取流型、液滴直径等少量数据,对录像中蕴藏的大量的细节信息还缺乏深入的挖掘,人工处理数据的方式也烦琐费时。
显微摄像本身是将实验现象转化成数字信息存储于计算机中的方法,采用图像识别技术可以进一步从显微录像中提取出关键数据。目前MATLAB 等运算软件已经具备丰富的函数库,可以对复杂图像进行简化与解析,帮助研究者捕捉实验参数。遗憾的是,在微流控领域,显微图像识别和分析方面的研究却少有报道。2013 年,Wei 等[23]报道了一种通过图像处理来获取微通道内液滴直径的方法,他们利用MATLAB 实现了微纳滤波、图像腐蚀、边缘检测和体积计算等步骤,再将显微录像进行处理后计算出了液滴直径。同年Basu[24]报道了通过图像处理获得液滴形态和速度(droplet morphometry and velocimetry, DMV)的方法,为微流控图像处理技术的运用奠定了基础。该方法提出了背景识别、轮廓识别、液滴填充等针对微流控图像的处理流程,对液滴的分散、切割和蜿蜒流动等过程进行了研究,取得了丰富的实验数据。随后本课题组[25]也开发了一种快速识别同轴微通道内气液界面位置的图像处理技术,快速获取了液滴分散过程中周期性压力变化。
鉴于显微图像识别技术在微流控领域的重要研究价值,本文工作尝试使用图像识别方法对微通道内液滴聚并过程[26-27]开展实验研究。与针对微通道内液滴运动过程的图像识别方法不同,聚并实验涉及液滴接触状态判定和液滴聚并时间分析等新挑战,因此本文开发了局部背景处理、选区二值化、图像干扰去除、液滴接触状态识别等面向微流控聚并的图像处理方法。根据图像处理结果计算了微通道内液滴聚并前后的运动速度,收集了液膜排空时间等关键参数,分析了微通道内流动条件和固体杂质对于聚并过程的影响规律。
1 实验部分
1.1 实验装置和体系
实验微通道如图1(a)所示。该装置使用精密机械加工方法在聚甲基丙烯酸甲酯(PMMA)表面刻制微通道,再通过75°C、0.4 MPa 的热压设备(泰科盛热压机)与空白PMMA 面板封装而成。通道总长40 mm,分为上下游两段,其宽度w和深度h的数值如图1 所示。上游通道含有两个T 型分支,其中第一个分支用于形成直径均一的柱状液滴,第二个分支用于补加连续相流体,微调液滴间距。Qc1和Qc2表示两股连续相流体的流量,Qd表示分散相流体的流量。为了在液滴碰撞实验中获得几何结构更为简单的球形液滴,上游通道深度设置为下游通道的1/2,下游通道的宽度和深度相等,此时液滴进入下游通道后自动由柱状液滴转变成为球形液滴。下游通道含有一个六边形扩大通道,实施液滴的碰撞,其平面结构如图1(b)所示。

图1 微通道实验装置Fig.1 Schematic diagram of microchannel equipment
连续相为正辛醇(北京现代东方精细化学品有限公司),分散相为去离子水。实验前两相流体已互相饱和,因此实验中无化学组分的溶解扩散。在部分连续相中加入平均直径约30 nm 的疏水性SiO2颗粒(硅烷偶联剂改性,北京纳辰科技),模拟体系中固体杂质对于微流控聚并过程的影响[28]。实验中纳米颗粒悬浊液能够稳定存在1 h 以上,颗粒的质量分数分别为0.05%和0.1%。实验中没有观察到微通道进出口存在颗粒团聚沉积的现象,连续相溶液保持澄清透明。体系物性如表1 所示,其中流体黏度通过乌氏黏度计(Brookfield DV-II+P)测量,密度通过称量固定体积的液体质量(梅特勒天平)计算而得,界面张力通过界面张力和接触角测量仪(OCAH200,DataPhysics Instruments GmbH)测量,纳米颗粒照片通过透射电镜(日本电子,JEM-2010)获得。实验流量由微量注射泵(兰格,LSP02-1B)控制。微流动过程使用配有CMOS 相机(PL-B742U,PixeLINK)的显微镜(上海光学仪器六厂)记录,拍摄速率为92帧/秒。录像图片尺寸为512×384像素,对应标尺为105 像素/毫米,像素识别误差约9.5 μm。图像处理用的计算机型号为 HP-ASUS ZX50JX4720,操作系统选择windows 8.1 Enterprise,所用软件为MATLAB R2015b。

表1 实验体系物性(27°C)Table 1 Physical properties of working systems(27°C)
1.2 典型实验现象
实验研究了扩大段通道处液滴的运动规律,主要观察到两种实验现象:一种是两个液滴在扩大通道内相互接触,发生聚并,如图2(a)所示;另一种是液滴在微通道内未发生相互接触,仅顺序通过通道扩大段,如图2(b)所示。发生聚并的过程是前一个液滴(A)流入扩大通道后,随着流道变宽逐渐降低流速,随后与后续液滴(B)发生碰撞,引发聚并,形成大液滴(C)。由于本实验的液滴直径基本相同,因此液滴能否发生聚并主要取决于液滴的间距和运动速度。当使用含有SiO2纳米颗粒的溶液作为连续相时,典型的聚并过程如图2(c)所示,因为实验使用的纳米颗粒浓度很低,所以微通道内溶液的透明性变化不大,因此针对其聚并过程仍然可以使用图像处理方法开展研究。SiO2纳米颗粒的照片如图2(d)所示。
2 图像处理部分
2.1 图像背景的提取

图2 液滴聚并与不接触现象Fig.2 Phenomena of droplet coalescence and out of touch

图3 背景图像获取过程Fig.3 Background image acquisition process
对微流控过程进行图像分析的主要目的是解析液滴的运动过程,为了排除干扰首先需要将作为背景的微通道图像移除。在没有进行实验的情况下单独拍摄微通道可以获得背景图像,但通过这种方法获得的背景图像往往因为与其他实验过程中光线强度或光照角度存在差异,难以多次利用。因此,本文工作采用通过MATLAB 的众数(mode)函数获取视频背景的方法。如图3 所示,一段录像转入MATLAB后首先形成512×384×3×700(长×宽×颜色×帧数)的矩阵数据,对该图像在帧数维度上求众数可以获得每一个像素点上700帧数据中出现频次最多的颜色数值。由于微液滴不断从背景图像上流过,对于任一个像素点来说液滴轮廓占据的帧数很少,因此在众数函数运算中将被排除,此时获得的运算结果理论上即为背景图像。针对实验录像求众数后的结果如图3(b)所示,可见该方法面向液滴聚并实验,还需要进一步调整。在聚并实验中,液滴可以长时间停留在通道扩大段内,因此单纯众数函数并未取得理想结果,通道中心处形成不合理区域。为了消除这一区域,进一步将得到的彩色背景图像转化为灰度图像(利用rgb2gray 函数将512×384×3 矩阵降维成512×384 矩阵),再查看该图片的灰度直方图[图3(b)插图],可以发现背景的灰度分布范围很窄。基于这一特征,采用掩膜处理的方法(roipoly 函数),即用背景中最普遍的灰度值(范围95~109)随机替代(round 函数)背景中扩大段通道中心区域的灰度值,结果如图3(c)所示,获得了理想的背景图片。
2.2 显微图像的二值化

图4 显微图像的数字化过程Fig.4 Digitization process of microscopic images
在获得背景图像后,将原图像降维成灰度图像,然后与背景图像相减,即可获取仅含液滴的图像。由于微通道中连续相和分散相对光的折射率不同,因而当从原始图像中减去背景时偶尔发生出现负值的情况。为了避免负值的出现,借鉴Basu[24]的方法,首先对原始图像和背景分别求反(imcomplement 函数),再使用绝对减法(imabsdiff 函数)扣除背景,其结果如图4(b)所示。背景去除后的图像数据为512×384×700(长×宽×帧数)矩阵,每一个数据单元储存了对应像素点上的灰度值(0~255)。为了进一步简化计算,将图像进行二值化处理,即将灰度数据转化为仅含0(黑)和1(白)的二进制数据。这一过程利用阈值函数(graythresh)实现,它可以将灰度大于设定阈值的点设置为1,小于阈值的点设定为0。但是,在实践过程中发现使用单一阈值存在缺陷,这主要是因为通道中心处液滴轮廓较浅,对全幅照片采用单一阈值容易造成液滴轮廓变形。为此,提出选区二值化的方法,即将通道中心处和通道外围分成两个区域,分别设置不同的阈值。鉴于目前算法的成熟程度,本文实验所选取的阈值需要通过实验人员的观察判断。以最接近人眼可识别的液滴外轮廓为原则,将微通道内部阈值设定为21,之外区域的阈值设置为9,其结果如图4(c)所示。由于其他实验与图4 所示实验在几乎相同的拍摄条件下完成,因此这两个阈值在处理其他显微图像时不再改变。掩膜二值化后图像中残存的噪声点可以通过MATLAB 中的高斯滤波器消除,如图4(d)所示。经过以上步骤,液滴边缘已经可以被程序准确读取,随后使用填充函数(imfill)将液滴内部的空间转化为纯色,再通过形态开启(imopen函数)去除细小的毛刺,即可得到图4(e)所示的便于轮廓计算的液滴二值化图像。
2.3 图像干扰去除
在后续识别液滴轮廓时,处于图像边缘的不完整液滴往往会干扰计算,为此使用Imclearborder 函数进一步移除和图像边界接触的物体,其结果如图5(a)~(c)所示。此外,偶然情况下图像中也会出现一些面积较大的干扰(主要来源于图像处理过程中的计算误差累积),仅使用形态开启操作不能将其移除。因此,在图像处理的最后一步加入一个大干扰滤除的步骤(bwareaopen 函数),将面积小于液滴面积的区域直接设置为背景,其结果显示在图5(e)~(f)中。
3 液滴聚并规律分析
3.1 液滴接触状态判定
经过上述背景提取、背景去除、掩膜二值化、噪声消除、区域填充、形态开启、边界物体移除、大干扰滤除等操作以后,可进一步通过MATLAB 软件IPT 工具箱(regionprops 函数)读取每个液滴的几何参数。该参数包括投影面积、质心坐标、偏心率、宽高比等。在微流控聚并过程中,液滴首先相互接触,再挤压变形,然后发生聚并,可见液滴接触的时刻是聚并起始的关键时刻。基于液滴相互接触时的几何关系和相互接触液滴的二值化图像,本文提出以下液滴发生接触的判定方案:在下一帧中找不到两个独立的小液滴但在相同位置找到一个“大液滴”[当两个液滴之间“搭桥”后,MATLAB 程序自动判定为一个液滴,如图6(a)、(b)所示],大液滴面积与两个小液滴面积之和的相对偏差<0.5%且大液滴质心位置与小液滴质心中点位置的偏差小于等于1个像素点,即判定液滴发生相互接触。与肉眼识别的液滴接触时刻相比,本研究提出的接触判据在图像处理执行中误差不超过1 帧(0.011 s)。液滴聚并过程中,另一个重要时刻就是聚并发生的时刻。在判定液滴是否发生聚并方面,本文工作使用液滴的偏心率作为判据。液滴的偏心率定义为椭圆形液滴的焦距与椭圆长轴的比,它的数值越接近0,说明物体越接近圆形。当液滴发生聚并时,两个液滴几乎是一瞬间融合,因此在图像识别结果中,“大液滴”的偏心率会发生突变[图6(b)、(c),图6(c)的前一帧内中心液滴的偏心率为0.888,而图6(c)的中心液滴偏心率仅为0.265],据此程序判断液滴发生了聚并。

图5 干扰滤除过程Fig.5 Interference filtering processes

图6 微液滴状态判据说明Fig.6 Explanation of microdroplet states
3.2 液滴运动速度分析
液滴的运动速度对于微流控聚并过程十分重要,其大小与液滴所处的微通道环境密切相关。对于本文所研究的扩大微通道,随着其截面的变化液滴的运动速度也发生变化。通过液滴质心的坐标和跨帧时间可以计算出任意时刻液滴的运动速度udrop。首先分析了图2(b)所示的液滴不接触过程,将两次实验的结果绘制于同一张图上,结果如图7(a)所示。在液滴逐渐进入扩大通道的过程中,其初速度比较稳定。在距离视频边缘1.33 mm 处开始进入到扩大通道,随后液滴运动速度逐渐下降,在扩大通道中心(x=1.96 mm)处达到最低值。之后液滴再次加速,于2.63 mm 位置处进入下游通道。从图7(a)的速度图线可以看出,下游通道虽然与上游通道呈现对称结构,但是当液滴从扩大通道再次进入常规通道时速度略微降低且发生了小范围的波动,这主要是因为通道入口段内流动未达到完全稳定。对比图7(a)中最高速度(0.92 mm/s)和最低速度(0.36 mm/s),其比值为2.56,与扩大通道宽度和上下游通道宽度的比2.5 基本一致。可见在流量一定的情况下,液滴的运动速度主要取决于流道的截面积。从图7(a)中也可以看出液滴运动的加速和减速阶段基本上随液滴的位置呈现线性变化,其主要原因也在于六边形的结构设计。由于液滴进入扩大通道存在快速的减速过程,因此两个存在一定间距的液滴在扩大通道内就会发生接触,进而引发聚并。
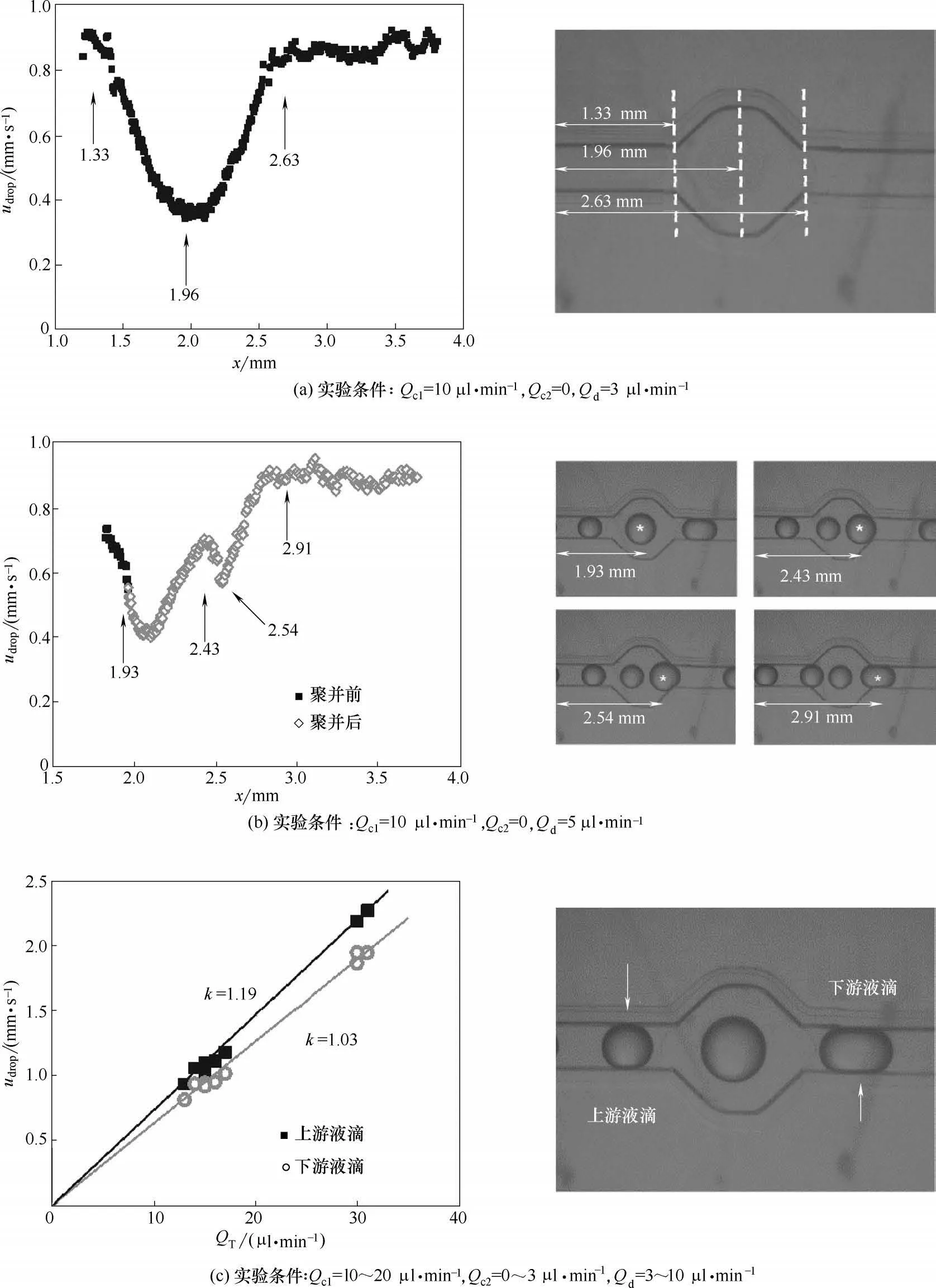
图7 液滴运动速度分析Fig.7 Analysis of droplet moving speed
进一步分析图2(a)所示的液滴聚并过程,将两次实验的结果绘制与同一张图上,结果如图7(b)所示。可以看出聚并发生前(x= 1.93 mm 前)液滴的运动轨迹与图7(a)基本相同,但液滴发生聚并后其速度曲线发生了明显变化。由于聚并发生在扩大通道的前部,因此两个液滴在完成聚并后,形成的新液滴速度进一步下降,当通过扩大通道的中心点后速度再次上升。液滴接触扩大通道壁面时(x=2.43 mm),由于空间位阻的作用产生形变,其质心运动速度下降,因此在位于视频左侧边缘2.54 mm 处产生了第二个速度的极小值。发生形变后的液滴在上游流体的挤压作用下最终进入下游通道,其运动速度也恢复至最高值。可见,当有聚并发生时,扩大通道内的液滴运动十分复杂,对于微流控聚并来讲,认识微通道内速度的变化规律对于控制聚并液滴的数量和聚并后液滴的输送具有价值。据此结果,本文关注了扩大通道两侧微通道内的液滴运动速度,如图7(c)所示。由于微通道中液滴处于中心位置,因此其运动速度一般高于两相的平均速度uav=QT/wh2(QT=Qc1+Qc2+Qd)[29]。图7(c)中k值给出了液滴速度udrop与平均速度uav的比值(k=udrop/uav),可以看出上游通道中液滴直径小,液滴与通道间相对静止的连续相流体多,因而其运动速度更快,是平均速度的1.19倍。

表2 液膜排空时间分析结果Table 2 Analysis results of liquid film drainage time
3.3 液膜排空时间分析
最后,尝试利用图像处理程序获取液滴聚并过程中的液膜排空时间。经典的液滴聚并理论认为,聚并过程的决速步是排空两液滴界面之间所夹持的连续相液膜的过程,液膜排出速度快,则聚并时间短,因此液膜排空时间是认识聚并动力学的特征参数。液滴相互接触时刻和液滴聚并时刻构成的区间即为液膜的排空时间。对于具有不同纳米颗粒含量的微流控液滴聚并过程,表2 记录了典型的实验结果。可以看出,在液滴直径差别较少的情况下,液膜排空时间在0.1 s 量级,流量对于排水时间的影响较少,虽然高流量下液滴运动加快,但其接触位置也相对提前,因此整体表现出液膜排空时间受流量影响较小。当体系颗粒含量较低时(0.05%),疏水SiO2颗粒的存在对于聚并时间影响不明显;但是当颗粒含量达到0.1%时,液膜排空时间明显延长,此时位于液液界面之间的颗粒由于空间效应阻碍了液膜排出过程[30]。并且从表2 所示的液膜排空时间范围来看(数据90%置信区间),加入纳米颗粒后液滴聚并时间范围也明显拓宽,说明聚并过程变得更难以控制。实验中也观察到,进一步提高纳米颗粒含量会导致液滴接触但不发生聚并的出现,液滴发生聚并的概率也随着颗粒含量的提高而下降。
4 结 论
介绍了一种基于显微图像分析研究扩大微通道内液滴聚并现象的方法。该方法针对微流控聚并过程中液滴的运动特征,发展了包含背景识别、背景去除、选区掩膜二值化、噪声消除、液滴填充、形态开启、干扰排除等图像处理方法。通过图像识别取得了液滴投影面积、质心坐标、偏心率等几何参数,发展液滴接触和发生聚并的图像识别判据。基于图像识别结果研究了液滴运动速度变化规律,发现扩大通道的截面积是决定液滴运动速度的主要因素,可以使用扩大通道与上下游通道的截面积比例估计液滴运动速度的变化比例。当通道中有聚并发生时,由于直径的增大,液滴运动速度呈现双极值的现象,该现象的揭示有助于聚并微通道结构的设计和液滴输送条件的选择。进一步通过图像识别方法获取了聚并过程中液膜排空时间的变化规律,发现液膜排空时间在0.1 s 量级且流量对于液膜排空时间影响较少,连续相中固体颗粒含量达到0.1%时,液膜排空时间明显延长。

