依达拉奉联合缺血后处理对大鼠脑缺血再灌注损伤的影响
王颖 周红群 殷梅 缪薇 朱榆红
[摘要] 目的 探討依达拉奉(Eda)与缺血后处理(IP)联合使用后对脑缺血再灌注损伤(I/R)的影响,并与单独应用IP比较,评价Eda联合IP是否能对I/R产生叠加保护作用。 方法 选择SD大鼠36只,根据随机数字表法将其分为对照组(I/R组)、IP组、IP+Eda组,每组12只。I/R组采用线栓法建立大鼠I/R模型,IP组采用线栓法建立大鼠I/R模型的同时给予IP干预,IP+Eda组采用线栓法建立大鼠I/R模型的同时给予Eda和IP干预。术后48 h对大鼠进行神经功能缺损评分、脑梗死体积测定;采用荧光定量PCR、Western blot、免疫组化法检测大鼠脑组织中血管紧张素Ⅱ1型和2型受体(AT1、AT2)的表达;检测各组大鼠超氧化物歧化酶(SOD)抑制率。 结果 与I/R组比较,IP+Eda组和IP组神经功能缺损评分降低,大鼠脑梗死体积缩小,AT1、AT2的mRNA和蛋白相对表达量降低,AT1、AT2阳性细胞数减少,SOD抑制率升高,差异有统计学意义(P < 0.01或P < 0.05)。IP+Eda组与IP组比较,上述指标差异均无统计学意义(P > 0.05)。 结论 IP+Eda组能对大鼠I/R产生保护作用,但两者联合后并不会产生叠加的保护效应。
[关键词] 脑缺血/再灌注损伤;依达拉奉;缺血后处理;血管紧张素Ⅱ1型受体;血管紧张素Ⅱ2型受体
[中图分类号] R54 [文献标识码] A [文章编号] 1673-7210(2020)02(b)-0013-05
Effect of Edaravone combined with ischemic postconditioning on cerebral ischemia-reperfusion injury in rats
WANG Ying ZHOU Hongqun YIN Mei MIAO Wei ZHU Yuhong
Department of Neurology, the Second Affiliated Hospital of Kunming Medical University, Yunnan Province, Kunming 650031, China
[Abstract] Objective To investigate the effect of Edaravone (Eda) combined with ischemic postconditioning (IP) on cerebral ischemia-reperfusion injury (I/R), and to evaluate whether Eda combined with IP have superimpose protective effects on I/R compared with IP alone. Methods Thirty-six SD rats were selected and divided into the control group (I/R group), IP group and IP+Eda group according to the random number table method, with 12 rats in each group. The rat I/R model was established in the I/R group by suture method. The rat I/R model was established by suture method in the IP group with IP intervention. The rat I/R model was established by suture method in the IP+Eda group with Eda and IP intervention. At 48 h after the operation, the rats were evaluated for neurological deficits and the volume of cerebral infarction was measured. By fluorescence quantitative PCR, Western blot and immunohistochemical method the expression of tissue angiotensin Ⅱ with type 1 and type 2 receptor (AT1, AT2) in the rat brain tissue was detected. The inhibition rate of superoxide dismutase (SOD) of rats in each group was detected. Results Compared with I/R group, IP+Eda group and IP group showed a decrease in neurological deficit score, a decrease in cerebral infarction volume, a decrease in mRNA and protein expression of AT1 and AT2, a decrease in the number of AT1 and AT2 positive cells, and an increase in SOD inhibition rate, with statistically significant differences (P < 0.01 or P < 0.05). There was no significant difference in the above indicators between the IP+Eda group and the IP group (P > 0.05). Conclusion The IP+Eda group can protect rat I/R, but the combination of the two groups does not produce a superimposed protective effect.
[Key words] Cerebral ischemia-reperfusion injury; Edaravone; Ischemic postconditioning; Angiotensin Ⅱ type 1 receptor; Angiotensin Ⅱ type 2 receptor
脑缺血/再灌注损伤是一个包括兴奋性氨基酸毒性、自由基及脂质过氧化、线粒体功能障碍、钙离子超载、炎症、细胞凋亡等在内的多环节病理级联反应[1-3]。缺血后处理,即组织器官缺血后,在较长时间的再灌注之前进行反复、短暂的再灌注/缺血处理,使长期缺血的组织器官在恢复血流后即刻被充血这一过程受到干扰,进而有效调动机体内源性保护机制以减轻脑缺血再灌注损伤的一种处理措施[4-6]。然而,已有文献报道[7],一旦脑缺血再灌注损伤的级联损伤反应启动,缺血后处理的脑保护作用一方面无法同时对抗诸多的病理因素,另一方面还会使自身的神经保护作用受到限制。基于此,本研究考虑在缺血后处理的基础上,联合一种外源性神经保护制剂,以求达到更好的脑保护效应。依达拉奉是临床常用的一种自由基清除剂,通过静脉给药可以快速到达脑和脊髓内,清除具有细胞毒性的自由基团,是一种外源性保护机制,具有良好的脑保护作用[8-11]。本研究旨在联合依达拉奉和缺血后处理两种内、外源性保护措施,共同对抗脑缺血再灌注损伤,观察及评价两者联合后能不能协同作用,较单独使用缺血后处理发挥更有效的神经保护作用并探讨其相关机制,为临床联合使用神经保护方法对抗脑缺血再灌注损伤提供必要的理论及实验依据。
1 材料与方法
1.1实验动物和分组
健康雄性SD大鼠36只,SPF级,质量260~280 g。由北京维通利华实验动物技术有限公司提供[合格证号:SYXK(京)2017-0033]。将大鼠按照随机数字表法分为对照组(I/R组)、缺血后处理组(IP组)、依达拉奉联合缺血后处理组(Eda+IP组),每组12只大鼠。本研究通过昆明医科大学第二附属医院动物实验伦理委员会批准。
1.2 实验动物处理方法
1.2.1 大鼠大脑中动脉栓塞模型的建立 给大鼠气管插管,呼吸机(瑞沃德)辅助呼吸,1%~2%恩氟烷混合70%N2O及30%O2吸入麻醉。从颈外动脉将直径0.26 mm线栓插入18~20 mm,至大鼠大脑中动脉起始处。2 h后拔出线栓,实现再灌注。48 h后按照Belayev的12评分法对大鼠进行神经功能缺损评分[12]。
1.2.2 缺血后处理 IP组和IP+Eda组大鼠在拔除线栓后,即刻用微型动脉夹夹闭双侧颈总动脉阻断血流10 s,开放动脉夹恢复血流10 s,即为1次缺血后处理操作。之后采用相同方式,一共进行5个循环缺血后处理操作。
1.2.3 缺血后处理后的给药 IP+Eda组大鼠于缺血后处理后即刻、12 h、24 h分3次按5 mg/kg经腹腔注射依达拉奉(吉林省博大制药有限责任公司,生产批号:02-1800082)。其他组大鼠于相同时间点腹腔内注射1 mL 0.9%生理盐水。
1.3 脑梗死体积的测量
大鼠于再灌注48 h后,将鼠脑置于脑切片模具中切片,后置于2,3,5-氯化三苯基四氮唑(TTC)染液中10 min,用Image-Pro Analysis Software 6.0图像分析系统计算脑梗死体积。
1.4 荧光定量PCR分析
大鼠再灌注48 h后取出梗死区脑组织,加入1 mL Trizol提取总RNA。依据Revert Aid First Strand cDNA Synthesis Kit(Thermo Scientific,K1621)操作说明合成cDNA,在聚合酶作用下进行扩增。根据大鼠血管紧张素Ⅱ1型受体(AT1)和血管紧张素Ⅱ2型受体(AT2)目的基因的mRNA序列,应用beacon designer 7.90设计Q-PCR引物,引物序列为,AT1 上引物:5′-AATGACAATCACCACCAA-3′下引物:3′-GCAGG-CACAGTTACATAT-5′;AT2 上引物:5′-AATGATG-AATGCCAACAC-3′,下引物:3′-TCTGCTGAAGACC-AATAG-5′;β-actin上引物:5′-GTGTTGGCATAGAGGTCTT-3′下引物:3′-TATGGAATCCTGTGGCATC-5′。擴增条件如下:95℃ 10 min,然后以95℃ 15 s、60℃ 60 s为1个循环,共进行40个循环。最后依据Maxima?誖RSYBR Green/ROX qPCR Master Mix(2X)试剂盒(Kapa,KK4601)操作说明进行荧光定量PCR检测。
1.5 Western blot检测
大鼠再灌注48 h后取梗死区脑组织,将其剪碎并在冰上充分研磨,加入RIPA裂解液冰浴30 min,离心半径8 cm,4℃,以12 000 r/min离心5 min,取上清液,按常规方法依次进行蛋白浓度测定、电泳分离蛋白、转膜,封闭,加入1∶800 AT1(Abcam,ab18801),1∶1000 AT2(Abcam,ab92445),1∶1000 β-actin(北京中杉金桥生物技术有限公司,TA-09)4℃孵育过夜。第2天加入二抗室温孵育1 h后显影,Bio-Rad膜成像系统进行半定量分析。
1.6 免疫组织化学检测
大鼠再灌注48 h后,4%多聚甲醛[溶于0.1 mol/L磷酸盐缓冲液(PBS),pH=7.4]灌注大鼠后取脑,固定于4%多聚甲醛PBS溶液48 h。随后用石蜡包埋、切片,SP法进行免疫组化染色。AT1和AT2一抗浓度均为1∶200,阴性对照用PBS代替。AT1和AT2阳性细胞呈棕褐色。在大鼠缺血侧大脑半球梗死灶周围,光镜下(20×)选取连续3个视野,计数阳性细胞数,计算平均值。
1.7 超氧化物歧化酶(SOD)抑制率检测
大鼠再灌注48 h后取梗死区脑组织,按组织重量以1∶9比例加入9倍生理盐水,剪碎组织,冰浴匀浆,离心半径8 cm,以3000 r/min离心10 min,取上清液,测定蛋白浓度。按SOD测定试剂盒(南京建成生物工程研究所,A001-3)检测并计算样本SOD的抑制率。
1.8 统计学方法
采用SPSS 18.0统计学软件对所得数据进行分析,计量资料采用均数±标准差(x±s)表示,进行正态性检验和方差齐性检验,若满足正态性分布且方差齐,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
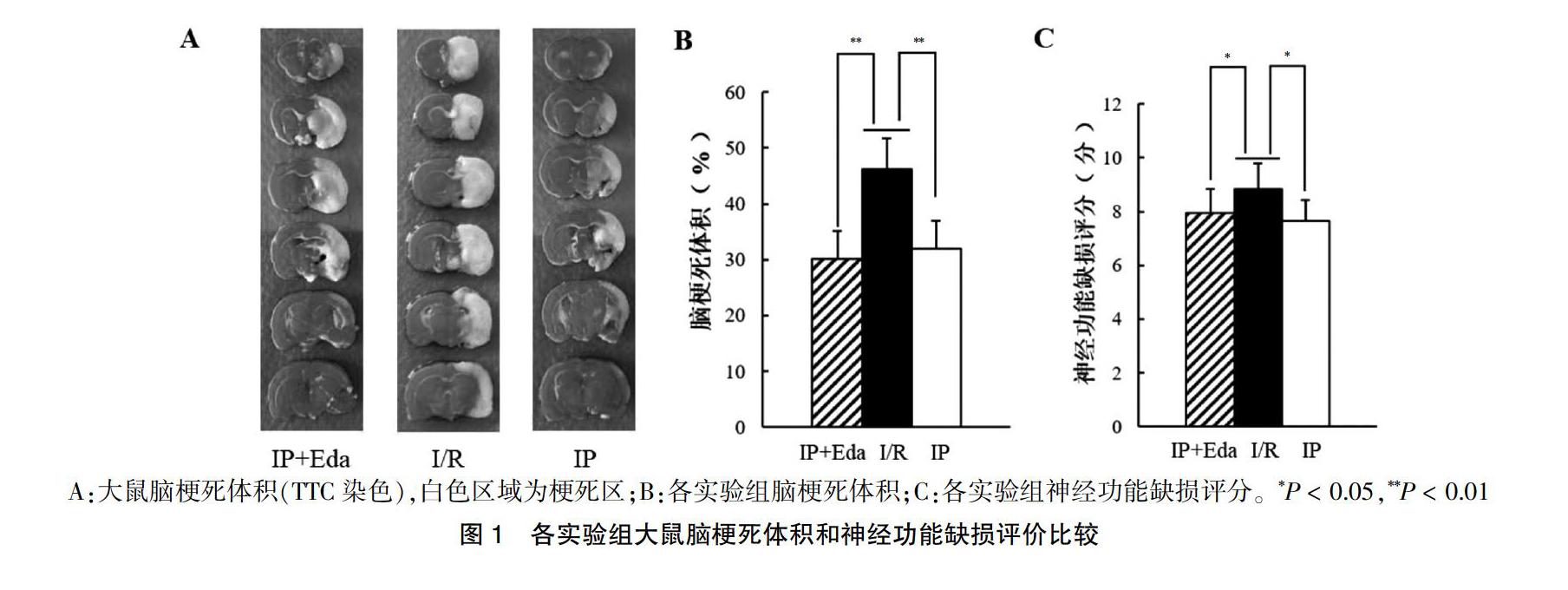
2.1 各组大鼠脑梗死体积比较
IP+Eda组及IP组大鼠脑梗死体积和神经功能缺损评分均较I/R组减少,差异有统计学意义(P < 0.01或P < 0.05)。IP+Eda组大鼠脑梗死体积及神经功能缺血评分与IP组比较,差异无统计学意义(P > 0.05)。见图1。
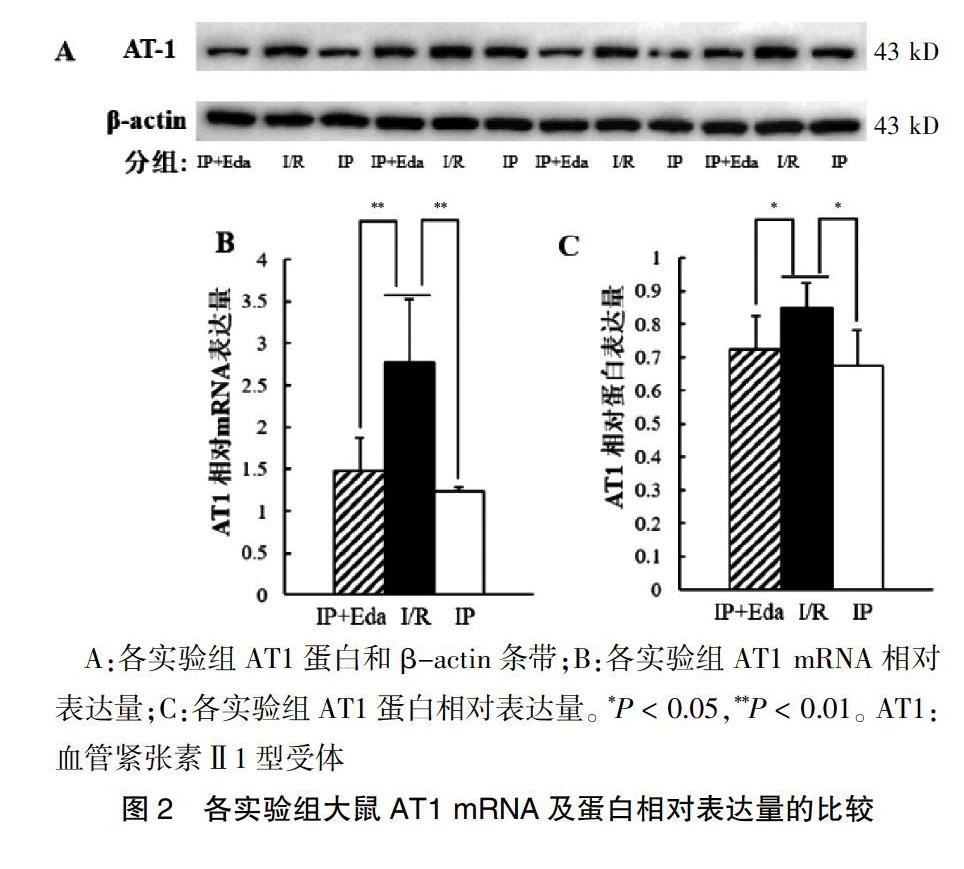
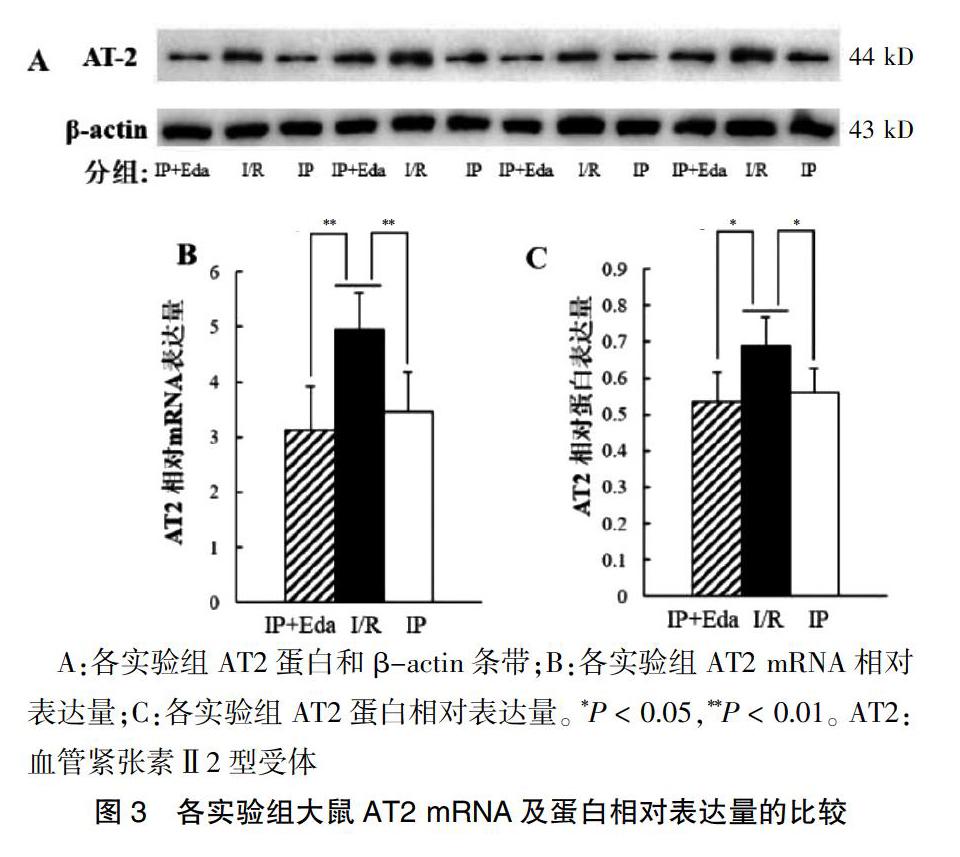
2.2各组大鼠AT1和AT2 mRNA及蛋白相对表达量比较
IP+Eda组与IP组大鼠AT1 mRNA和蛋白相对表达量及AT2 mRNA和蛋白相对表达量均较I/R组明显降低,差异有统计学意义(P < 0.01或P < 0.05)。IP+Eda组AT1及AT2 mRNA和蛋白的相对表达量与IP相比较,差异无统计学意义(P > 0.05)。见图2~3。
A:各实验组AT1蛋白和β-actin条带;B:各实验组AT1 mRNA相对表达量;C:各实验组AT1蛋白相对表达量。*P < 0.05,**P < 0.01。AT1:血管紧张素Ⅱ1型受体
2.3 各组大鼠AT1和AT2阳性细胞比较
各组大鼠缺血侧脑组织均可见AT1、AT2阳性细胞,主要分布在梗死灶周围。IP+Eda组与IP组的AT1、AT2阳性细胞数明显少于I/R组,差异有统计学意义(P < 0.01或P < 0.05)。IP+Eda组AT1、AT2阳性细胞数与IP组比较,差异无统计学意义(P > 0.05)。见图4、图5(封四),图6。
2.4 各组大鼠SOD抑制率的比较
IP+Eda组与IP组SOD抑制率明显高于I/R组,差异有高度统计学意义(P < 0.01)。IP+Eda组SOD抑制率与IP组比较,差异无统计学意义(P > 0.05)。见图6。
3 讨论
肾素-血管紧张素系统(renin-angiotensin system,RAS),也被称为肾素-血管紧张素-醛固酮系统(RAAS),分布于肾脏、肾上腺、心脏、脉管系统,在体内是一种重要的激素及体液调节系统,可产生强烈的缩血管效应及促血管增生作用,负责血压、体液和电解质平衡以及全身血管阻力的调节[13]。自从Detlev Ganten证实脑内也存在独立的RAS后,RAS与神经系统之间的关系便成为研究热点之一,现已发现RAS在神经系统疾病的发生、发展过程中发挥了关键的效应[14]。李蓓华等[15]发现在血管性痴呆大鼠的血浆和脑组织中,肾素活性及血管紧张素转换酶Ⅱ的水平有明显的升高,证实RAS在脑血管病的发生过程中有重要的作用。Gebre等[16]证实针对目标性的RAS给予血管紧张素转换酶抑制剂干预后,可减少脑内淀粉样斑块的沉积,使阿尔茨海默症患者从中受益。
在RAS中,肾素将血管紧张素原分解,产生无活性的血管紧张素Ⅰ,随后在血管紧张素转化酶的作用下转化为血管紧张素Ⅱ。血管紧张素Ⅱ是一种血管活性物质,主要有两种G蛋白偶联受体,分别是AT1和AT2。在脑缺血事件发生后,AT1受体和AT2受体与血管紧张素Ⅱ结合,一方面过度收缩血管,干扰颅内血管循环的代偿功能;另一方面,参与氧化应激反应[17-19]。氧化应激反应是脑缺血/再灌注损伤过程中一种明确的病理机制,在这个过种中超氧阴离子(O2-)的大量生成是其基本特征。血管紧张素Ⅱ与其受体结合后,通过增加脉管系统中O2-阴离子的水平加速内皮功能障碍;同时还有效活化还原型辅酶Ⅱ氧化酶,促进脑细胞中的线粒体活性氧的生成,加重脑缺血再灌注损伤[20]。Wang等[21]报道缺血后处理可通过调节AT1的表达来减轻心肌梗死后冠状动脉和间质的纤维化。Zhang等[22]发现依达拉奉可通过减少AT1和AT2的表达来缓解心脏功能障碍。而本研究中也显示了依达拉奉联合缺血后处理可明显减轻脑缺血/再灌注损伤,表现为大鼠脑缺血/再灌注损伤后脑梗死体积和神经功能缺损评分的下降,AT1和AT2表达的减低及SOD抑制率的上升。
但遗憾的是,依达拉奉联合缺血后处理并没有表现出明显的神经保护协同作用,两者联合后的神经保护作用与单独应用缺血后处理相似。可能的原因为脑缺血/再灌注损伤后的病理级联反应涉及到一系列的机制,而氧化应激反应仅是“冰山一角”,依达拉奉联合缺血后处理可能无法同时对抗包括炎性反应、细胞凋亡、线粒体损伤在内的病理机制,但究竟是其中的哪一种病理机制影响了联合保护效應,还需要在未来的研究中继续探索。
[参考文献]
[1] Wu MY,Yiang GT,Liao WT,et al. The Current Mechanistic Concepts in Ischemia and Reperfusion Injury [J]. Cell Physiol Biochem,2018,46(4):1650-1667.
[2] 黄丽,朱彩霞,张芹欣,等.四种开窍药对急性不完全性脑缺血再灌注损伤模型大鼠的脑保护作用[J].中国比较医学杂志,2018,28(8):77-82.
[3] 曾兆禄,韩继超,薛云,等.针刺结合丹红注射液对大鼠脑缺血再灌注损伤的保护作用[J].中国比较医学杂志,2016,26(2):62-66.
[4] Zhao H,Sapolsky RM,Steinberg GK. Interrupting reperfusion as a stroke therapy:ischemic postconditioning reduces infarct size after focal ischemia in rats [J]. J Cereb Blood Flow Metab,2006,26:1114-1121.
[5] 徐波.HO-1在缺血后处理抗肺缺血再灌注损伤中的作用及其对STAT-3表达的影响[J].中国实验动物学报,2013,21(4):81-85.
[6] 王荣亮,赵海苹,罗玫.远程缺血后适应对大鼠脑缺血再灌注损伤后MIP-1α表达的影响[J].中国比较医学杂志,2013,23(8):24-29,后插1.
[7] Wang Y,Ge P,Yang L,et al. Protection of ischemic post conditioning against transient focal ischemia-induced brain damage is associated with inhibition of neuroinflammation via modulation of TLR2 and TLR4 pathways [J]. J Neuroinflammation,2014,11:15.
[8] Sun MS, Jin H,Sun X,et al. Free Radical Damage in Ischemia-Reperfusion Injury:An Obstacle in Acute Ischemic Stroke after Revascularization Therapy [J]. Oxid Med Cell Longev,2018:3804979.
[9] Dringen R. Metaolism and functions of glutathione in brain. Prog Neurobiol,2000,62(6):649-671.
[10] 韩遵华,段淼,李清香.依达拉奉对缺氧缺血性脑病新生大鼠脑水肿及CD163/HO-1信号通路的影响[J].中国比较医学杂志,2019,29(4):34-40.
[11] 米艳,高小平,朱清风,等.依达拉奉对大鼠脑缺血再灌注损伤的机制研究[J].中国医药导报,2019,16(13):16-19.
[12] Belayev L,Alonso OF,Busto R,et al. Middle cerebral artery occlusion in the rat by intraluminal suture [J]. Stroke,1996,27(9):1616-1622.
[13] Yang T,Xu C. Physiology and Pathophysiology of the Intrarenal Renin-Angiotensin System: An Update [J]. J Am Soc Nephrol,2017,28(4):1040-1049.
[14] Tao MX,Xue X,Gao L,et al. Involvement of angiotensin-(1-7) in the neuroprotection of captopril against focal cerebral ischemia [J]. Neurosci Lett,2018,687:16-21.
[15] 李蓓華,鲁国洲,黄新武.血管性痴呆大鼠肾素-血管紧张素-醛固醇系统的动态变化[J].中国老年学杂志,2017, 37(14):3423-3425.
[16] Gebre AK,Altaye BM,Atey TM,et al. Targeting Renin-Angiotensin System Against Alzheimer′s Disease [J]. Front Pharmacol,2018,9:440.
[17] Tang M,Zhao L,Chen Y,et al. Angiotensin Ⅱ protects cortical neurons against oxygen-glucose deprivation-induced injury in vitro [J]. Biomed Rep,2014,2(1):112-116.
[18] Wu CY,Zha H,Xia QQ,et al. Expression of angiotensin Ⅱ and its receptors in activated microglia in experimentally induced cerebral ischemia in the adult rats [J]. Mol Cell Biochem,2013,382(1/2):47-58.
[19] Alhusban A,Kozak A,Eldashan W,et al. Artery reopening is required for the neurorestorative effects of angiotensin modulation after experimental stroke [J]. Exp Transl Stroke Med,2016,8:4.
[20] Rodríguez-Lara SQ,García-Benavides L,Miranda-Díaz AG. The Renin-Angiotensin-Aldosterone System as a Therapeutic Target in Late Injury Caused by Ischemia-Reperfusion [J]. Int J Endocrinol,2018,2018:3614303.
[21] Wang ZF,Wang NP,Harmouche S,et al. Postconditioning attenuates coronary perivascular and interstitial fibrosis through modulating angiotensin Ⅱ receptors and angiotensin-converting enzyme 2 after myocardial infarction [J]. J Surg Res,2017,211:178-190.
[22] Zhang WW,Bai F,Wang J,et al. Edaravone inhibits pressure overload-induced cardiac fibrosis and dysfunction by reducing expression of angiotensin II AT1 receptor [J]. Drug Des Devel Ther,2017,11:3019-3033.
(收稿日期:2019-10-09 本文编辑:顾家毓)

