联合检测血清NF-κB、TNF-α水平对tPSA灰区前列腺癌患者的诊断价值
周毅 王伟 刘杰 姚远 杨剑文


[摘要] 目的 研究前列腺癌(PCa)患者血清中腫瘤坏死因子-α(TNF-α)及核因子κB(NF-κB)的诊断价值。 方法 选取2015年1月~2018年1月广西科技大学附属柳州市人民医院(以下简称“我院”)诊治的PCa患者100例作为PCa组,选取我院同期诊治的良性前列腺增生(BPH)患者40例为BPH组,选取我院同期体检的健康人群40名为健康对照组。应用电化学发光法检测各组血清总PSA(tPSA)水平,酶联免疫吸附试验(ELISA)检测各组血清TNF-α和NF-κB水平,受试者工作曲线(ROC)分析各指标在PCa中的诊断价值。 结果 BPH组与PCa组患者血清tPSA比较,差异有统计学意义(P < 0.05)。PCa组TNF-α、NF-κB水平高于健康对照组、BPH组,差异均有统计学意义(均P < 0.05)。PCa组患者TNF-α、NF-κB表达与病理分级、Gleason评分及肿瘤分期有关(均P < 0.05),与年龄、初始tPSA及是否存在远处转移无关(P > 0.05)。TNF-α、NF-κB及联合检测的敏感性分别为75.1%、79.2%及81.3%,特异性分别为71.5%、80.1%及82.4%。ROC曲线的曲线下面积分别为0.713、0.753及0.832,联合诊断的诊断效能大于任一单一指标的诊断效能。 结论 PCa患者血清TNF-α、NF-κB表达升高,联合检测患者血清TNF-α、NF-κB对tPSA处于诊断灰区的PCa有较高的诊断价值。
[关键词] 前列腺癌;前列腺特异抗原;核因子-κB;肿瘤坏死因子-α
[中图分类号] R737.25 [文献标识码] A [文章编号] 1673-7210(2020)01(c)-0065-05
Diagnostic value of combined detection of serum NF-κB, TNF-α levels in patients with tPSA gray area prostate cancer
ZHOU Yi WANG Wei LIU Jie YAO Yuan YANG Jianwen
Deparment of Urology Surgery, Liuzhou People′s Hospital Affiliated to Guangxi University of Science and Technology, Guangxi Zhuang Autonomous Region, Liuzhou 545060, China
[Abstract] Objective To investigate the diagnostic value of tumor necrosis factor-α (TNF-α) and nuclear factor-κB (NF-κB) in serum of prostate cancer (PCa) patients. Methods From January 2015 to January 2018, 100 cases of PCa diagnosed and treated in Liuzhou People′s Hospital Affiliated to Guangxi University of Science and Technology (hereinafter referred to as “our hospital”) were selected as the PCa group. Forty patients with benign prostatic hyperplasia (BPH) diagnosed and treated in our hospital during the same period were selected as the BPH group, 40 healthy subjects who underwent physical examination in our hospital during the same period were selected as the healthy control group. Determination of total PSA (tPSA) in each group by electrochemical luminescence. Enzyme-linked immunosorbent assay (ELISA) was used to detect serum TNF-α and NF-κB in each group, and the differences in the expression of each indicator were statistically analyzed. The receiver operating characteristic curve (ROC) was used to analyze the diagnostic value of each indicator in PCa. Results Comparison of serum tPSA between the BPH group and the PCa group showed statistically significant difference (P < 0.05). The levels of TNF-α and NF-κB in the PCa group were higher than those in the healthy control group and the BPH group, with statistically significant differences (all P < 0.05). The expression of TNF-α and NF-κB in the PCa group was correlated with pathological grade, Gleason score and tumor stage (all P < 0.05), and was independent of age, initial tPSA and the presence of distant metastasis (P > 0.05). Sensitivity and specificity of TNF-α, NF-κB and combined assays were 75.1%, 79.2% and 81.3%, respectively, and 71.5%, 80.1% and 82.4%, respectively. The area under the ROC curve was 0.713, 0.753 and 0.832, respectively. The diagnostic efficiency of joint diagnosis was higher than that of any single indicator. Conclusion The expressions of TNF-α and NF-κB in serum of PCa patients were increased, and the combined detection of TNF-α and NF-κB in serum of PCa patients was of high diagnostic value for PCa in the gray area of diagnosis.
[Key words] Prostate cancer; Prostate specific antigen; Nuclear factor-κB; Tumor necrosis factor-α
前列腺癌(prostate cancer,PCa)是男性泌尿生殖系统常见的恶性肿瘤。近年来随着我国人口逐渐步入老龄化社会,其发病率有不断增加的趋势[1]。PCa早期常无明显症状,当出现梗阻尿道、骨骼疼痛等症状时多已为晚期,早期診治是影响预后的关键[2]。前列腺特异抗原(prostate specific antigen,PSA)是诊断PCa的重要筛查手段,但该指标常受年龄、前列腺体积等因素的影响,血清总PSA(tPSA)在4~10 ng/mL时只有约25%的患者证实存在PCa[3]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)由多种细胞分泌的细胞因子,参与调节机体自身免疫、慢性炎症等病理生理学过程,并促进肿瘤的发生发展过程[4]。有研究报道PCa组织中TNF-α表达升高,并且与临床分期、病理分级有关[5],有可能成为PCa诊断治疗的肿瘤标志物。核因子-κB(nuclear factor-κB,NF-κB)作为一种转录因子,在白细胞介素-8(IL-8)等细胞因子的刺激后导致NF-κB活化,由胞浆转移转位至胞核,促进如血管内皮生长因子(VEGF)、Twist1、基质金属蛋白酶(MMPs)等下游靶基因的表达,促进肿瘤细胞发生上皮间质转化、血管生成及浸润转移等[6]。本研究通过检测PCa患者血清TNF-α和NF-κB表达,探讨二者及联合检测在PCa诊断中的临床价值。
1 资料与方法
1.1 一般资料
选取2015年1月~2018年1月于广西科技大学附属柳州市人民医院(以下简称“我院”)诊治的100例PCa患者的临床病理资料(PCa组),以我院同期诊治的良性前列腺增生(benign prostatic hyperplasia,BPH)患者40例为BPH组,我院同期健康体检的人群40名作为健康对照组。PCa组纳入标准:①均经穿刺活检或术后病理检查明确诊断。②初诊时血清tPSA介于4.0~10.0 ng/mL之间。③患者既往未接受过内分泌治疗、免疫治疗等抗肿瘤治疗。④临床病理资料完整,患者及家属均知情同意并已签署知情同意书。排除标准:①合并前列腺炎、泌尿系感染、呼吸道感染等疾病。②合并其他器官系统的恶性肿瘤。③合并严重的心肝肺肾等器官功能不全。患者年龄43~81岁,平均(56.13±7.40)岁;初始tPSA水平根据中位tPSA值7.12 ng/mL,其中≤7.12 ng/mL 41例,>7.12 ng/mL 59例;TNM分期及病理分级参考第8版美国癌症联合会标准[7]:其中Ⅰ~Ⅱ期54例,Ⅲ~Ⅳ期46例;病理分级:高分化及中分化(G1~G2)49例,低分化及未分化(G3~G4)51例;Gleason评分≤7分43例,>7分57例;伴远处转移13例,无远处转移87例。BPH组纳入标准:①血清tPSA介于4.0~10.0 ng/mL之间。②经术后病理检查确诊为BPH。排除标准:①既往有前列腺手术史或既往应用影响血清PSA水平的药物,如5α还原酶抑制剂等。②合并前列腺炎、泌尿系感染等。BPH组年龄43~78岁,平均(59.10±6.70)岁。健康对照组为同期健康查体人群,年龄40~73岁,平均(58.24±6.80)岁。各组年龄比较,差异无统计学意义(P > 0.05),具有可比性。本研究经我院医学伦理委员会审核批准通过。
1.2 检测方法及观察指标
所有研究对象取清晨空腹静脉血5 mL,静置30 min后,经4000 r/min,r=13 cm,5 min离心获取血清,-70℃冰箱保存。血清tPSA应用全自动化学发光免疫分析仪i-2000(美国雅培公司)及其配套试剂盒检测。血清TNF-α、NF-κB检测采用酶联免疫吸附试验法检测,试剂盒购自武汉博士德生物科技公司(生产批号:141227、141009)。实验步骤严格按照说明书进行。每个标本测量3次,结果取平均值。单一指标结果阳性判定为PCa,联合检测以TNF-α、NF-κB两指标均阳性判定为PCa。
1.3 统计学方法
应用SPSS 22.0统计软件进行统计分析,计量资料采用均数±标准差(x±s)表示,组间比较采用t检验,三组均数间比较采用F检验,三组均数两两比较采用Q检验(Newman-Keuls法)。计数资料采用百分率表示,组间比较采用χ2检验。ROC曲线分析各指标及联合检测的诊断价值。以P < 0.05为差异有统计学意义。
2 结果
2.1 各组血清TNF-α、NF-κB水平比较
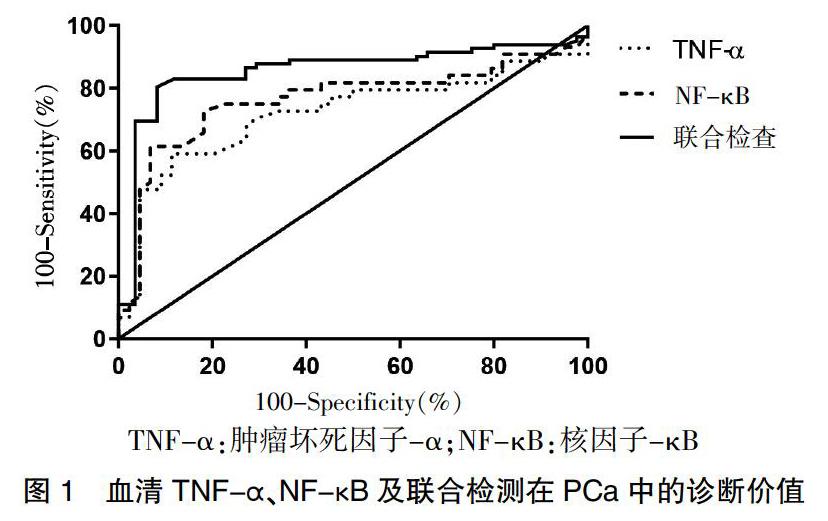
PCa组患者TNF-α水平分别明显高于健康对照组和BPH组(q = 77.646、7.635,P = 0.000、0.000)。PCa组患者NF-κB水平分别明显高于健康对照组和BPH组(q = 38.003、19.443,P = 0.000、0.000)。见图1。
注:与PCa组比较,*P < 0.05;与健康对照组比较,△P < 0.05。TNF-α:肿瘤坏死因子-α;NF-κB:核因子-κB;PCa:前列腺癌;BPH:良性前列腺增生
2.2 PCa组TNF-α、NF-κB表达与临床病理特征的关系
PCa组患者TNF-α、NF-κB表达与病理分级、Gleason评分及肿瘤分期有关(均P < 0.05),与年龄、初始tPSA及是否存在远处转移无关(P > 0.05)。病理分级G3~G4患者血清TNF-α、NF-κB水平明显高于G1~G2患者,Gleason评分>7患者血清TNF-α、NF-κB水平明显高于≤7分患者,肿瘤分期Ⅲ~Ⅳ期患者血清TNF-α、NF-κB水平明显高于Ⅰ~Ⅱ患者。见表2。
2.3 TNF-α、NF-κB及两者联合检测在PCa中的诊断价值
TNF-α、NF-κB及联合检测的敏感性分别为75.1%、79.2%及81.3%,特异性分别为71.5%、80.1%及82.4%。应用ROC曲线分析TNF-α、NF-κB及两者联合检测PCa的诊断效能,曲线下面积(AUC)分别为0.713(95%CI:0.606~0.832)、0.753(95%CI:0.657~0.844)及0.832(95%CI:0.716~0.921),联合检查的诊断效能大于任一单一指标的诊断效能。见图1。
TNF-α:肿瘤坏死因子-α;NF-κB:核因子-κB
3 讨论
近年来随着我国人口老龄化及饮食结构的改变,PCa的发病率有逐渐增高的趋势。PCa早期診断并予以有效治疗是降低患者死亡率、延长患者远期生存的重要因素[8-10]。血清PSA检查是目前早期可疑PCa的最佳筛查方法。但血清tPSA水平受到前列腺体积、前列腺炎症等因素的影响,在诊断PCa时仍具有局限性,因而血清tPSA处于诊断灰区时,结合其他血清指标有助于PCa的鉴别诊断。炎症在肿瘤的发生发展中具有重要的作用,炎症过程中的细胞因子、趋化因子及相应的受体的异常表达影响肿瘤的增殖、凋亡及浸润转移等生物学过程。研究显示,PCa的发生发展与肿瘤微环境中的炎性细胞因子如IL-6、IL-17及TNF-α等的产生增多有关[11-13]。NF-κB是存在于胞质中的转录因子,在IL-6等细胞因子的刺激下活化,活化下游靶基因,参与肿瘤细胞增殖、凋亡及血管生成等病理生理学过程。有研究显示,PCa中NF-κB表达增高,并通过活化STAT3等下游靶基因的表达,促进肿瘤的局部浸润和远处转移[14]。此外,肿瘤微环境中单核巨噬细胞、细胞毒性T淋巴细胞(CTL)等能分泌产生TNF-α等细胞因子,通过激活NF-κB及ERK1/2信号通路,促进CTL细胞上调PD-L1表达,促进CTL凋亡,抑制肿瘤的抗肿瘤免疫反应,与肿瘤的发生发展过程密切相关[12]。因此,本研究通过检测PCa患者血清TNF-α、NF-κB水平,分析血清TNF-α、NF-κB及联合检测在tPSA处于诊断灰区的PCa中的诊断价值。
本研究中,PCa组患者血清NF-κB水平明显高于健康对照组和BPH组,显示PCa时NF-κB水平升高,其机制可能是肿瘤发生时,肿瘤微环境中的辅助性T淋巴细胞(Th1为主),NK细胞等产生的促炎性细胞因子如IL-6、TNF-α等,作用于肿瘤细胞表面相应受体,通过经典激活途径和/或非经典激活途径促进肿瘤细胞内NF-κB信号通路的过度激活,影响下游基因的表达,促进肿瘤细胞的浸润和转移[15-17]。PCa组患者血清NF-κB表达与病理分级、肿瘤分期有关,提示NF-κB可能参与PCa发生发展的过程。其原因可能是NF-κB信号的激活促进上皮间质转化的相关转录因子的表达,如SNAIL、SLUG及TWIST1等,肿瘤的间质性表型vimentin、N-cadherin、α-SMA等表达增加,促进肿瘤的浸润和转移[18-19]。此外,肿瘤分期越高,分化越差,肿瘤细胞因缺血等因素坏死增多,释放到外周血中的肿瘤标志物水平越高。本研究中,PCa组患者血清TNF-α水平明显高于健康对照组及BPH组,显示PCa时患者血清TNF-α水平升高,其机制可能与肿瘤微环境中巨噬细胞极化状态的改变有关,即巨噬细胞由M1型向M2型极化,导致TNF-α等促炎细胞因子分泌增多[20]。本研究中,PCa组患者血清TNF-α表达与病理分级、Gleason评分及肿瘤分期有关,提示TNF-α可能参与PCa的发生发展,其机制一方面是TNF-α能促进肿瘤细胞内氧化应激反应的增强,活性氧产生增多,进一步损伤DNA,导致基因的突变。另一方面,TNF-α能激活细胞内信号传导,促进MMPS、VEGF的表达,进而促进肿瘤的转移和血管生成[21]。本研究进一步研究TNF-α、NF-κB及两者联合检测在PCa中的诊断价值,结果显示血清TNF-α、NF-κB联合诊断的诊断效能大于任一单一指标的诊断效能,与以往研究报道一致[22]。结果显示联合检测血清TNF-α、NF-κB对于tPSA处于诊断灰区的PCa患者具有较高的诊断价值,有助于提高PCa诊断的准确性。
综上所述,tPSA处于诊断灰区的PCa患者血清TNF-α、NF-κB表达升高,联合检测诊断灰区的PCa患者血清TNF-α、NF-κB具有较高的诊断价值,具有一定的临床意义。
[参考文献]
[1] 俞加法,陈炳.前列腺癌的流行病学及其危险因素研究近况[J].中国生化药物杂志,2017,37(7):444-446.
[2] Barry MJ,Simmons LH. Prevention of Prostate Cancer Morbidity and Mortality:Primary Prevention and Early Detection [J]. Med Clin North Am,2017,101(4):787-806.
[3] Shen MJ,Nelson CJ,Peters E,et al. Decision-making Processes among Prostate Cancer Survivors with Rising PSA Levels:Results from a Qualitative Analysis [J]. Med Decis Making,2015,35(4):477-486.
[4] Balkwill F. TNF-alpha in promotion and progression of cancer [J]. Cancer Metastasis Rev,2006,25(3):409-16.
[5] 肿瘤坏死因子-α在前列腺癌组织中的表达及临床意义[J].华西医学,2015(3):407-410.
[6] Shiota M,Yokomizo A,Takeuchi A,et al. Protein kinase C regulates Twist1 expression via NF-κB in prostate cancer [J]. Endocr Relat Cancer,2017,24(4):171-180.
[7] Buyyounouski MK,Choyke PL,McKenney JK,et al. Prostate cancer-major changes in the American Joint Committee on Cancer eighth edition cancer staging manual [J]. CA Cancer J Clin,2017,67(3):245-253.
[8] Barry MJ,Simmons LH. Prevention of Prostate Cancer Morbidity and Mortality:Primary Prevention and Early Detection [J]. Med Clin North Am,2017,101(4):787-806.
[9] 張莹,王希喆,周露,等.p504s、ck5/6和p63表达水平在前列腺增生和前列腺癌中的诊断价值[J].中国医药导报,2018,15(17):106-109.
[10] 华婷,阮建萍,关清,等.多参数MRI在诊断前列腺癌中的应用[J].中国医药导报,2018,15(17):110-113.
[11] Nguyen DP,Li J,Tewari AK. Inflammation and prostate cancer:the role of interleukin 6 (IL-6) [J]. BJU Int,2014, 113(6):986-992.
[12] Wang X,Yang L,Huang F,et al. Inflammatory cytokines IL-17 and TNF-α up-regulate PD-L1 expression in human prostate and colon cancer cells [J]. Immunol Lett,2017,184:7-14.
[13] Pilling AB,Hwang O,Boudreault A,et al. IAP Antagonists Enhance Apoptotic Response to Enzalutamide in Castration-Resistant Prostate Cancer Cells via Autocrine TNF-α Signaling [J]. Prostate,2017,77(8):866-877.
[14] Zhang L,Shao L,Creighton CJ,et al. Function of phosphorylation of NF-κB p65 ser536 in prostate cancer oncogenesis [J]. Oncotarget,2015,6(8):6281-6294.
[15] DiDonato JA,Mercurio F,Karin M. NF-κB and the link between inflammation and cancer [J]. Immunol Rev,2012,246(1):379-400.
[16] Liu L,Li E,Luo L,et al. PSCA regulates IL-6 expression through p38/NF-κB signaling in prostate cancer [J]. Prostate,2017,77(14):1389-1400.
[17] Ye K,Chen QW,Sun YF,et al. Loss of BMI-1 dampens migration and EMT of colorectal cancer in inflammatory microenvironment through TLR4/MD-2/MyD88-mediated NF-κB signaling [J]. J Cell Biochem,2018,119(2):1922-1930.
[18] Zhang J,Kuang Y,Wang Y,et al. Notch-4 silencing inhibits prostate cancer growth and EMT via the NF-κB pathway [J]. Apoptosis,2017,22(6):877-884.
[19] 吴婷,周武雄.肿瘤微环境中肿瘤相关巨噬细胞的研究进展[J].细胞与分子免疫学杂志,2016,32(2):265-267.
[20] 崔力方,郭晓静,付丽.TNF-α与肿瘤发生发展关系的研究进展[J].中华乳腺病杂志:电子版,2007,1(6):236-240.
[21] 田英,梅雪峰,赵娟,等.血清PSA、TNF-α、NF-κB联合检测对前列腺癌患者的诊断价值[J].标记免疫分析与临床,2018,25(9):106-109.
(收稿日期:2019-05-04 本文编辑:封 华)
[基金项目] 广西医药卫生自筹经费计划课题(Z2014435)。
[作者简介] 周毅(1979.8-),男,副主任医师;研究方向:泌尿系肿瘤的诊治。

