熔盐电解制备锂离子电池Cu3Si/Si负极及其倍率性能研究
周忠仁, 董 鹏
(昆明理工大学 冶金与能源工程学院, 云南 昆明 650093)
1 前言
随着新能源动力汽车的普及,研发高比能量、长寿命锂离子电池迫在眉睫。由于现阶段商业化应用的石墨类负极储锂比容量接近其理论值,亟需研发新一代锂离子电池负极材料。硅由于储量丰富、嵌锂比容量高等优势,成为取代碳材料的下一代锂电池负极材料。然而,硅作为储锂材料时存在着弱导电性以及巨大的体积膨胀/收缩问题,是导致材料的容量衰减、倍率性能差的直接原因。现阶段,解决硅负极的手段之一是将硅材料粒径降低至纳米级、引入金属与硅构成合金组分构成复合体系,实现硅分散在惰性或者非惰性基体中,提高复合材料的结构稳定性[1-4]。现阶段,科研人员利用金属Ti、Ni、Ge、Cu合成出Si/TiSi2、SiGe复合薄膜、Si/Ni3Si复合材料等[5-7],使硅的储锂性能得到极大提升。
金属铜由于具备优异的导电性能,将该金属作为合金组分制备硅铜复合材料,能够显著增强电子的传输能力,提升硅负极的电化学储锂性能。Zhou等[8]采用金属热还原法合成具有核壳结构的Cu3Si@Si纳米颗粒,在2 A/g大电流密度下循环400圈后可逆比容量仍高达904 mAh/g;Woo等[9]采用CVD法合成的Cu3Si/Si纳米颗粒具有高达3 036 mAh/g的初始比容量,首次库伦效率为90.5%。然而,CVD法对于实验设备要求高,制备成本较大;金属热还原法制备的硅铜复合材料存在着还原温度高、反应过程不易控制等问题。因此,开发低成本合成高比能量密度的硅基合金负极材料新方法,仍是目前的研究热点。本文提出的熔盐电解法在电解硅基合金方面的成功应用,为解决上述问题、实现低成本合成提供了一条思路。现阶段,熔盐电解法已经成功制备出硅钛、硅锗、硅镍、硅碳等硅基复合材料[10-13],将上述复合材料组装成锂离子电池负极后,活性物质硅的电化学储锂性能获得了大幅度提高。本文以CuO作为金属添加剂,研究在熔盐中直接电解CuO/SiO2混合物料制备硅铜合金反应历程,并测试硅铜复合物的储锂性能。
2 实验材料及方法
2.1 实验原料及阴极制备
以CuO(阿拉丁试剂网,C112563)和SiO2粉末(阿拉丁试剂网,T105415)为原料,按照CuO和SiO2质量比为1∶1混合,称取适量的混合粉末并模压成型得到圆柱形胚体,在管式炉空气气氛、900 ℃下烧结3 h后获得柱状块体CuO/SiO2阴极。
2.2 电解实验
电解实验采用CuO/SiO2为阴极,石墨棒(直径5 mm,长度100 mm)为阳极,引入CaCl2-NaCl熔盐体系为反应介质。通过恒槽压方式,控制槽电压2.8 V、电解温度700 ℃、氩气保护气氛下通电5 h。待电解结束后,将阴极片从熔盐中取出,经蒸馏水和无水乙醇洗涤、真空干燥,获得样品。
2.3 样品表征
电解中间产物以及终产物物相检测采用日本理学公司Mini-600D型X射线衍射仪,参数为管电压40 kV、扫描角度10~90°、Cu Kα辐射、电流40 mA。样品形貌及元素检测采用捷克TESCAN公司生产的VEGA3型扫描电子显微镜进行观察。
3 结果与讨论
3.1 硅铜合金反应过程分析
CuO/SiO2块体在阴极电脱氧过程涉及到电化学脱氧、固- 液和固- 固相反应过程,为便于分析硅铜合金化反应,对电解过程中间产物以及电解产物物相进行分析。图1为阴极氧化物在CuO、SiO2质量比为1∶1,控制槽电压2.8 V、电解温度700 ℃下的中间产物和电解最终产物XRD图谱。从图1a可以看出,电解产物中检测到Cu3Si和Si。其中,图谱中分别在28.46°、47.3°、56、1°处检测出的峰对应单质Si,在36.6°、44.6°、45°附近检测到Cu3Si。从图1b中检测到的中间物相包括CaSiO3、Si、Cu、Cu9Si和Cu15Si4,暗示了SiO2在电解过程中有中间产物CaSiO3的生成。而CuO则被还原成单质Cu。根据XRD检测到的物相,可以推测阴极CuO、SiO2电脱氧反应以及铜硅合金化反应历程如下:首先,由于CuO极易被电解还原,金属Cu优先被还原出来,使得阴极的整体导电性能得到提升,电子在块体阴极内部的传输更容易进行。根据三相反应界面模型可知[14-15],SiO2的电脱氧过程发生在SiO2/电解质/(Cu和Si—Cu合金)三相界面处,由于熔盐中的Ca2+能够与SiO2和熔盐中的O2-反应,生成CaSiO3,因此,SiO2和CaSiO3在过电位下均能够被电解脱氧生成单质Si。当单质Si生成后,随即与邻近的金属Cu进行合金化反应,分别生成Cu9Si、Cu15Si4,并最终生成硅铜合金的稳定相Cu3Si。上述新生成的硅铜合金亦能作为新的导电集流体,推进电解反应持续向块体内部进行。最终,块体内部SiO2被电解还原后,生成单质Si。
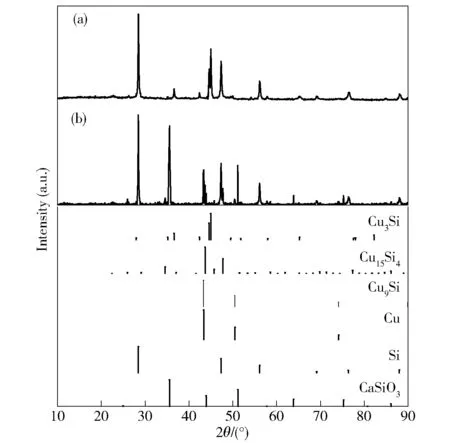
a.电解产物Cu3Si/Si b.中间产物图1 电解过程中间产物和电解产物XRD图谱
3.2 电解产物形貌及能谱分析
为研究电解产物的微观结构,结合扫描电镜测试手段,对CuO、SiO2质量比为1∶1、槽电压2.8 V、温度700 ℃、通电5 h后的电解产物进行测试,如图2所示。从图中可以看出电解产物Cu3Si/Si复合物呈现出多孔状,在大块颗粒表面覆盖着粒径较小的固态颗粒,且各颗粒间界面能够明显被观察到。
图3a所示为电解产物Cu3Si/Si粒径分布。从图2和图3a中可以发现,Cu3Si/Si粒径集中在0.05~2.8 μm之间。对图2进行选区EDS能谱打点分析,结果如图3b和c所示。从图中可以看出,堆积在表面的细小颗粒中Si的含量高达84.26wt%,Cu的含量仅有15.74wt%;大块颗粒检测出Si含量为9.92wt%,Cu的含量高达90.08wt%。

电解产物Cu3Si/Si SEM图图2 电解产物Cu3Si/Si微观形貌图谱分析
因此,可以推断,表面覆盖的细小颗粒为单质Si富集区,大块颗粒则是Cu3Si合金颗粒。
3.3 倍率性能分析
将Cu3Si/Si复合材料组装成锂离子半电池负极后,分别在200、500、800、1 000、2 000以及200 mA/g放电电流密度下测试负极的储锂性能。半电池组装过程见文献[16]。测试结果如表1所示。从表中可以看出,Cu3Si/Si负极在200 mA/g放电电流密度下初始比容量为1 346.22 mAh/g,在500 mA/g下充放循环后比容量衰减至754.3 mAh/g。当继续增加放电电流密度至800、1 000、2 000 mA/g时,可逆比容量分别下降至661.4、564.8、192.1 mAh/g,当电流密度重新恢复至200 mA/g后,可逆比容量恢复至1 030.6 mAh/g。为便于分析,将采用熔盐电解法合成的单质Si作为负极材料时的倍率性能进行对比[17-18]。从表1可以看出,单质Si负极在200 mA/g、500 mA/g、1 000 mA/g和200 mA/g时的可逆比容量分别为2 265.1、573.3、278.9和271.6 mAh/g。通过对比发现,Cu3Si/Si负极的初始比容量低于单质Si负极,这是由Cu组分的加入减少了活性物质Si的含量所导致。当增大放电电流密度后,Cu3Si/Si负极的可逆比容量要明显高于单质Si负极,体现出了优异的倍率性能。这是由于硅铜合金优异的导电性能能够显著增强负极活性材料与导电基底的电接触以及电子的快速传输,使得材料的倍率性能得到显著提升。
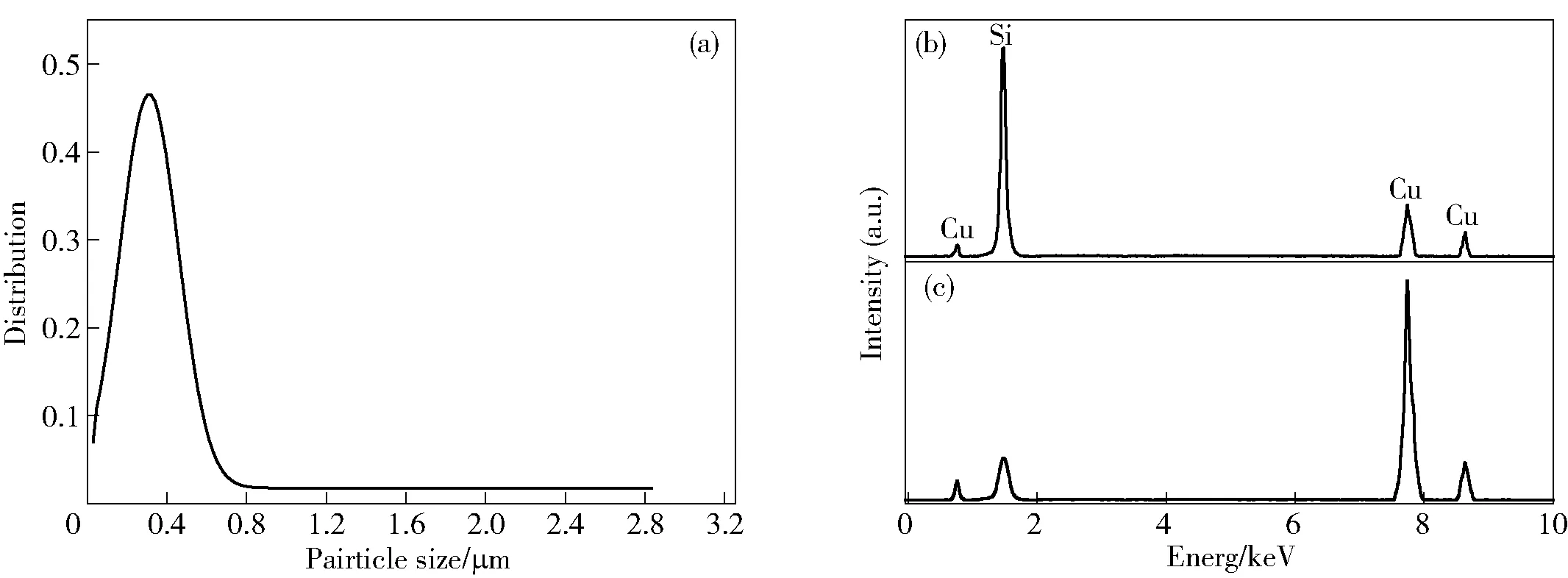
a.电解产物粒径分布 b.区域1元素含量图谱分析 c.区域2元素含量图谱分析图3 电解产物Cu3Si/Si颗粒粒径及Cu、Si元素含量分析图谱
表1 Cu3Si/Si和单一Si负极在不同放电电流密度下储锂比容量[18]mAh/g

负极材料电流密度20050080010002000200Cu3Si/Si1346.2754.3661.4564.8192.11030.6Si2265.1573.3—278.9—271.6
4 结论
(1) 以CuO、SiO2质量比为1:1的混合物料为电解原料、CaCl2-NaCl熔盐体系为电解质,制备得到Cu3Si/Si复合物,产物微观形貌为粒径在0.05~2.8 μm的多孔颗粒。
(2) CuO/SiO2的电解脱氧反应历程包括CuO电解还原生成单质Cu,SiO2优先生成CaSiO3并进一步电脱氧生成单质Si。硅铜合金化反应有中间产物Cu9Si和Cu15Si4,并最终生成硅铜合金稳定相Cu3Si。
(3) 将Cu3Si/Si复合物组装成锂离子电池负极后,体现出了良好的倍率性能。在200、500、800、1 000和2 000 mA/g放电电流密度下,可逆比容量分别为1 346.22、754.3、661.4、564.8和192.1 mAh/g。当电流密度重新降低至200 mA/g后,可逆比容量恢复至1 030.6 mAh/g。

