富硒长双歧杆菌DD98菌株对伊立替康所致小鼠腹泻及肠道菌群的影响
,*,4,*
(1.复旦大学药学院,上海 200120;2.中国医药工业研究总院,上海 201203;3.上海师范大学生命科学学院,上海 200234;4.上海交通大学药学院,上海 200240)
伊立替康(irinotecan,CPT-11)是一种衍生自喜树碱的化合物,广泛应用于各类肿瘤疾病治疗,如非小细胞肺癌、胃癌和直肠癌等[1]。CPT-11进入体内后能迅速在胃肠道和肝脏组织中水解为活性化合物SN-38,SN-38在肝葡萄糖醛酸化过程中代谢为无活性代谢物SN-38葡糖苷酸(SN-38G),随后被输出到肠道[2]。但是,SN-38G可被肠道细菌β-D-葡糖醛酸糖苷酶水解为SN-38,从而导致肠毒性[3]。研究表明[4],CPT-11还会造成脊髓抑制毒性、中性粒细胞和白细胞减少等不良反应。
双歧杆菌是活的肠道微生物,作为药物或食品补充剂有助于维持人类或其他宿主消化道的微量平衡,并且可以通过自身转化吸收微量元素,改变生理生化功能[5]。研究表明[6],益生菌制剂具有低毒性、良好的耐受性等优点,可通过降低肠道β-D-葡糖醛酸糖苷酶的活性,缓解伊立替康治疗引起的腹泻。微量元素硒(selenium,Se)是人体必需元素,与蛋白质组成硒蛋白维持生理功能,与25-30种遗传特异性酶组成硒酶维持催化功能,在生物化学和生理学上具有重要作用[7]。研究表明[8-9],有机硒具有显著的低毒性和可接受的生物利用度,可作为化疗预防剂,以防止抗癌药物伊立替康的毒性,并协同增强体外和体内的抗肿瘤治疗效果。据此,本实验室在高硒培养基中发酵培养双歧杆菌,通过特定条件使培养基中的无机硒吸收转化为自身硒蛋白,制备具备硒功能和双歧杆菌功能的富硒益生菌(Selenium-enrichedBifidobacteriumlongum,Se-DD98)。研究表明[10],双歧杆菌经富硒培养后,黏附能力显著提升,且可能与细菌表面Tuf黏附蛋白的改变有关。
有研究表明[11-13],富硒益生菌可影响体内硒蛋白基因表达、免疫功能、和谷胱甘肽过氧化酶的活性,并且与CPT-11联用后可以增强抗肿瘤作用。富硒长双歧杆菌可降低CPT-11诱导的小鼠死亡率并预防小鼠小肠黏膜炎[14]。本实验室前期研究表明,Se-DD98能够改善5-FU导致的化疗性肠黏膜炎[15]。CPT-11的严重不良反应限制了其临床应用,因此本研究旨在探讨Se-DD98辅助用药后对CPT-11所致不良反应的缓解作用,包括对小鼠体重、腹泻等级、免疫指标和肠道菌群的影响,为后期研究和开发活性更优的新型富硒益生菌产品奠定基础。
1 材料与方法
1.1 材料与仪器
48只健康雄性SPF级ICR小鼠 6~8周龄,体质量(20±2) g,由上海杰思捷实验动物有限公司提供,实验动物许可证号:SCXK(沪)2014-0018,普通饲料适应性喂养3 d,饲养温度21-25 ℃,相对湿度40%~70%;长双歧杆菌DD98菌株(CGMCC 16573) 本实验室经高通量筛选得到耐硒长双歧杆菌优势菌株[16],经16S rRNA测序及核苷酸序列BLAST分析,结果表明DD98菌株是一种新的长双歧杆菌;盐酸伊立替康原料药 齐鲁制药;二甲基亚砜 国药集团化学试剂有限公司;粪便基因DNA提取试剂盒 北京天根生化科技有限公司;亚硒酸钠 山东西亚化学工业有限公司;BBL琼脂培养基 青岛海博生物技术有限公司。
ALC-210.3电子天平 赛多利斯有限公司;AG22331 Hamburg离心机 艾本德;Forma 900系列超低温冰箱 赛默飞世尔;XH-C漩涡混合器 金坛市白塔新宝仪器厂;AJD14L010台式高速冷冻离心机 贝克曼库尔特;DK-8D电热恒温水槽 上海一恒科学仪器有限公司;1510全波长酶标仪 赛默飞世尔;LGJ-22D冷冻干燥剂 北京四环科学仪器厂有限公司;BC-2800vet全自动血液细胞分析仪 深圳迈瑞生物医疗电子股份有限公司。
1.2 实验方法
1.2.1 样品制备 Se-DD98的培养:前期实验研究结果表明[17],将长双歧杆菌DD98接种于BBL琼脂培养基中,厌氧培养12 h后,向培养基中添加亚硒酸钠,继续培养至24 h,在高硒环境下发酵可制备得到Se-DD98。Se-DD98冷冻干燥48 h后得到冻干菌粉,密封保存于4 ℃,实验前采用平板涂布法检测样品活菌数。参照食品安全国家标准,测定菌粉Se-DD98的硒含量为0.349 mg/g(硒重量/菌粉重量)。
给药溶液的配制:高剂量菌液(菌液活菌数1×109CFU/kg)配制:平板涂布法测得菌粉活菌数为5.196×108CFU/g(菌粉重量),根据小鼠灌胃体积0.2 mL/10 g(小鼠体重),最终确定配制溶液浓度为0.096 g/mL,使用无菌蒸馏水溶解菌粉。低剂量菌液(菌液活菌数1×108CFU/kg)配制:使用梯度稀释法,用无菌蒸馏水将高剂量菌液稀释10倍,得到低剂量菌液。
1.2.2 动物分组及给药 小鼠随机分为4组,每组12只,分别为正常对照组、CPT-11组、Se-DD98低剂量组、Se-DD98高剂量组。正常对照组和CPT-11组灌胃蒸馏水,Se-DD98低剂量组灌胃低剂量菌液(菌液活菌数1×108CFU/kg),Se-DD98高剂量组灌胃高剂量菌液(菌液活菌数1×109CFU/kg),灌胃体积0.2 mL/10 g(小鼠体重),1次/d。
参照文献方法[18],建立伊立替康小鼠腹泻模型。第0~24 d,各组小鼠灌胃无菌蒸馏水或者菌液;第18 d,正常对照组腹腔注射无菌生理盐水,其余各组每只小鼠腹腔注射150 mg/kg CPT-11,注射体积0.1 mL/10 g(小鼠体重);第17 d和第24 d,每组各取6只小鼠,考察生理生化指标及肠道菌群变化;第18~24 d,观察各组小鼠腹泻情况。
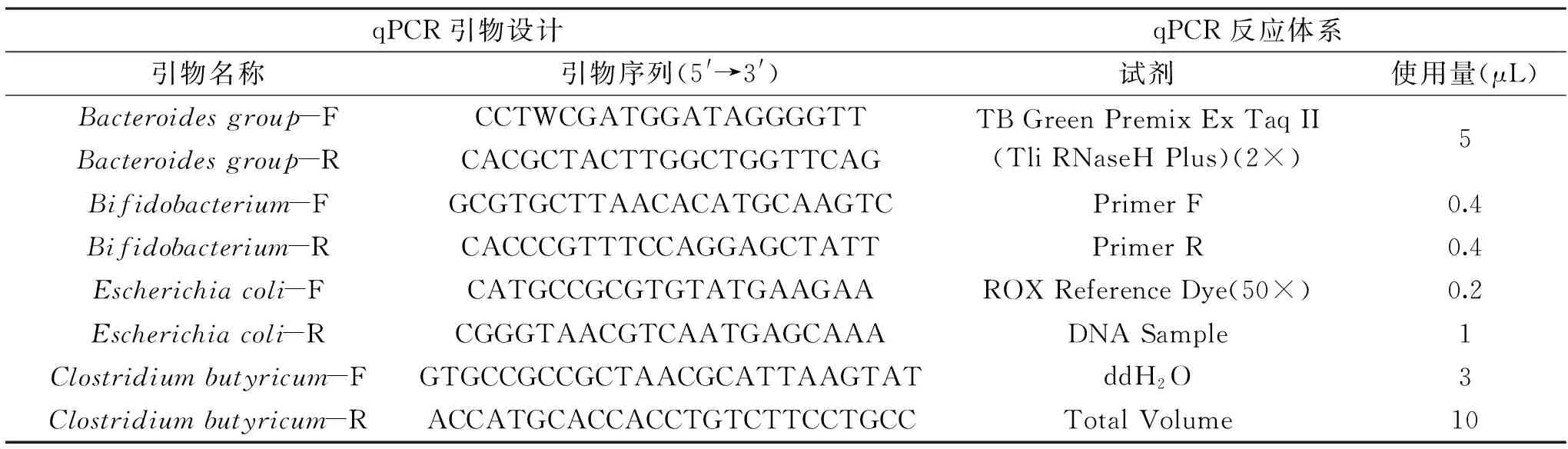
表2 qRCR引物设计和反应体系Table 2 qPCR primer design and reaction system
1.2.3 小鼠体重 实验开始后分别于第18、19、20、21、22、23、24 d每天早上9:00观察小鼠状态,测量各组小鼠体重并记录[19],按照公式(1)计算各组小鼠原始体重百分比。
原始体重百分比(%)=Wn/W0×100
式(1)
式中:Wn:第n(0~24) d各组小鼠体重;W0:第0 d各组小鼠体重。
1.2.4 小鼠腹泻发生率和腹泻等级评价 参考文献方法[20],伊立替康注射24 h后,分别在24、48、72、96、120和144 h观察小鼠腹泻情况并进行腹泻评分(表1),按照公式(2)和(3)分别计算各组小鼠腹泻发生率和小鼠平均腹泻等级。
腹泻发生率(%)=(N/N0)×100
式(2)
式中:N:各组小鼠腹泻只数;N0:各组小鼠总只数。
平均腹泻等级=M/N0
式(3)
式中:M:各组小鼠腹泻等级之和;N0:各组小鼠总只数。

表1 小鼠腹泻评价标准Table 1 Diarrhea evalution criteria in mice
1.2.5 小鼠脾脏指数和外周血常规指标测定 第17和24 d,各组小鼠随机取出6只并称重,采用眼内眦法采集血液至含肝素的抗凝管中,上下颠倒混匀,在2 h内使用全自动血液细胞分析仪检测外周血常规。所有操作步骤都需要严格按照相关规定进行,以保证检测结果的准确性。对比分析外周血常规检测结果,包括白细胞、淋巴细胞和中性粒细胞。
第17 d和第24 d,采用颈椎脱臼法处死小鼠,冰上操作,取出脾脏并称重,按照公式:脏器指数=脏器质量(mg)/体质量(g)计算脾脏指数。
1.2.6 小鼠肠道微生物相对丰度测定 第17 d和第24 d,采用颈椎脱臼法处死小鼠,冰上操作,取出0.2 g盲肠内容物装入干净的EP管中,放入-80 ℃冰箱冻存。使用粪便基因DNA提取试剂盒提取粪便总DNA,超微量紫外分光光度计测定DNA浓度并稀释。参照文献方法[21-23],使用荧光定量qPCR测定拟杆菌、长双歧杆菌、梭菌和大肠杆菌的相对丰度,CT检测限为40个循环(表2和表3)。

表3 qPCR反应条件Table 3 qPCR reaction conditions
1.2.7 小鼠回肠组织结构的观察 采用苏木精-伊红(Hematoxylin and eosin,HE)染色法分别于第17 d和第24 d,采用颈椎脱臼法处死小鼠,距回盲瓣5 cm处获取回肠组织,0.9%生理盐水冲洗干净,福尔马林固定24 h。将石蜡组织切片脱蜡至水,水洗3次,每次2 min;将切片置于苏木素液中浸染5 min,之后水洗1 min;盐酸酒精分化30 s之后,流水冲洗5 min;伊红染液浸染3 min,之后流水冲洗30 s;逐级乙醇脱水,最后用二甲苯透明,中性树胶封片固定后,于光学显微镜下观察。
1.3 数据处理
采用SPSS 21.0软件进行统计分析。两组之间的差异采用t-test进行显著性分析。结果表示为平均值±标准差,P<0.05表示存在显著性差异,P<0.01表示存在极显著性差异。
2 结果与分析
2.1 小鼠体重变化
实验数据显示,伊立替康组、Se-DD98低剂量组和高剂量组小鼠的原始体重百分比在第18 d注射伊立替康后均呈现先下降后回升的趋势(图1)。
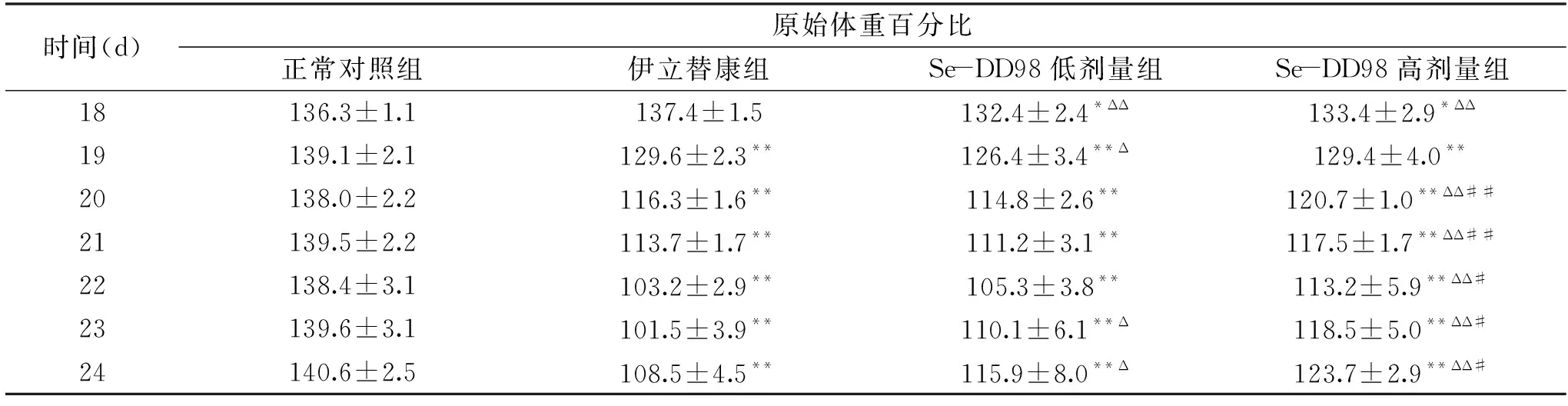
表4 小鼠在18 d到24 d的原始体重百分比Table 4 Percentage of initial mouse body weight from the 18 d to the 24 d
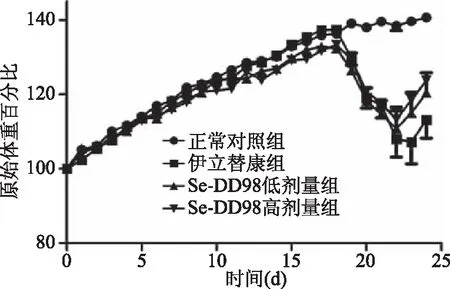
图1 小鼠原始体重百分比变化Fig.1 Changes of percentage of initial mouse body weight
注:与正常组比较,*P<0.05,**P<0.01;与伊立替康组比较,ΔP<0.05,ΔΔP<0.01;与低剂量比较,#P<0.05,##P<0.01。表5~6同。
由表4可知,与正常对照组比较,注射伊立替康后,伊立替康组、Se-DD98低剂量组和高剂量组的原始体重百分比均显著降低(P<0.05)。但与伊立替康组比较,Se-DD98低剂量组的原始体重百分比在18~19 d显著降低(P<0.05),在23和24 d显著升高(P<0.05);与伊立替康组比较,Se-DD98高剂量组的原始体重百分比在18 d极显著降低(P<0.01),在20 d以后均极显著升高(P<0.01);且Se-DD98高剂量组的原始体重百分比显著高于低剂量组(P<0.05)。结果表明,伊立替康会造成小鼠体重下降,而长期给予Se-DD98菌粉能够抑制伊立替康造成的体重下降,并且存在剂量依赖性。
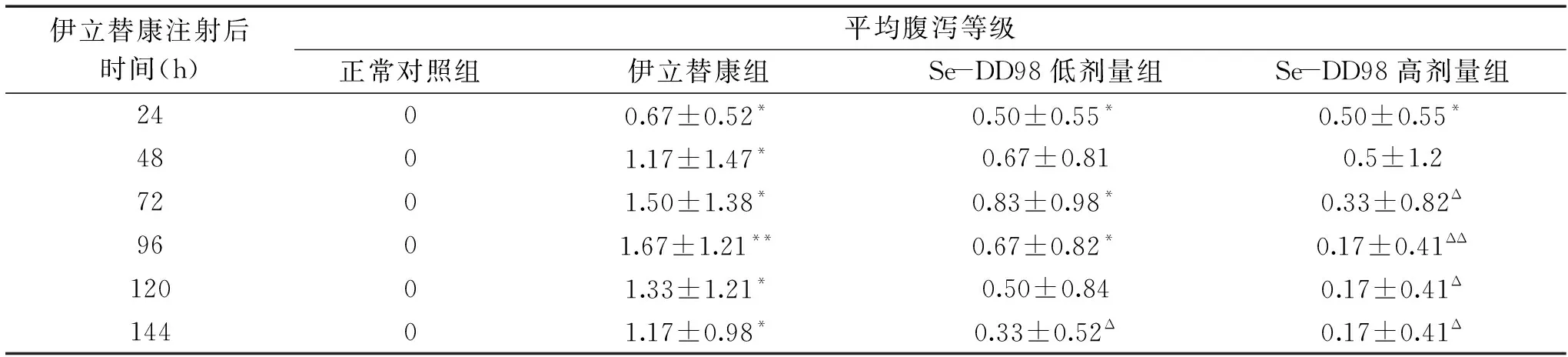
表5 Se-DD98 对伊立替康所致腹泻小鼠平均腹泻等级的影响Table 5 Effect of Se-DD98 on average diarrhea levels in diarrhea mice induced by irinotecan
2.2 Se-DD98对小鼠腹泻发生率和平均腹泻等级的影响
研究表明,伊立替康诱导的高腹泻发生率将影响药物的临床治疗,并且严重的腹泻等级也会致使脱水等生命危险[24]。伊立替康组腹泻发生率随着时间增加呈现先逐渐上升,后期下降后保持不变的趋势。Se-DD98低剂量组在96 h下降后保持不变,Se-DD98高剂量组在48 h下降后保持不变,但Se-DD98高、低剂量组的腹泻发生率均低于伊立替康组(图2)。

图2 Se-DD98对伊立替康所致腹泻小鼠腹泻发生率的影响Fig.2 Effect of Se-DD98 on diarrhea incidencein diarrhea mice induced by irinotecan
伊立替康组和Se-DD98高、低剂量组的平均腹泻等级也显示随时间而变化,出现先升高后下降的现象。伊立替康组在各时间点的平均腹泻等级均显著高于正常对照组(P<0.05)。Se-DD98低剂量组在144 h,Se-DD98高剂量组在72~144 h的平均腹泻等级均显著低于伊立替康组(P<0.05)(表5)。结果表明,伊立替康会导致小鼠不同程度的腹泻且平均腹泻等级呈现先升高后下降的现象,给予Se-DD98菌粉能够降低小鼠腹泻发生率和平均腹泻等级。由此推知,Se-DD98能够缓解伊立替康所致的小鼠持续腹泻。
2.3 Se-DD98对小鼠免疫指标的影响
研究认为,双歧杆菌对正常小鼠免疫功能影响的水平低于其对免疫功能低下小鼠模型各项免疫指标的影响[25];与单独给予硒或者单独给予益生菌比较,富硒益生菌具有更多优势,能够增强环磷酰胺治疗的荷瘤小鼠的免疫功能[12,26]。由表6可知,第17 d(伊立替康注射前),各组小鼠的脾脏指数、白细胞指数、淋巴细胞指数和中性粒细胞指数均没有显著差异。第24 d(伊立替康注射后),与正常对照组比较,伊立替康组的脾脏指数和白细胞数目均极显著降低(P<0.01)。与伊立替康组比较,Se-DD98低剂量组的脾脏指数和中性粒细胞指数均显著升高(P<0.05),Se-DD98高剂量组的脾脏指数、白细胞指数和中性粒细胞均显著升高(P<0.05)。结果表明,伊立替康注射前,长期给予Se-DD98菌粉对正常小鼠免疫功能没有明显的影响。伊立替康注射后造成小鼠免疫功能下降,Se-DD98菌粉能够提高小鼠免疫功能。由此推知,Se-DD98菌粉对正常小鼠免疫功能影响甚微,但能抑制伊立替康所致的机体免疫功能下降,具有调节机体免疫功能的作用。
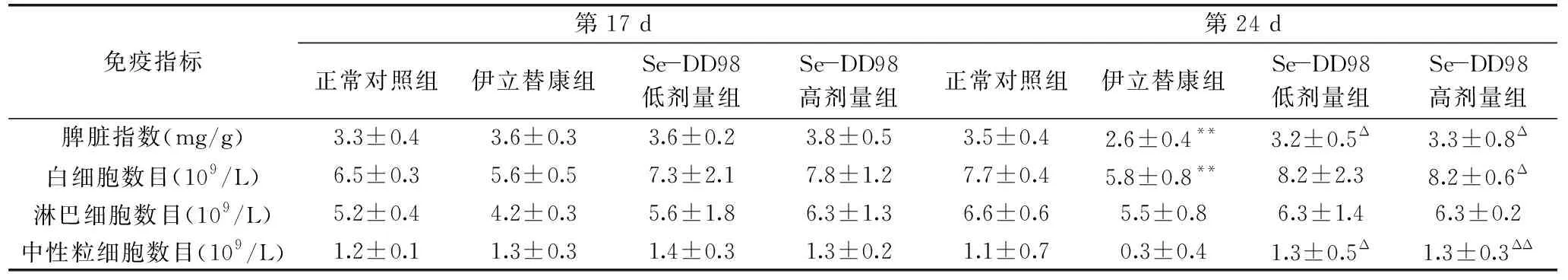
表6 Se-DD98对伊立替康所致腹泻小鼠免疫指标的影响Table 6 Effect of Se-DD98 on immune indexes in diarrhea mice induced by irinotecan
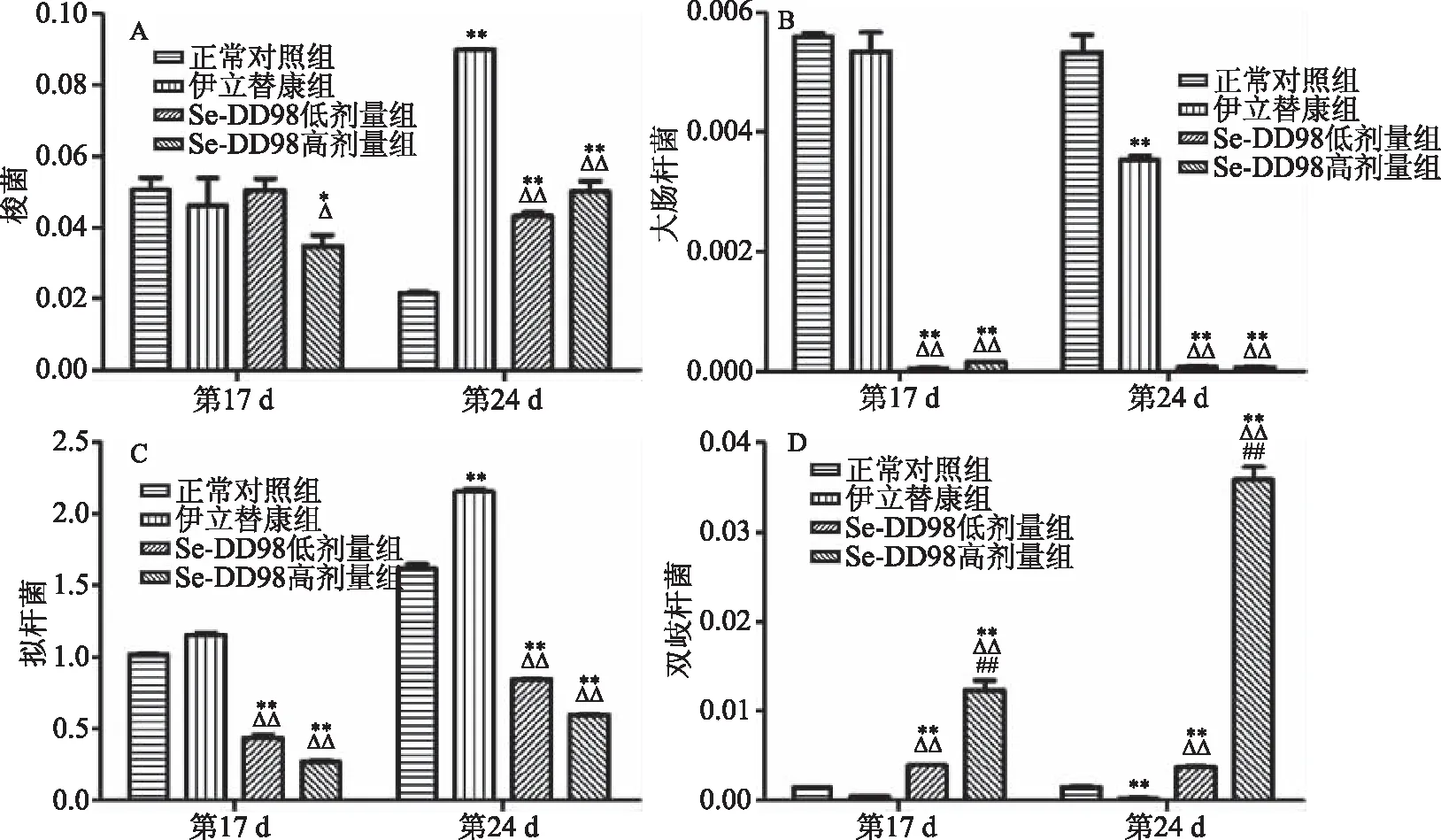
图3 Se-DD98对小鼠肠道菌群相对丰度的影响Fig.3 Effect of Se-DD98 on relative abundance of intestinal microflora in mice 注:A:梭菌;B:大肠杆菌;C:拟杆菌;D:双歧杆菌。与正常组比较,*P<0.05,**P<0.01;与伊立替康组比较,ΔP<0.05,ΔΔP<0.01;与低剂量比较,#P<0.05,## P<0.01。
2.4 Se-DD98对小鼠肠道菌群的影响
研究表明[23,27-28],拟杆菌、梭菌和大肠杆菌能够增强β-D-葡糖醛酸糖苷酶的活性,促使肠道内非活性化合物SN-38G转化为活性化合物SN-38,从而加剧小鼠腹泻。Kulkarni课题组研究表明[29],饮食中的长双歧杆菌能够影响某些与β-D-葡糖醛酸糖苷酶相关的肠道微生物菌群的代谢活性。
第17 d(伊立替康注射前),与正常对照组比较,Se-DD98高、低组的大肠杆菌和拟杆菌相对丰度显著减少(P<0.05);而双歧杆菌相对丰度显著增加(P<0.01)。有研究表明,益生菌制剂减少正常小鼠粪便中大肠杆菌等有害菌含量,增加双歧杆菌等有益菌含量[30]。由此推知,长期给予Se-DD98,能够增加正常小鼠粪便双歧杆菌等有益菌含量,减少梭菌、大肠杆菌和拟杆菌的含量。
第24 d(伊立替康注射后),与正常对照组比较,伊立替康组的梭菌和拟杆菌显著增加(P<0.01),大肠杆菌和双歧杆菌显著减少(P<0.01);Se-DD98低、高剂量组的大肠杆菌、拟杆菌显著减少(P<0.01),而梭菌和双歧杆菌显著增加(P<0.01)。与伊立替康组比较,Se-DD98低、高剂量组的梭菌、大肠杆菌和拟杆菌相对丰度显著减少(P<0.01),而双歧杆菌显著增加(P<0.01)。Se-DD98低、高剂量组的拟杆菌的减少和双歧杆菌的增加呈剂量依赖性(图3)。
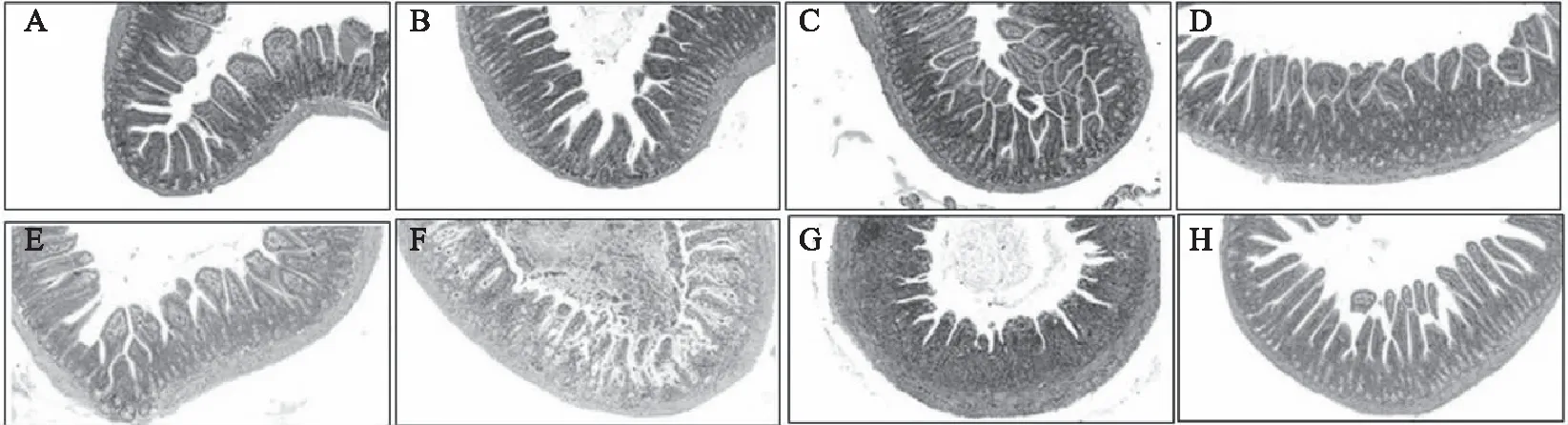
图4 Se-DD98对伊立替康所致腹泻小鼠回肠组织结构的影响Fig.4 Effect of Se-DD98 on histologic structure of the ileum in diarrhea mice induced by irinotecan注:A:第17 d正常对照组;B:第17 d伊立替康组;C:第17 d Se-DD98低剂量组;D:第17 d Se-DD98高剂量组;E:第24 d正常对照组;F:第24 d伊立替康组;G:第24 d Se-DD98低剂量组;H:第24 d Se-DD98高剂量组。
上述结果表明,伊立替康注射后导致小鼠肠道内与β-D-葡糖醛酸糖苷酶相关的梭菌和拟杆菌相对丰度增加。长期给予Se-DD98菌粉能够降低小鼠肠道内的梭菌、大肠杆菌和拟杆菌相对丰度,增加长双歧杆菌相对丰度。由此推知,Se-DD98菌粉能够缓解伊立替康所致小鼠腹泻,可能其降低与β-D-葡糖醛酸糖苷酶相关的肠道菌含量并且增加双歧杆菌含量有关。
2.5 Se-DD98对小鼠回肠组织结构的影响
研究表明,伊立替康导致小鼠严重腹泻,并对肠道结构和细胞有损害作用[31]。第17 d(伊立替康注射前),各组小鼠的小肠肠壁各层结构完好,无溃疡形成,腺体大小、形态、分布正常,肠壁未见炎细胞浸润。第24 d(伊立替康注射后),与正常对照组比较,伊立替康组小肠粘膜变薄、粘膜上皮细胞变性、坏死、脱落,见大量炎细胞浸润,腺体有萎缩,肠腺减少。与伊立替康组比较,Se-DD98低、高剂量组只显示部分粘膜上皮细胞变性、坏死、脱落,少量炎细胞浸润(图4)。
结果表明,伊立替康会导致小鼠回肠粘膜变薄、粘膜细胞变性以及腺体萎缩等损伤。长期给予Se-DD98菌粉对正常小鼠回肠粘膜、细胞和腺体无影响,但能够减轻由伊立替康导致的肠道粘膜、细胞和腺体的损伤。由此推知,Se-DD98对正常小鼠肠道结构和细胞无损害作用,但对伊立替康所致的肠道损伤有保护作用;Se-DD98缓解小鼠腹泻可能与其保护肠道细胞和粘膜有关。
3 结论
本研究结果表明Se-DD98能够抑制伊立替康所致的小鼠体重下降和免疫功能降低;降低小鼠腹泻发生率和平均腹泻等级,缓解伊立替康所致的小鼠腹泻。Se-DD98能够减少肠道内与β-D-葡糖醛酸糖苷酶相关的梭菌、大肠杆菌和拟杆菌含量,并且增加肠道内双歧杆菌含量,推测Se-DD98可通过调节肠道菌群缓解伊立替康所致腹泻。Se-DD98也能够减轻伊立替康导致的小鼠肠道粘膜、细胞和腺体的损伤,推测Se-DD98缓解腹泻与保护肠道粘膜有关,具体作用机制有待进一步研究。此外,Se-DD98对正常小鼠免疫功能影响甚微,但能抑制伊立替康所致的机体免疫功能下降,具有调节机体免疫功能的作用。本研究为应用Se-DD98辅助治疗伊立替康等常用化疗药物引起的腹泻等副作用提供了实验依据。

