H7N9禽流感病毒跨种间传播及其感染人气道黏膜的分子机制研究进展
郭妍蓉,谈思怡,林宇静,刘曦,郑晓滨,乔永康,Tan Kai Sen,王德云,张评浒,严彦*
1中山大学附属第五医院广东省生物医学影像重点实验室,广东珠海 519000;2中山大学附属第五医院感染与免疫学研究中心,广东珠海 519000;3中山大学附属第五医院病理科,广东珠海 519000;4中山大学附属第五医院感染病防治中心,广东珠海 519000;5中山大学附属第五医院呼吸内科,广东珠海 519000;6华大基因生命科学研究院,广东深圳 518083;7新加坡国立大学杨潞龄医学院耳鼻喉头颈外科系,新加坡 119077;8扬州大学转化医学研究院,江苏扬州 225009
1 H7N9的病原学和病因学
H7N9亚型禽流感病毒(avian influenza virus,AIV)是甲型流感病毒的一种。流感病毒属于正黏病毒科,根据核蛋白(NP)和基质蛋白(MP)的不同,可分为A型(甲型)、B型(乙型)、C型(丙型)。其中甲型流感病毒(IAV)依据病毒表面血凝素(HA)和神经氨酸酶(NA)的不同,可划分为18种HA亚型和11种NA亚型[1]。水禽是A型流感病毒的天然宿主,能通过跨种间传播感染人的禽流感病毒主要包括H5N1、H6N2、H7N9、H9N2等几种亚型,H5和H7亚型属于高致病性禽流感(highly pathogenic avian influenza,HPAI)[2]。不同亚型的禽流感病毒共同感染鸟类后,在宿主体内易发生基因片段重组,产生新型流感病毒,H7N9病毒正是一种新型重组病毒。相关研究表明,H7N9禽流感病毒的基因片段均来源于其他禽流感病毒[3-5],其HA基因与H7N3亚型病毒高度同源,NA基因与2011年韩国发现的鸟类H7N9禽流感病毒高度同源[6],其余内部基因则与H9N2病毒的基因片段高度同源。
H7N9禽流感病毒于2013年2月在我国首次暴发,主要通过飞沫传播,经呼吸道感染人体。该病毒不仅可感染家禽,还可跨越宿主界限感染人呼吸道上皮细胞,诱发细胞因子连锁反应,导致全身炎症反应,引起轻至重度肺部感染,出现急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、休克及多脏器衰竭(multiple organ dysfunction syndrome,MODS),严重者可能死亡[7],具有潜在的流行风险。H7N9禽流感病毒自出现至今,共发生了6次流行,导致1500多人发病,600多人死亡,致死率为31%~45%[7-10]。值得庆幸的是,此类病毒迄今尚未获得人传人的能力,仅在小范围内散发,若其获得与人流感病毒类似的人传人能力,极易引起大范围暴发的灾难。
H3N2是人季节性流感病毒的典型代表,而H5N1和H7N9均是HPAI,三者均对人类健康存在重大威胁,其流行病学特征及临床表现具有一定的相似性。在季节性流感流行期间,老年人(>65岁)的住院率较高[11],H5N1感染不受年龄阶段限制,各年龄段均有发生,包括儿童和年轻人[12],而H7N9感染者主要是有接触活禽经历的、>59岁的男性[4,13]。这可能与该年龄段人群的先天免疫和适应性免疫系统功能减弱有关[14-15]。H7N9感染导致的MODS,白细胞、淋巴细胞减少[16],以及病毒在肺外扩散[17]等临床表象与病理特征均证实了上述观点。临床导致H7N9禽流感患者死亡的原因通常与急性肺损伤导致的ARDS有关[16],且H7N9病毒载量和病情恢复与患者预后密切相关[18]。对比三类流感病毒的流行病学特征、临床特征及治疗方案,有助于防范以后可能出现的疫情(表1)。
2 H7N9跨种间传播感染人
流感病毒的跨种间传播主要与病毒基因组重排及突变点积累从而导致病毒变异有关[36-40]。目前H7N9禽流感病毒突破种间屏障感染人体的分子机制尚未明确。一方面,禽流感病毒基因之间的重组结合缩短了物种间屏障的距离,尽管尚未发现禽流感与人流感病毒基因片段的重组,但病毒基因之间的重组是禽流感病毒发生跨种间传播的重要机制之一;另一方面,禽流感病毒跨种间传播适应新宿主的重要方式是流感病毒蛋白上发生适应性的点突变,其中聚合酶碱性蛋白2(polymerase basic protein 2,PB2)[41]是跨宿主传播最重要的因素之一。现已报道,H7N9禽流感病毒的PB2蛋白(PB2 627K、PB2 701N、PB2 588V[30-32]等)突变可能与其跨种间传播密切相关。此外,H7N9禽流感病毒发生相关位点突变后,对不同呼吸道上皮细胞受体的亲和力亦发生改变,这可能是造成其跨越种间屏障感染人体的重要原因之一。禽流感病毒主要结合分布在下呼吸道、细支气管和肺部的唾液酸α-2,3半乳糖苷受体(SAα-2,3,禽流感病毒受体),而季节性流感病毒主要结合分布在上呼吸道、气管和支气管的唾液酸α-2,6半乳糖苷受体(SAα-2,6,人流感病毒受体)[42-43]。但H7N9禽流感病毒兼具两者之长,可同时与呼吸道上皮细胞的SAα-2,3受体和SAα-2,6受体结合,具有“双受体结合”的特点[44]。与H5N1病毒相比,H7N9对人型受体具有更高的亲和力[35],这可能是导致其跨种间传播直接感染人体的关键原因之一。
3 人体第一道防线——黏膜上皮
黏膜上皮是人体与外界接触的第一道物理性和生物性防线。气道上皮细胞(airway epithelial cells,AECs)是呼吸道最表层的组织结构细胞,其组成包括支气管基底细胞、柱状纤毛上皮细胞、杯状细胞、Clara细胞,以及肺泡Ⅰ型和Ⅱ型细胞。AECs的基本生理功能有:分泌和转运黏液和抗菌肽,重吸收气道表面的液体,通过纤毛运动清除外来刺激物,与上皮下的淋巴血管组织共同维持免疫稳态等[45-46]。气道上皮是宿主抵御外界病原体及有害物质的物理-生物性屏障,可限制病毒在AECs中的复制和生长[47];其在固有免疫中亦发挥重要作用,可通过影响树突细胞(dendritic cells,DCs)、T细胞及B细胞的功能[48],启动和调节适应性免疫应答[49]。宿主免疫应答是决定疾病发病机制的关键,黏膜上皮的破坏启动了固有免疫和适应性免疫应答,促进了各种细胞因子、免疫细胞及抗体的产生。因此,宿主细胞被破坏后,机体免疫应答机制可能进一步加重上皮黏膜损伤。结合相关文献,探讨H7N9禽流感感染导致黏膜上皮损伤的分子机制以及AECs和黏膜上皮在介导病毒感染的免疫应答中的作用机制具有重要意义。
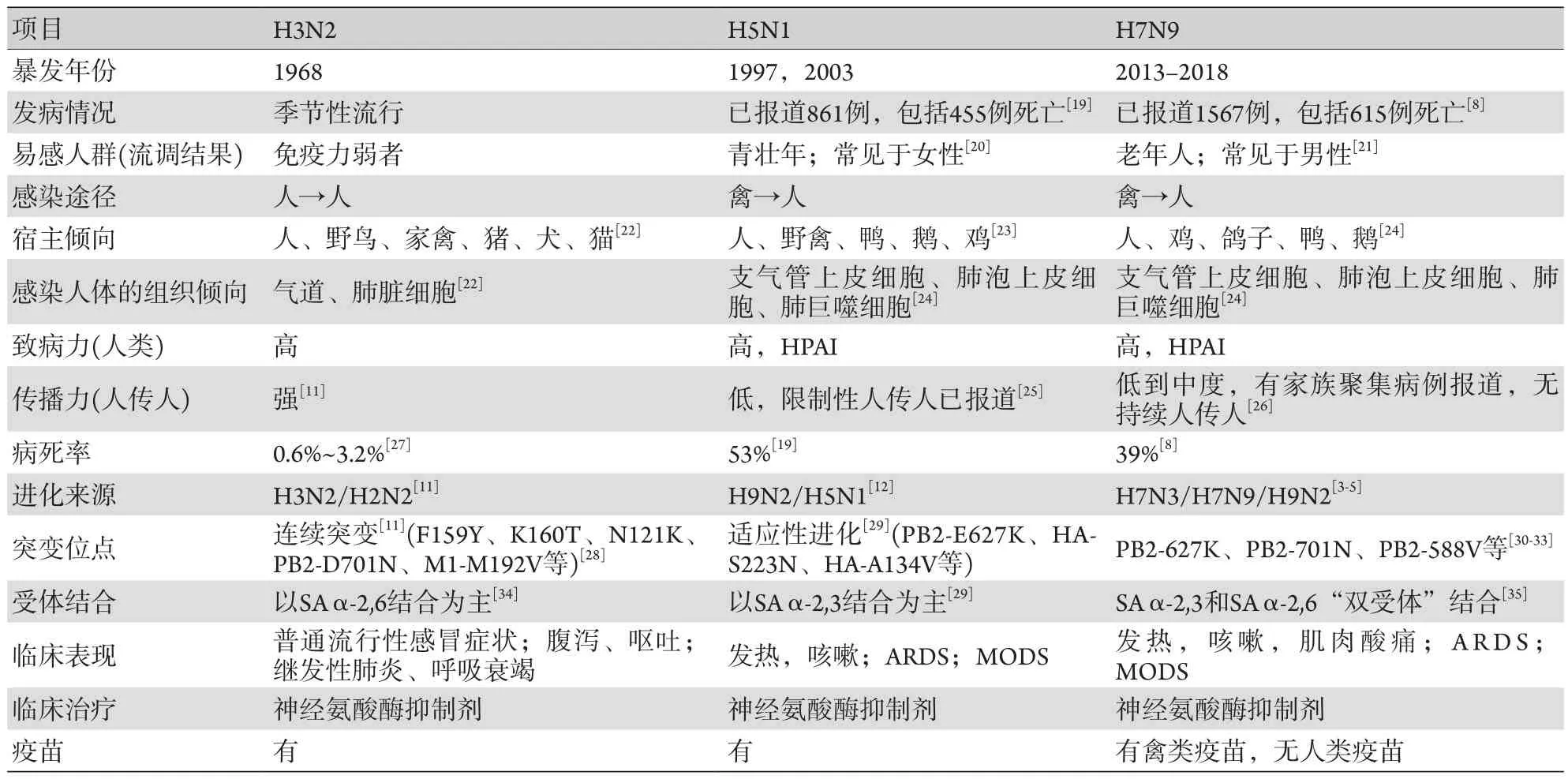
表1 代表性流感病毒的流行病学特征、感染后引起的症状及治疗策略Tab.1 Epidemiological characteristics and symptoms after infection and treatment strategies of representative influenza virus strains
气道黏膜上皮是病毒感染的第一道防线,呼吸道上皮细胞形成了一层巨大的黏膜表面,容易受到病原体的侵犯。禽流感病毒主要通过感染AECs,或者通过黏膜上皮的微擦伤感染黏膜下固有层。气道黏膜结构和功能的完整性对抵御禽流感病毒的入侵起着至关重要的作用[50]。H7N9禽流感病毒感染AECs致其凋亡及细胞内外结构破坏,进而导致黏膜上皮屏障破坏,严重影响机体疾病后续进展的严重程度和病程转归。气道黏膜上皮损伤的致病机制主要包括:①流感病毒直接诱导AECs凋亡和(或)坏死。流感病毒进入人体内首先感染AECs,破坏宿主细胞的前体mRNAs,抑制mRNAs的翻译,并通过细胞溶解或凋亡机制杀死宿主细胞[51]。研究表明,H7N9可感染纤毛细胞和非纤毛细胞,减少纤毛数量并损伤气道[52]。②流感病毒通过细胞因子间接诱导上皮细胞死亡。大量研究表明,禽流感感染患者体内血清细胞因子水平显著升高[53-55],如H7N9禽流感患者血清中干扰素γ诱导10 kD蛋白(10 kD interferon-gamma-induced protein,IP-10,又称CXCL10,C-X-C motif chemokine ligand 10)、巨噬细胞炎性蛋白(macrophage inflammatory protein,MIG)、单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)、白细胞介素[如(interleukin,IL)-6、IL-8]及干扰素-α(interferon-α,IFN-α)等细胞因子的表达水平显著高于健康人(未感染者)[35]。在宿主中,内皮细胞主要通过释放IL-6和IL-8等进一步增加禽流感诱导的细胞因子风暴的严重程度和AECs的损伤,加重黏膜上皮屏障损伤,但内皮细胞与黏膜上皮屏障的损伤无直接关系[56]。相比内皮细胞,AECs中肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)和CXC趋化因子家族8(C-X-C motif chemokine ligand 8,CXCL8)显著上调[56],表明AECs可能是驱动细胞因子风暴的另一关键因素。③AECs在感染早期即被诱导凋亡,在感染后期转变为焦亡(pyroptosis),其中Ⅰ型干扰素介导的JAK-STAT信号通路通过诱导Bcl-xl抗凋亡基因的表达抑制细胞凋亡[57],从而发展成焦亡,即病毒感染的炎症反应。④AECs间紧密连接的破坏导致黏膜上皮屏障损伤。连接上皮细胞的顶端连接复合体(apical junction complex,AJC)是上皮层形成流体屏障的一个重要部分,其由紧密连接蛋白(如claudins和zona occludens)和黏附连接蛋白(如E-cadherin)组成[58]。Short等[56]发现,禽流感导致AECs紧密连接的破坏可能与Claudin-4缺失有关。
4 AECs的免疫应答
病毒感染机体的过程较复杂,机体不能产生完全抵抗病毒入侵的免疫应答,在产生抗病毒反应的同时也会发生病理性损伤[59]。在病毒感染的AECs中,固有免疫感受器(如TLR7,RIG-1)表达,促进Ⅰ/Ⅲ型干扰素、促炎趋化因子(CXCL-9,CXCL-10,CXCL-11)和趋化因子配体5(C-C motif chemokine ligand 5,CCL5)过表达[60],发挥一定的抗病毒及介导炎症的作用。AECs作为病毒入侵的第一类靶细胞[61],是机体产生细胞因子的第一波驱动因素[56],也是机体抗病毒免疫应答的关键细胞(图1)。

图1 宿主体内免疫应答与病毒复制的关系Fig.1 Interaction of host immune response and virus replication
4.1 先天性免疫应答 先天性免疫系统主要通过模式识别受体识别病原相关分子模式来检测病毒感染,AECs表达了相关的免疫模式识别受体(pathogen recognition receptors,PRRs),包括Toll样受体(Toll-like receptors,TLRs)、NOD样受体(NOD-like receptor,NLR)、RIG-1样受体(retinoic acid-inducible gene I-like receptor,RLR)、C型凝集素、蛋白激酶受体(protein kinase receptor,PKR)和蛋白酶激活受体(protease activated receptor,PAR)等,与其相应的病原体相关分子模式(pathogenassociated molecular patterns,PAMPs)或损伤相关分子模式(damage-associated molecular patterns,DAMPs)作用后,激活AECs,产生多种分子[45]。Barjesteh等[62]在鸡气管上皮中发现,在鸡AECs中预先使用配体激活TLR3和TLR4,可活化干扰素调节因子7(interferon regulatory factor 7,IRF7)和NF-κB信号途径,激活巨噬细胞,产生抗病毒反应,从而降低禽流感在AECs中的复制。
4.1.1 单核-巨噬细胞 在病毒感染早期,单核-巨噬细胞被募集到肺组织。在宿主稳态状态下,AECs提供抑制信号来阻止肺巨噬细胞(alveolar macrophage,AM)激活;而在病毒感染状态下,抗炎信号被抑制从而启动抗病毒免疫反应。研究发现,一方面AM可直接吞噬禽流感病毒感染的AECs,同时产生肝细胞生长因子(hepatocyte growth factor,HGF)修复AECs;另一方面AM可通过抑制白三烯(leukotriene,LT)来保护Ⅰ型肺泡上皮细胞(type Ⅰ alveolar cells,AT1)免受病毒感染[63],而Ⅱ型肺泡上皮细胞(type Ⅱ alveolar cells,AT2)产生的粒细胞-单核细胞集落刺激因子(granulocytemacrophage colony stimulating factor,GM-CSF)可诱导AM的增殖和激活,抑制巨噬细胞的促炎作用,修复受损的上皮[64-65],对防止禽流感病毒感染引起肺炎起重要作用。H7N9感染单核细胞后,可通过抑制RIPK3通路降低Ⅰ型干扰素和细胞因子/趋化因子的早期表达,而MLKL蛋白的广泛磷酸化和caspase通路(caspases-3、8、9)的激活同时发生,提示凋亡和坏死途径同时被激活[66]。
4.1.2 DCs 肺DCs位于基底外侧,与AECs形成紧密连接,当病毒感染时,AECs刺激DCs获取病毒抗原并迁移至淋巴结激活CD8+T细胞免疫应答。DCs上的病原识别相关基因上调,表明机体固有免疫系统处于警戒状态,感染病毒的AECs直接或间接产生的细胞因子亦会对DCs诱导的Th细胞应答产生影响,促进抗病毒Th1或Th2反应。IFN-β主要由AECs和浆细胞样DCs表达[67]。在早期,AECs感染AIV而分泌IFN-β,可能在与其他未感染细胞或免疫细胞的沟通交流中起重要作用。DCs产生的高水平炎性细胞因子导致了肺组织的免疫损伤,同时AECs可诱导DCs免疫原性增强,可能是免疫抑制黏膜环境的一种补偿机制[68]。禽流感的非结构蛋白1(NS1)可诱导DCs产生TNF-α和IL-6[69],抑制宿主固有免疫反应,参与疾病的发生和发展。
4.1.3 中性粒细胞 中性粒细胞是在固有免疫系统中介导机体抗病毒和免疫损伤的重要免疫细胞,通过上皮细胞产生中性粒细胞趋化因子,机体依赖中性粒细胞上的CXCR2与AT1表达分泌的CXC因子结合,募集和激活中性粒细胞[70],而抑制促炎细胞因子(IL-8、IL-1β和TNF-α)释放和下调黏附分子表达可限制中性粒细胞迁移[71]。在炎症早期,中性粒细胞的募集和激活有助于机体形成有效的免疫应答,但由于AT1可自发性抑制TNF-α诱导的中性粒细胞凋亡,使感染组织的中性粒细胞寿命延长,这可能是后期感染组织免疫病理损伤加重的机制之一。此外,禽流感病毒感染可诱导支气管和肺泡上皮细胞产生成纤维细胞生长因子2(fibroblast growth factor 2,FGF2),并募集中性粒细胞[72],参与抗病毒反应。
4.1.4 自然杀伤(NK)细胞 NK细胞在免疫稳态和病毒免疫中发挥重要作用,其激活是通过激活或抑制受体[如杀伤lg样受体、CD16(Fc-γ)受体及NKp46[73]]与自身配体相结合调控的[74]。NK细胞通过调节IFN-γ的生成及脱颗粒(CD107a)[75]而发挥抗体依赖的细胞毒性作用(antibody-dependent cellular cytotoxicity,ADCC)[76]。
4.1.5 其他类型免疫细胞 一些固有样T细胞(innate-like T cells,ILCs)、γδT细胞[77]及黏膜相关不变T细胞(mucosal-associated invariant T cells,MAIT细胞)[78]可产生炎性因子和免疫调节因子,如IFN-γ、TNF-α、IL-22、IL-17、IL-33[79-91],其中IL-33可在感染禽流感病毒时保护肺上皮组织。黏膜途径激活ILCs后,细胞表面的肿瘤坏死因子相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)、CD49a和CD28表达均增加,IFN-γ分泌增加,同时可诱导免疫检查点分子糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoidinduced tumor necrosis factor receptor,GITR)和细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyteassociated antigen-4,CTLA-4)的表达[82]。程序性死亡受体1(programmed death receptor 1,PD-1)表达于髓样和淋巴样细胞,通过与配体PD-L1和PD-L2结合下调免疫应答信号。研究发现,禽流感病毒感染的AECs中PD-L1表达增加,免疫应答下调,是机体减轻免疫损伤的机制之一[81](表2)。

表2 先天性免疫应答相关细胞的炎症作用及分子机制Tab.2 Innate immunity and inflammatory response against viral infection
4.2 “细胞因子风暴”假说 近年来,“细胞因子风暴”假说被认为在HPAI病毒感染诱发的ARDS中起关键作用[84]。流感病毒感染的上皮细胞及多种免疫细胞可产生大量细胞因子,这些细胞因子具有多种生物效应,也是一大类免疫介质,因此细胞因子可作为固有免疫的一部分,介导抗病毒或Th1型免疫应答。同时,细胞因子亦可影响适应性免疫应答和疾病发生。在组织器官中,流感病毒感染可引起趋化因子(如RANTES、MCP-1、MCP-3、MIP-1α、IP-10和IL-8等)、促炎因子(如IL-1β、IL-6、IL-18和TNF-α等)[60]及抗病毒细胞因子(如IFN-α/β)的产生。干扰素的过度诱导和促炎因子的高表达均可导致组织严重损伤,阻碍有效的免疫调节。目前上述“细胞因子风暴”的机制尚不明确。Krischuns等[67]发现,TRIM28是HPAIV感染期间导致IFN-β和促炎细胞因子水平升高的关键免疫调节因子,其由PKR、p38 MAPK和MSK1多个信号级联诱导;Chen等[85]发现,AECs上某些细胞表面黏蛋白(如MUC15)与细胞因子/趋化因子、表皮生长因子受体(epidermal growth factor receptor,EGFR)及磷酸化ERK信号有关,其表达与免疫激活的高峰相一致。在不同亚型禽流感病毒诱导的各种细胞因子和趋化因子中发现,Ⅰ型和Ⅲ型干扰素水平有显著差异[86],H3N2可诱导强烈的IFN-β和IFN-λ应答,H1N1次之,而H5N1和H7N9仅可引起Ⅰ型和Ⅲ型干扰素水平的微小改变。有研究表明,IL-6和趋化因子(CCL-2/MCP-1、CCL-4/MIP-1β、CXCL-8/IL-8、CXCL-9/MIG和CXCL-10/IP-10)与禽流感(H5N1和H7N9)和人流感(H1N1和H3N2)病毒的致病性有关,CCL-2/MCP-1、CXCL-8/IL-8、CXCL-9/MIG和CXCL-10/IP-10与禽流感感染引起的死亡率显著相关[87]。细胞激酶在禽流感感染的免疫调节中发挥重要作用,可通过多种禽流感蛋白磷酸化所需的酶来影响病毒复制和抑制先天性免疫应答,如激酶PKC、ERK、PI3K和PAK可调节病毒的进入和复制,激酶IKK、JNK和p38 MAPK可介导调节病毒趋化因子和细胞因子表达的信号级联反应等[88]。
4.3 适应性免疫应答 机体固有免疫系统在禽流感感染中起重要作用,同时,适应性免疫应答在H7N9禽流感病毒感染中亦发挥着举足轻重的作用。如CD8+T细胞在降低疾病严重程度和促进机体恢复中发挥重要作用[89-90]。前文提到,H7N9禽流感病毒感染机体后,首先通过AECs感染此驱动环节,引起后续一系列固有免疫系统的免疫细胞发挥作用,如巨噬细胞、DCs、中性粒细胞等,产生大量细胞因子和趋化因子。而固有免疫环节中的细胞因子和趋化因子可继续募集、激活和协调T淋巴细胞,从而发挥其免疫学功能[91]。禽流感与上呼吸道DCs相互作用,DCs迁移至区域淋巴结后即启动初级或次级免疫应答,禽流感病毒蛋白在感染的细胞胞质中,经过溶酶体处理后递呈多肽,与MHC Ⅰ类和Ⅱ类蛋白结合,从而被CD8+CTLs和CD4+Th细胞识别。
H5N1和H7N9感染人可导致严重的临床表现及较高的致死率,主要是由于人体内没有预先存在的抗禽流感特异性抗体[6]。CD8+T细胞是适应性免疫应答的主要组成部分,对病毒的清除发挥重要作用[92],但CD8+T细胞不可在无抗体的情况下清除病毒,除非宿主本身预存了较高水平的先天的CD8+T细胞。研究发现,H7N9禽流感病毒感染的存活者体内存在长期抗体和记忆性T细胞反应[93],表明CD4+Th细胞和CD8+CTLs在HPAIV感染中起着重要的保护作用。从H7N9禽流感病毒感染中恢复的个体体内显现出强大的IFN-γ+CD8+T细胞应答[94],而死于感染的个体则很少或未产生IFN-γ诱导的细胞。研究发现,DCs中的IFN-γ信号通路对禽流感特异性的CD8+T细胞起重要的保护作用,可通过IL-10[95]调控CD103+DCs的迁移功能,获得最佳的抗病毒CD8+T细胞应答[96]。另外,DCs可能受NLRC4调节,FasL+DCs增加,导致禽流感特异性CD4+T细胞死亡,影响保护性T细胞反应[97]。而NLRC5通过调节造血细胞的MHC-Ⅰ,减少CD8+T细胞的表达,同时还调节多种免疫信号途径,在限制病毒复制和促进病毒清除方面起作用[98]。CD4+Th细胞在感染或免疫后可产生对记忆性CD8+T细胞的保护作用[92,99]。宿主对H7N9的T细胞表位的耐受性可能影响Th细胞的辅助作用,抑制或调节效应T细胞反应[100]。有研究发现,H1N1和H3N2流感病毒特异性的CD8+T细胞与H7N9禽流感病毒存在交叉反应性[101],这些交叉反应的CD8+T细胞能减轻疾病的严重程度(图2)。
5 预防与治疗
目前,新出现的高致病性甲型禽流感病毒(H7N9)对公共卫生和家禽业是一个巨大的挑战,人类感染严重的H7N9禽流感病毒使世界各地的公共卫生当局对人类流感大流行的潜在发展保持高度警惕。
接种疫苗是预防流感最有效的干预措施,各种平台已经生产了大量的H7N9候选疫苗。由于禽流感病毒持续发生抗原转换和漂移,使病毒可逃脱早先疫苗诱导的免疫保护[102]。而动物和人类的免疫实验表明,H7N9疫苗的免疫原性很差[103]。各种预防人感染H7N9的疫苗仍在设计和研制中,如针对黏膜免疫的疫苗(可加强机体第一道防线)[104]。值得庆幸的是,2017年9月针对鸡的H5/H7二价灭活疫苗出现,禽类接种该疫苗后,H7N9病毒的分离率下降了93.3%,而之后一年里仅出现3例H7N9感染[105]。

图2 机体内应答流感病毒的适应性免疫反应Fig.2 Adaptive immune response to influenza virus.
抗病毒药物是目前临床治疗流感病毒感染非常有效的方法之一。目前,临床上对禽流感的治疗策略包括对症支持治疗、抗病毒、保证组织供氧及维持脏器功能等。H7N9病毒感染患者病情发展较快,尤其是老年患者,常伴有严重的低氧血症和MODS。研究表明,减少继发性细菌感染可有效降低病死率[10]。临床推荐早期应用神经氨酸抑制剂(如奥司他韦)进行抗病毒治疗,以减少病毒复制,提高生存率,疑似病例可在48 h内予奥司他韦进行治疗。近年来,随着抗炎通路及分子机制研究的日益成熟,从抗炎方面治疗或延缓病毒引起的呼吸道疾病引起了科学家和临床医师们的广泛关注。IFN、氧化应激、NFR2-HO-1和TLR-MAPK/NF-κB等信号通路已被证实与IAV复制和流感性肺炎有关。如卡帕利洛苷A能抑制宿主IFN信号通路,降低STAT1磷酸化水平以及IFN-β和IL-29的表达,从而抑制IL-6、IP-10、MIG和RANTES/CCL-5的表达[106]。新型聚酮化合物B(PPQ-B)可能下调NF-κB和MAPK信号通路,显著降低IAV感染的肺组织和A549细胞中炎性因子TNF-α、IL-6、RANTES和KC的表达[107]。姜黄素能显著抑制IAV诱导的氧化应激,以及TLR2、4、7,Akt,p38/JNK,MAPK和NF-κB通路的激活[108],还可在体内诱导血红素加氧酶-1的表达,减轻IAV对肺组织的损伤[109]。综上所述,相关药物可通过抑制局部炎性细胞因子的产生来调节IAV感染后的免疫应答,减轻IAV感染引起的炎症反应,抗炎药物可作为抗病毒治疗IAV感染的辅助药物。
持续的基因突变、重组和选择压力使得禽流感病毒得以生存,并增加了持续威胁人类的新型禽流感病毒出现的可能性,导致科学家们较难准确预测和预防新型禽流感病毒。近年来,关于AECs在病毒感染气道过程中与机体各种免疫细胞发生相互作用的研究,有利于重新评估AECs在呼吸道病毒感染中的价值。一方面,利于了解高致病性H7N9禽流感病毒的致病机制,包括:①黏膜屏障受损,上皮细胞死亡或缺失;②“细胞因子风暴”不可逆转地加剧黏膜及肺损伤;③机体缺乏H7N9的预存抗体和记忆性T细胞,T细胞活化严重受损。另一方面,利于开发新的治疗策略,从而促进有效应答,或抑制呼吸道病毒感染过程中严重的免疫病理损伤。禽流感病毒的快速进化/演化,增加了研发禽流感特异性疫苗的难度,目前抗病毒药物的疗效较为有限,加入抗炎药物作为辅助治疗有一定效果。对病毒跨种间传播和感染机制的深入研究,可为病毒靶向治疗提供新的依据。

