输尿管软镜碎石术治疗铸型肾结石经皮肾镜碎石术后残石的临床研究
尹永华,张华杰,文博
(广州医科大学附属深圳沙井医院 泌尿外科,广东 深圳 518104)
铸型肾结石是泌尿外科常见疾病,主要治疗方法为经皮肾镜碎石术(percutaneous nephrolithotomy,PCNL),该方法治疗效果确切、结石清除率高[1],但一期手术无可避免出现术后残石等问题。目前,治疗铸型肾结石PCNL术后残石常为二期PCNL手术,该术式结石清除率高、手术时间短[2]。铸型肾结石术后残石位置较复杂,二期PCNL难以经原通道处理所有结石,常需重新建立单个或多个经皮肾通道,但建立多个经皮肾通道易出现术中术后大出血、术后发热和术后疼痛等并发症[3]。因此,需要更为安全的手术方式治疗铸型肾结石PCNL术后残石。输尿管软镜碎石术(retrograde intrarenal surgery,RIRS)为治疗肾结石的新方法,其清石效率较高,同时具有术中术后并发症少和术后恢复快的优势[4]。本文回顾性分析本院68例铸型肾结石PCNL术后残石患者的临床资料,比较二期PCNL与RIRS治疗铸型肾结石PCNL术后残石的安全性及有效性,为临床治疗铸型肾结石PCNL术后残石提供一定的依据。
1 资料与方法
1.1 一般资料
回顾性分析本院2015年7月-2018年8月68例铸型肾结石行PCNL术后残石患者的临床资料,根据患者及家属的选择分为两组。PCNL组是二期手术方式为PCNL的36例患者,RIRS组是二期手术方式为RIRS的32例患者。两组患者的基本情况包括患者年龄、性别、体质指数(body mass index,BMI)、术前CT确诊为单侧肾结石、残石数目(仅考虑残石直径≥0.6 cm)、一期术后残石主要分布位置、一期术后最大残石直径、术前血红蛋白测定。入准标准:患者一期PCNL术后3或4 d复查CT提示术后残石≥0.6 cm,二次手术前常规复查血常规、肝肾功能、电解质、凝血功能以及尿培养和尿常规,合并感染者予以抗感染治疗2周至尿培养阴性。见表1。

表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.2 手术方法
两组手术均由同一位临床经验丰富的泌尿外科医生完成。
1.2.1 一期PCNL采用气管插管全麻或腰硬联合麻醉。麻醉成功后患者取截石位,在肾镜观察下,经尿道进入膀胱置入F5输尿管导管。改俯卧位,于B超定位下选取合适的位置建立经皮肾镜通道(常为患肾中盏),由F10顺序扩张通道至F24,置入F24工作鞘,使用弹道碎石机进行碎石。碎石后,检查无明显残留结石,或仅剩余因角度原因可见到而碎石杆触不到的结石。沿导丝顺行置入F5双J管做输尿管内支架,退出斑马导丝,沿工作鞘置入肾造瘘管,退出工作鞘,缝合皮肤切口两针并固定肾造瘘管。术后予以抗感染、止血、止痛等对症支持治疗,术后3至4 d复查腹部CT,明确术后残石的大小、数量及位置。术后1至2周后,残留结石行二期手术治疗。
1.2.2 二期 PCNL组采用气管插管全麻或腰硬联合麻醉。麻醉成功后患者取截石位,在肾镜观察下经尿道进入膀胱,先拔除双J管再置入F5输尿管导管;改俯卧位。沿造瘘管插入斑马导丝至肾盂,拔出造瘘管,将F24工作鞘沿斑马导丝置入原经皮肾通道,然后将肾镜顺导丝置入工作鞘,肾镜观察肾盂及肾盏有无结石,若能观察且接触结石,则进行碎石;若未能观察结石或不可接触,则根据复查影像资料找到残石位置,联合B超定位下建立经皮肾镜通道,再由F10顺序扩张通道至F24,置入F24工作鞘(经原通道12例,微通道10例,标准通道14例;其中有4例多发残石建立1个标准通道和1个微通道),将肾镜置入工作鞘,使用弹道碎石机进行碎石。碎石后,沿导丝顺行置入F5双J管做输尿管内支架,退出斑马导丝,沿工作鞘置入肾造瘘管,退出工作鞘,缝合皮肤切口两针并固定肾造瘘管。术后3至4 d再次复查泌尿系CT,仍有残石≥0.4 cm,可认为残石未清除,根据结石大小,选择行体外冲击波碎石(extracorporeal shock wave lithotripsy,ESWL)或择期行三期手术,术后视小便颜色拔除肾造瘘管。术后1个月来院复查CT,并行双J管拔除。
1.2.3 二期RIRS组气管插管全麻后截石位,消毒,铺巾。打开肾造瘘管,接引流袋(有2例多发残石采用斜仰卧位双镜联合碎石)。将输尿管镜经尿道置入膀胱,在输尿管镜的观察下,拔除预先留置的双J管,向患肾输尿管开口置入斑马导丝,F14扩张鞘沿着斑马导丝置入输尿管上段近肾盂口下方水平。退出斑马导丝,更换为Olympus P3纤维输尿管软镜并沿着扩张鞘进入肾盂,寻找结石,并使用钬激光光纤进行碎石。碎石后,留置斑马导丝,然后退出纤维输尿管软镜及扩张鞘。更换输尿管镜,在斑马导丝引导下,留置F5双J管,最后退出输尿管镜及斑马导丝,留置尿管,结束手术。术后1或2 d再次复查泌尿系CT,仍有残石≥0.4 cm,可认为残石未清除,根据结石大小,选择行ESWL或择期行三期手术,术后视小便颜色拔除肾造瘘管。术后1个月来院复查CT,并行双J管拔除。
1.3 数据收集和疗效评价
术中出血量:将手术中的含血冲洗液收集并测量其总量,抽取5 mL混匀后的冲洗液,测定冲洗液血红蛋白浓度(采用全自动血细胞分析仪)。出血量计算公式:出血量(mL)=冲洗液中血红蛋白浓度(g/L)×冲洗液总量(L)/[术前血红蛋白浓度(g/L)×1 000]。
记录和比较两组患者的手术时间、术后出血量、二期手术清石率、三期手术/ESWL治疗率、术后24 h血红蛋白平均下降量、术后24 h疼痛视觉模拟评分(visual analogue score,VAS)、术后平均住院时间、输血和发热等并发症发生情况。
1.4 统计学方法
采用SPSS 25.0统计软件处理数据,计数资料以例表示,组间计数资料比较采用χ2检验;计量资料采用均数±标准差(±s)表示,进行t检验;等级资料采用秩和检验,P< 0.05为差异有统计学意义。
2 结果
2.1 两组患者二期手术临床资料比较
2.1.1 手术相关指标所有手术均顺利完成,无1例出现严重并发症。两组患者均取得良好的清石率,清石率分别为RIRS组87.50%和PCNL组91.67%,差异无统计学意义(P> 0.05)。在术后平均住院时间、术后出血量、术后24 h血红蛋白平均下降值、术后24 h VAS等方面,RIRS组均明显优于PCNL组,差异有统计学意义(P< 0.05),在手术时间方面,RIRS组手术时间明显长于PCNL组,差异有统计学意义(P< 0.05)。术后复查CT,PCNL组有3例患者(2例因多通道术中出血终止手术,1例因术中凝血块阻碍视野而碎石不充分)的残石> 0.4 cm需进一步治疗,三期手术/ESWL治疗率为8.33%;RIRS组有4例患者(4例下盏残石因肾盂漏斗部夹角小而碎石不充分)需进一步治疗,三期手术/ESWL治疗率12.50%,两组三期手术/ESWL治疗率比较,差异无统计学意义(P> 0.05)。见表 2。
2.1.2 不同结石分布清石率PCNL组14例下盏残石均碎石满意,无需再治疗(三期手术/ESWL率0.00%,0/14),RIRS组4例下盏残石因肾盂漏斗部夹角小而碎石不充分需进一步治疗(三期手术/ESWL率40.00%,4/10),两组患者下盏结石三期治疗率差异有统计学意义(χ2= 6.72,P= 0.010),PCNL组下盏清石率明显高于RIRS组。RIRS组上、中盏结石22例,三期治疗率0.00%(0/22),下盏结石10例,三期治疗率40.00%(4/10),上、中盏结石与下盏结石三期治疗率比较,差异有统计学意义(χ2= 10.06,P= 0.002)。
2.2 两组患者二期手术术后Clavien-Dindo外科手术并发症分级比较
本研究并发症比较见表3,Clavien-Dindo外科手术并发症分级比较见表4。在总并发症发生率方面,RIRS组发生4例,发生率12.50%(4/32);PCNL组发生14例,发生率38.89%(14/36),RIRS组总并发症发生率明显少于PCNL组(P< 0.05)。其中,RIRS组术后发热4例,未出现石街和败血症;PCNL组术后发热8例,6例因出血而给予相应处理(2例患者输注浓缩红细胞2~4 u;2例多通道患者因术中出血影响视野,终止手术;2例术后迟发性出血,予以手术切口缝合、沙袋加压、绝对卧床等对症保守治疗后好转),所有出血患者经治疗后均无需介入治疗,随访未发生再次出血。RIRS组无1例因术中出血影响视野而终止手术,无输尿管撕脱/穿孔等并发症,术后亦无迟发性出血。两组患者术后复查CT均未见结石残留。

表3 两组患者并发症比较Table 3 Comparison of complications between the two groups
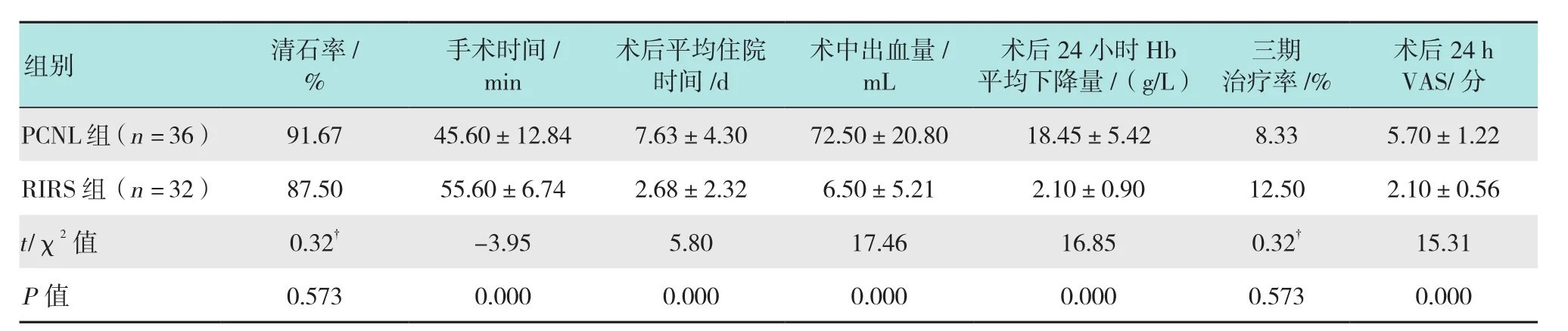
表2 两组患者二期手术相关资料比较Table 2 Comparison of two-stage surgery related data between the two groups

表4 两组患者Clavien-Dindo外科手术并发症分级比较 例Table 4 Comparison of Clavien-Dindo classification of surgical complications between the two groups n
3 讨论
铸型肾结石为泌尿系结石中的复杂性结石[5],常填充肾盂和几个肾盏,甚至全部肾盏,若存在梗阻、感染等问题,可引起肾功能损伤,甚至并发严重感染。因此,检查发现铸型结石时需及时手术治疗,以清除结石、保护肾功能。同时,铸型肾结石常出现结石复杂、结石巨大、取石困难、无肾积水或严重肾积水等问题,导致治疗难度大,常需多次治疗才能彻底清除结石,目前的治疗方案主要为PCNL。因铸型肾结石常填充多个肾盏,单通道PCNL难以处理全部结石,需建立多个通道或者多期手术治疗[6]。术后残石是铸型肾结石PCNL手术难以避免的问题,有资料[7-8]显示,铸型肾结石一期碎石术后残石率为5.2%~22.0%,术后残石处理为铸型肾结石手术的重点之一。目前,RIRS已成为治疗肾结石的有效方法,具有碎石效果确切、清石率高和并发症少等特点,已广泛应用于各种上尿路结石的治疗。欧洲泌尿外科指南[9]指出,RIRS是治疗1.0~2.0 cm肾结石的一线方案,是治疗2.0~3.0 cm结石的选择方案之一。有研究[10]指出,RIRS治疗1.0~2.0 cm肾结石与微通道经皮肾镜取石术(microchannel percutaneous nephrolithotomy,MPCNL)疗效相当,也有相关研究[11]尝试使用RIRS治疗铸型肾结石,取得理想的治疗效果。因此,本研究结合输尿管软镜的特点,探讨二期RIRS与二期单通道/多通道PCNL治疗铸型肾结石PCNL术后残石的相关问题。
铸型肾结石术后残石为一期单通道PCNL碎石的结石术后残留,常为一期单通道PCNL无法观察或无法接触的结石,往往分布于与原通道平行的肾盏。若二期PCNL在一期手术原通道进行碎石手术,获取的手术视野与一期手术视野无明显差异,常常无法观察全部残石,以致无法处理全部残石,碎石效果欠佳。因此,二期PCNL处理铸型肾结石PCNL术后残石,往往需建立多个通道再进行碎石。有研究[3,12]认为,建立多个经皮肾通道对肾脏的损伤较大,术后出血明显,且建立多通道难度大,副损伤及并发症较一期PCNL手术增多。本研究也发现多通道穿刺成功率不高,一个新经皮肾通道往往需要穿刺1至3次;同时,在建立PCNL多通道时易因穿刺肾脏致术中出血,PCNL术中形成的部分凝血块常包裹结石或阻挡术野,影响手术操作,甚至中止手术,降低手术清石率。本研究PCNL组有2例患者术中建立多通道过程中出现明显出血而停止手术,1例患者因术中凝血块阻碍视野而碎石不充分。因此,3例患者需行三期手术/ESWL治疗。
与PCNL组比较,RIRS组无需建立经皮肾通道,输尿管软镜因其构造的特点,可顺应输尿管-肾盂结构到达各个肾盏,顺利清除各肾盏结石,且术后无需留置肾造瘘管。在术中术后出血方面,RIRS组明显优于PCNL组,术中出血量分别为(6.50±5.21)和(72.50±20.80)mL、术后24 h血红蛋白平均下降值(2.10±0.90)和(18.45±5.42)g/L,差异均有统计学意义。一期手术术后保留肾造瘘管,二期RIRS术中灌注于肾盂的灌注液能通过肾造瘘管排出,可避免术中肾盂内压过高,术者术中可根据手术需求增加肾盂灌注量,冲走残石,以提高碎石效率、缩短手术时间。二期RIRS术中出现出血时,亦可加大肾盂灌注,冲走血块,保持术野清晰,提高手术效率。本文二期RIRS清石率(87.50%)与PCNL组(91.67%)比较,差异无统计学意义,但RIRS组中有4例患者需要进行三期手术或ESWL治疗,4例患者均为下盏残石碎石不充分。笔者认为,因肾盂与肾下盏夹角过小,盏颈漏斗部较长,输尿管软镜无法到达下盏残石处,而导致清石不彻底。本研究中,PCNL组的下盏结石清石率高于RIRS组(χ2= 6.72,P= 0.010),而RIRS组的上、中盏结石的清石率高于下盏结石(χ2= 10.06,P= 0.002)。结合临床经验,笔者认为,RIRS处理中上盏残石清石效果理想,而处理下盏残石成功率低。MOLIMARD等[13]研究也显示,肾下盏的清石率要明显低于中、上盏,肾盂与下盏夹角越小、盏颈漏斗部越长,碎石成功率越低。
既往文献[14-15]报道,RIRS术后并发症主要为术后尿源性脓毒血症,RIRS术中会出现肾盂内压增高,使得手术时间延长、灌注液吸收增多,导致病菌或内毒素进入循环系统,从而更容易发生尿源性脓毒血症。有研究[16]建议,术中应避免输尿管软镜手术时间过长、水流量过大,以减少脓毒血症的发生。而本研究RIRS组未出现脓毒血症等严重并发症,笔者认为,由于一期PCNL术后肾造瘘管存在,RIRS术中灌注于尿路系统的液体可通过肾造瘘管排出体外,避免肾盂压力升高,降低了脓毒血症的发生风险,与徐刚等[17]的研究一致。同时,因肾造瘘管连接于引流袋,RIRS碎石过程中释放的细菌可被冲出肾盂,减少致病菌和内毒素进入血循环,从而降低脓毒血症发生率。本文PCNL组也未发生尿源性脓毒血症,笔者认为,PCNL建立多个取石通道,有利于肾盂内压降低,加快排出含菌冲洗液,缩短手术时间,可减少中毒性休克并发症的发生率,与ZHONG等[18]的研究一致,同时,取石钳器械取石的过程中,可减少术中肾内压力,有利于致病菌或内毒素经冲洗液顺利流出体外,减少脓毒血症的发生,与NEGRETE-PULIDO等[19]的研究一致。
在手术时间方面,RIRS可提高术中水流灌注量及速度,冲走碎石,保持手术视野清晰,提高手术速率,进而降低手术时间。PCNL碎石效率高,较大残石也可通过经皮肾通道取出,手术时间短。但本组的数据显示,PCNL组优于RIRS组[(45.60±12.84)和(55.60±6.74)min],差异有统计学意义。铸型肾结石术后残石常分布于不同肾盏,二期PCNL常需建立2至3个经皮肾新通道,甚至要建立更多的经皮肾新通道,手术时间也随之延长。虽然两组总平均手术时间差异有统计学意义,但PCNL组中有16例患者因术中需建立2~4个经皮肾新通道,其手术时间均多于RIRS组的平均手术时间。
RIRS顺应人体自然腔道治疗结石,避免经皮穿刺至肾盂,减少患者损伤及减轻疼痛,还可降低手术出血风险,术后恢复快。而二期PCNL常需建立2至3个经皮肾新通道,术后需留置多根造瘘管,引起术后明显疼痛,术后恢复时间延长。本研究RIRS组术后疼痛程度和术后恢复程度均优于PCNL组,与以往文献[20]报道RIRS术后疼痛明显轻于MPCNL相似。
综上所述,在处理铸型肾结石PCNL术后残石时,RIRS与二期单通道/多通道PCNL均可有效清除残石,RIRS处理中上盏残石清石效果理想,处理下盏残石时如肾盂漏斗部夹角小而成功率会较低。相比二期单通道/多通道PCNL,RIRS具有术中出血少、手术创伤小、术后疼痛轻、术后住院时间短和手术并发症少等优势。因此,在治疗铸型肾结石PCNL术后中上盏残石时可优先考虑RIRS。

