曲美他嗪对心肌梗死模型大鼠心肌细胞凋亡、自噬以及心功能的保护作用
心肌梗死是心内科常见的临床急症,心肌细胞的再生能力有限,缺血坏死后导致后期心室重构,从而导致心功能不全或者心力衰竭发生。快速恢复血供,预防后期心室重构是目前心肌梗死治疗的主要方法[1],虽然近年来干细胞移植、基因编程等治疗方法应用到心肌梗死的治疗研究中,但是药物治疗仍然是保护心肌的常用方法[2]。临床研究显示曲美他嗪在冠状动脉血运重建过程中可以发挥作用,促进心肌代谢及心肌能量的产生[3];临床和实验研究均显示曲美他嗪可以保护缺血心肌细胞,常用于心肌梗死的治疗[4]。本研究通过构建心肌梗死大鼠模型,观察曲美他嗪对模型大鼠心肌细胞凋亡、自噬以及心功能的保护作用。
1 材料与方法
1.1 实验动物 60只SPF级成年雄性SD大鼠,由海南医学院动物实验中心提供,体质量190~220 g,清洁级适应性喂养3 d后,建立心肌梗死模型。
1.2 实验造模 戊巴比妥钠腹腔注射麻醉,插管连接小动物呼吸机,心电图机连接大鼠四肢,左侧胸前区备皮消毒后胸骨左侧第3肋和第4肋间切开皮肤,依次分离肌肉、组织,40只SD大鼠暴露心脏后用6-0号无创缝合线于肺动脉圆锥与左心耳之间距离主动脉根部 1 mm处结扎前降支,缝线下方心肌变白、运动减弱,心电图Ⅱ导联见ST段弓背向上,为造模成功,将40只造模成功SD大鼠随机分为对照组和曲美他嗪组。另外20只SD大鼠作为假手术组,仅仅在前降支下穿线不做结扎。所有模型鼠恢复自主呼吸后拔管撤机。假手术组和对照组不做处理,曲美他嗪组给予10 mg/(kg·d)曲美他嗪灌胃,连续给药28 d。
1.3 心功能检测 手术前和术后第28天,使用彩超,频率13 MHz,测定左心室收缩末期内径(LVESD)、短轴缩短分数(FS) 和射血分数(EF)。
1.4 心肌细胞凋亡原位检测 TUNEL 法检测细胞凋亡,试剂盒购自美国Millipore公司,按照说明书操作。第28天试验完成后断颈处死所有动物,心肌梗死区取材,常规石蜡包埋、切片后使用TUNEL试剂盒染色,凋亡细胞染为棕色,200×显微镜下计数凋亡细胞,计算凋亡指数(PI)=(凋亡细胞数/总细胞数)×100%。
1.5 心肌细胞自噬蛋白的Western Blot检测 第28天试验完成后断颈处死所有动物,心肌梗死区取材,液氮下研磨,提取细胞总蛋白,80 V SDS-PAGE凝胶电泳蛋白2 h后,100 V电转蛋白至PVDF膜,加入LC3Ⅱ抗体(美国cell signal公司)孵育过夜后,加入二抗,2 h,化学发光法检测目的蛋白的表达,胶片曝光显示目的条带,β-actin作为内对照。Bandscan软件扫描后计算LC3Ⅱ蛋白的相对表达量,即相对灰度值。
1.6 统计学处理 所有数据输入SPSS 16.0软件进行统计分析。多组间均数比较进行方差分析,组间两两比较使用LSD-t检验;计数资料应用χ2分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组术后存活率比较 假手术组大鼠无死亡,存活率为100.0%,对照组死亡9只,存活11只,存活率为55.0%,曲美他嗪组死亡4只,存活16只,存活率为80.0%。3组间死亡率比较差异有统计学意义(P<0.05)。
2.2 3组术后心肌凋亡指数比较 假手术组、对照组和曲美他嗪组术后第28天缺血心肌细胞PI值分别为(0.76±0.23)%、(21.52±6.57)%和(12.38±2.15)%,3组间比较差异有统计学意义(P<0.01)。详见图1。
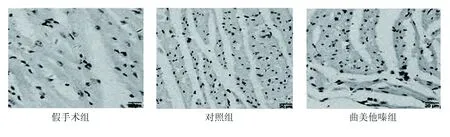
图1 心肌细胞凋亡的TUNEL检测
2.3 3组术后心肌自噬蛋白LC3Ⅱ表达的比较 经灰度扫描后,假手术组、对照组和曲美他嗪组心肌自噬蛋白LC3Ⅱ相对灰度值分别为0.17±0.03,0.46±0.12,0.68±0.15,各组间比较差异有统计学意义(P<0.01)。详见图2。
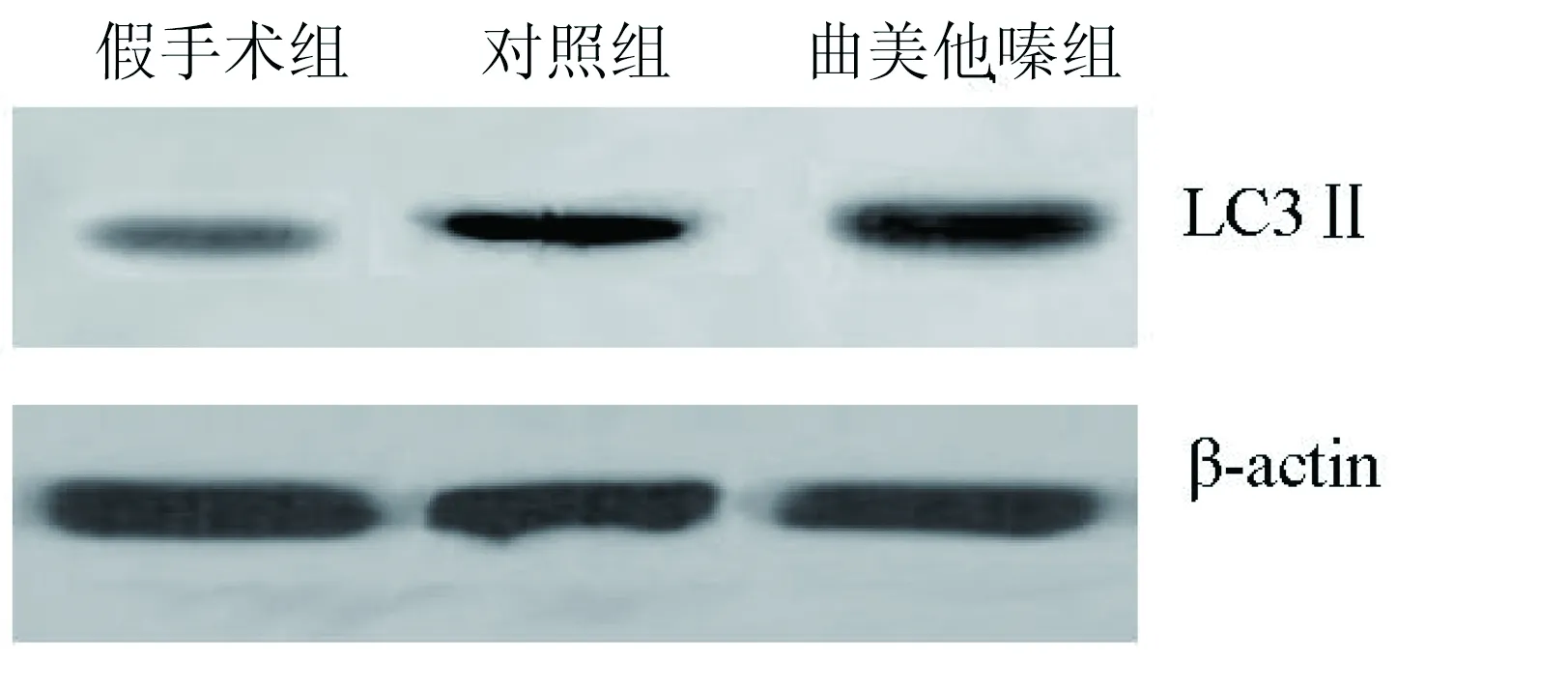
图2 3组心肌自噬蛋白LC3Ⅱ的表达比较
2.4 3组大鼠心功能比较 3组手术前LVESD、FS 和EF比较差异无统计学意义(P>0.05),术后28 d,假手术组LVESD、FS和EF变化与术前比较差异无统计学意义(P>0.05),但对照组和曲美他嗪组LVESD较术前升高(P<0.05),FS和EF减低(P<0.05),且术后28 d曲美他嗪组LVESD低于对照组(P<0.05),而FS和EF高于对照组(P<0.05)。详见表1。

表1 3组LVESD、FS和EF指标比较(±s)
与假手术组比较,①P<0.05,②P<0.01;与对照组比较,③P<0.05;与本组手术前比较,④P<0.05。
3 讨 论
心肌细胞属于稳定细胞,基本不能再生,缺血后心肌细胞凋亡是心肌细胞损伤或丢失的主要表现形式[4],诱发了心室重构加剧以及后期的心功能不全[5]。孙静等[6]应用Vinexin-β 基因敲除小鼠发现抑制心肌细胞凋亡后,可以减少梗死心肌面积以及保护心功能。
细胞自噬的诱导与调节是一个非常复杂的过程,自噬在心肌细胞能量代谢中占有重要地位,功能紊乱或受损细胞质成分在自噬溶酶体作用下分解为能量物质,虽然目前对心肌梗死中自噬功能作用仍存有争议,但多数研究认为适当的自噬对心脏损伤的修复以及功能起到保护作用。心肌缺血时ATP水平降低,细胞能量感受器AMPK-mTORC1-ULK1 信号通路激活,激活位于内质网的beclin-1蛋白,导致了自噬[7]。自噬对心肌的相关保护机制为:自噬分解受损细胞器给细胞提供能量,可以缓解受损心肌细胞的能量危机;抑制受损的线粒体诱发的过量活性氧产生,促进功能紊乱线粒体的更新;清除过激反应蛋白维持细胞稳态[8]。心肌梗死时常常表现为心肌细胞的自噬活动增强,就可以释放出大量的能量物质,补充心肌缺血造成的能量危机[9]。自噬体膜型(LC3Ⅱ)是自噬标志物,LC3-Ⅱ增多说明自噬过程激活,班努·库肯等[10]研究发现,心肌梗死大鼠模型自噬相关蛋白LC3Ⅱ的表达显著增加,参与受损心肌的修复。
近期有研究显示,心肌细胞凋亡和自噬可以通过一些通路联系起来。Wang等[11]研究显示当心肌细胞自噬减少时凋亡就会增加;Zhang等[12]在糖尿病性心肌病大鼠模型中也发现早期给予曲美他嗪可以降低心肌细胞凋亡,增加自噬。本研究探讨了心肌细胞缺血时曲美他嗪对受损细胞凋亡和自噬的调节作用,为心肌梗死的治疗提供新思路。LC3Ⅱ是一种自噬激活的标志性蛋白,其水平升高可以反映细胞自噬的增加,本研究观察到曲美他嗪组LC3Ⅱ表达水平高于对照组,说明曲美他嗪加强了缺血心肌细胞自噬的激活,增强缺血心肌细胞的保护性自噬反应。谭淑娜等[13]在心力衰竭大鼠模型中也发现了曲美他嗪可以升高缺血心肌细胞的自噬应激反应,发挥心功能保护作用。本研究显示曲美他嗪组对LVESD、FS和EF的改善作用优于对照组,说明了曲美他嗪有利于心肌梗死大鼠心功能的修复。
综上所述,曲美他嗪有助于大鼠心功能恢复,减少心肌细胞凋亡和增加心肌自噬。

