油菜秸秆对5种杂草种子萌发和生长的化感效应
李淑英 路献勇 程福如 马艳 郑曙峰 阚画春 陈敏 刘小玲 徐道青 王维


摘要:為探索油菜(Brassica napus L.)秸秆在防治杂草方面的潜力,以马唐[Digitaria sanguinalis(L.) Scop.]、旱稗[Echinochloa hispidula (Retz. ) Nees.]、马齿苋(Portulaca oleracea L.)、反枝苋(Amaranthus retroflexus L.)和醴肠(Eclipta prostrata (L.) L.]为受体,采用室内生物测定方法研究油菜秸秆不同部位水浸提液对5种杂草的化感作用。结果表明,与对照相比,250.0 g/L油菜叶和主茎水浸提液处理抑制马唐、反枝苋和醴肠的发芽率,延长它们的平均发芽时间;250.0 g/L油菜叶和主茎水浸提液处理降低马齿苋发芽率,对它的平均发芽时间没有明显影响;250.0 g/L油菜叶水浸提液处理对旱稗发芽率和平均发芽时间均没有显著影响,该浓度主茎水浸提液降低旱稗发芽率,延长旱稗的平均发芽时间;125.0 g/L根水浸提液处理抑制马唐、反枝苋和醴肠发芽率,延长它们的平均发芽时间,具化感抑制效应。250.0 g/L油菜叶、主茎水浸提液处理和 125.0 g/L 根水浸提液处理均抑制5种杂草的根长;15.6 g/L叶水浸提液处理对马唐和醴肠、15.6 g/L主茎水浸提液处理对反枝苋、7.8 g/L根水浸体液处理对反枝苋、旱稗的根生长有促进作用。不同浓度油菜根、主茎和叶水浸提液对5种杂草茎生长的化感作用存在差异。总体上看,油菜叶水浸提液对旱稗和醴肠的化感综合抑制效应较强;根水浸提液对醴肠的化感综合抑制作用较强。主茎水浸提液对醴肠和马齿苋的化感综合抑制效应较强。
关键词:油菜秸秆水浸提液;化感作用;发芽率;平均发芽时间
中图分类号:S451.2 文献标志码:A 文章编号:1003-935X(2020)02-0033-10
Abstract:The potential of Brassica napus straw for weed control,was assessed in indoor bioassays by evaluating the allelopathic effects of aqueous extracts from different parts of the straw on 5 weeds,Digitaria sanguinalis,Echinochloa hispidula,Portulaca oleracea,Amaranthus retroflexus and Eclipta prostrata. The germination rate of D. sanguinalis,A. retroflexus and E. prostrata was inhibited and their mean germination time was prolonged by 250.0 g/L leaves and main stem aqueous extract of rape,compared with the control;germination rate of P. oleracea was also decreased but without significant effect on its average germination time. Germination rate and mean germination time of E. hispidula was not affected by 250.0 g/L aqueous extract of leaves,while 250.0 g/L aqueous extract of main stem decreased its germination rate and prolonged its mean germination time. Aqueous root extracts (125.0 g/L) decreased the germination rate and prolonged the mean germination time of D. sanguinalis,A. retroflexus,E. prostrata seeds. The root length of the five weeds was decreased by 250.0 g/L leaves and main stem aqueous extracts and 125.0 g/L root aqueous extract. The root growth of D. sanguinalis and E. prostrata were promoted by 15.6 g/L aqueous extract of leaves,that of A. retroflexus was promoted by 15.6 g/L aqueous extract of main stem,and that of E. hispidula and A. retroflexus was promoted by 7.8 g/L aqueous extract of roots. There were differences in allelopathic effect of aqueous extracts of roots,main stems and leaves from B. napus at different concentrations on the five weeds. Overall,the strongest allelopathic inhibition was obtained with aqueous extract from leaves on E. hispidula and E. prostrata,from roots on E. prostrate,and from main stem on E. prostrate and P. oleracea.
Key words:aqueous extract of Brassica napus straw;allelopathic potential;germination rate;mean germination time
棉田杂草危害十分严重,化学除草是棉田杂草防除的主要方法[1]。单一除草剂(或具相同作用模式的除草剂)的大量、重复施用易导致杂草敏感种群向耐、抗性种群演替[2],新型除草剂的面世又有诸多因素限制[3];另外,化学除草剂易引发作物药害、除草剂残留,除草剂引起的环境与人类健康的共同问题等,迫使种植户考虑非化学除草剂的替代品[4]。
化感作用(allelopathy)是指一种植物通过释放化学物质到环境中对另一种植物产生直接或间接的促进或抑制作用,多种植物具有化感作用且可用于农业或生态系统[5]。芸薹属植物因其秸秆或植株提取物的化感活性而受到重视,尤其当用作农田覆盖作物时[6]。目前,已报道用等室琼脂法室内检测多种油菜栽培品种对硬直黑麦草(Lolium rigidum Gaud.)的化感抑制作用[7],芸薹属不同种秸秆浸提液对石茅[Sorghum halepense(L.) Pers.][8]、反枝苋(Amaranthus retroflexus L.)、龙葵(Solanum nigrum L.)、马齿苋(Portulaca oleracea L.)、苦蘵(Physalis angulata L.)和光头稗[Echinochloa colonum (L.)Link.][9]的化感作用。油菜的不同栽培品种或芸薹属不同种的秸秆浸提液对供试杂草皆有化感抑制作用,而抑制作用程度在不同的品种或种之间有差异,而且植物不同组织的化感效应也存在差异,地上部分或叶片的化感抑制作用要高于地下部分或根部[9-11]。供试植物的不同组织对化感物质的敏感度也存在差异[12]。Uremis等研究了25种油菜栽培品种根和茎的水浸提液对5种杂草发芽率、根生长、茎生长的化感作用,发现不同栽培品种的化感抑制作用不同,且茎水浸提液的化感抑制效应强于根水浸提液[13]。Walsh等分别运用叶洗、水浸提液、鲜秸秆拌土和根分泌物4种方法研究了蓝芥和油菜对野燕麦、亚麻、萝卜的化感作用,不同的处理方法所获得的化感效应因供试植物、供试植物的不同组织而不同;蓝芥和油菜的叶洗液可提高3种植物的根、茎鲜重;蓝芥和油菜鲜物质水浸提液對3种参试植物的发芽有一定的抑制作用或延长发芽时间,减少野燕麦和萝卜的根鲜重,增加它们的茎鲜重;鲜秸秆拌土后可增加野燕麦和萝卜的株高或干重;根分泌物对3种植物的茎高没有影响,蓝芥根分泌物只降低野燕麦鲜重,对亚麻和萝卜的鲜重没有影响,而油菜根分泌物则只显著降低亚麻的鲜重[14]。多数研究发现,化感化合物在某个浓度抑制一些物种的生长,也可能在较低浓度促进相同物种或不同物种的生长[12]。安徽省沿江地区是春油菜的主产区,广泛实行油棉两熟耕作制度,油菜秸秆还田将成为该地区秸秆利用的主要途径。因此须明确油菜秸秆对棉田主要杂草的化感效应,为油菜秸秆的合理利用及棉田杂草的综合治理提供科学依据。
1 材料与方法
1.1 试验材料
供试油菜品种为沣油737[15],为安徽省沿江地区主栽品种。2016年11月底栽种于安徽省农业科学院棉花研究所安庆试验基地的试验田中。
供试的5种农田杂草分别为马唐[Digitaria sanguinalis(L.) Scop.]、旱稗(E. hispidula L.)、马齿苋、反枝苋和醴肠[Eclipta prostrata (L.) L.]。分别在杂草种子成熟期采收种子,置于牛皮纸袋内低温保存备用。
1.2 植株取样与水浸提液制取
在种植油菜的大田中随机选取抽薹期未开花油菜10株,将油菜按根、主茎和叶分离后清洗干净,晾干,磨碎,加蒸馏水在室温下浸泡48 h。用4层纱布过滤掉纤维残渣,再4 ℃离心4 h,取上清液,然后用0.2 μm孔径的微孔滤膜抽滤后得上清液备用。分别获得500 g/L油菜叶和主茎的水浸提液,以及250 g/L油菜根的水浸提液。使用前按等比法加蒸馏水稀释到适当浓度。
1.3 杂草种子发芽测定
杂草种子用0.3%高锰酸钾消毒3 min,再用蒸馏水清洗3次。在垫有2层滤纸的培养皿(直径9 cm)中,放入大小一致的100粒杂草种子。油菜叶和主茎水浸提液设置浓度分别为15.6、31.3、62.5、125.0、250.0 g/L,油菜根水浸提液设置浓度分别为7.8、15.6、31.3、62.5、125.0 g/L,以蒸馏水为对照。每个培养皿加入油菜水浸提液 10 mL。每个浓度设3个重复。然后将培养皿放入人工气候箱(白天温度为28 ℃,湿度为70%,光照度为3 000 lx,光照10 h;夜晚温度为20 ℃,湿度为80%,暗培养14 h)。为保持滤纸的湿度,每天向培养皿内添加适量油菜水浸提液或蒸馏水。每天观察并记录种子发芽数,同时清除发芽种子,当种子萌发的胚根长达到种子长度一半时定为发芽。本试验重复2次。
1.4 幼苗生长测定
选取长势一致的发芽种子20粒放入培养皿(直径9 cm,2层滤纸)中,按上述设定的油菜秸秆水浸提液浓度,每皿加入10 mL,以蒸馏水为对照,每个浓度设4个重复。然后把培养皿放入人工气候箱(按上文设定)中,7 d后测量发芽杂草的根长和苗高,最后取平均值。本试验重复2次。
1.5 数据分析
(1)发芽率。P=n/N×100%。其中:P为发芽率%;n为7 d内杂草种子发芽数,N为供试杂草种子数。本试验因醴肠发芽较慢,其发芽率取播种后11 d的,其他杂草的发芽率取播种后 7 d 的。
(2)化感效应指数[16]。RI=1-C/T(T≥C),RI=T/C-1(T
(3)化感综合效应(synthetic allelopathic effect,SAE)[17]。SAE=(∑RIi)/m。其中:RIi分别代表发芽率、根长和苗高的化感效应指数;m为化感效应指数的项数。
(4)平均发芽时间(mean germination time,MGT)[18]。MGT=∑(dni)/∑ni。式中:d为从种子放入发芽皿之日算起的时间,d;ni为相应各日发芽数,粒。
运用Excel 2007对数据进行分析和作图,SSPS 13.0对数据进行方差分析和Duncans多重比较。
2 结果与分析
2.1 油菜秸秆水浸提液对5种杂草发芽率的影响
由表1可知,油菜叶水浸提液对反枝苋和醴肠的发芽率有抑制作用,125.0 g/L及以上浓度处理的叶浸提液对反枝苋与31.3 g/L及以上浓度处理的叶浸提液对醴肠有显著抑制作用,其中 31.3 g/L 叶浸提液处理对醴肠的抑制作用最强。对马唐的发芽率有一定抑制作用,但差异不显著;浓度为31.3~125.0 g/L的油菜叶水浸提液对旱稗发芽率有促进作用,浓度为15.6 g/L的油菜叶水浸提液对旱稗有抑制作用,但不同浓度间差异不显著;对马齿苋发芽率无显著影响。油菜叶水浸提液对5种杂草发芽率呈现化感抑制效应,其抑制效应从大到小为醴肠>马唐>反枝苋>马齿苋>旱稗。
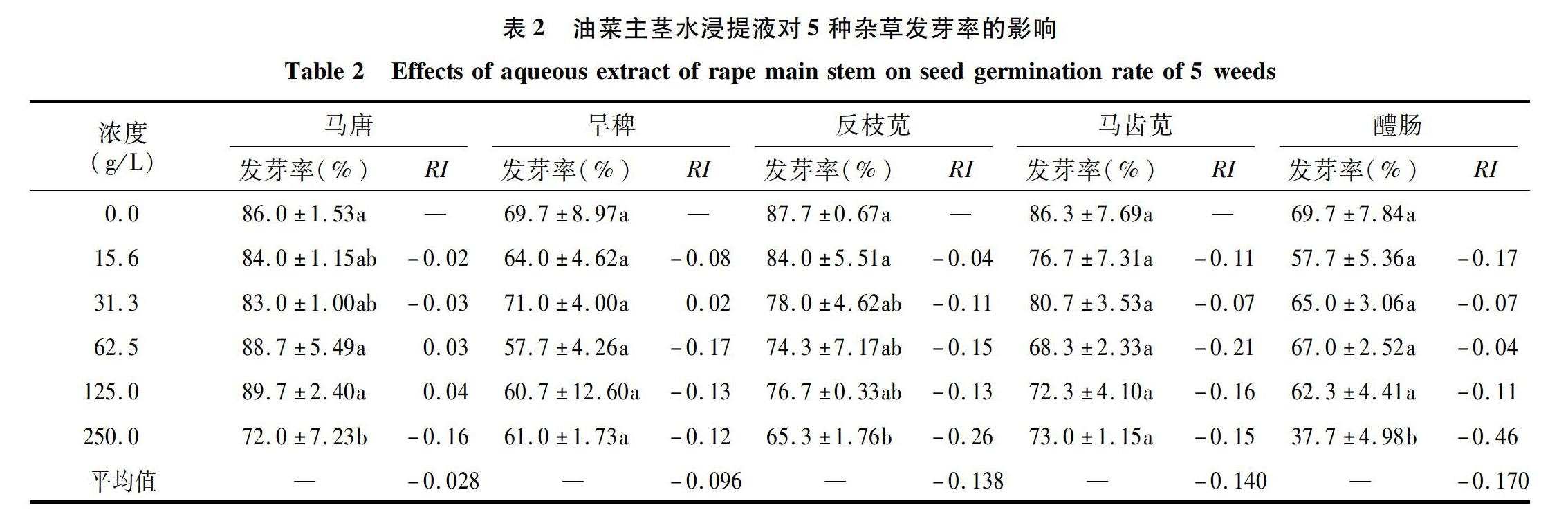
由表2可知,浓度为250.0 g/L的油菜主茎水浸提液对马唐、反枝苋、醴肠的发芽率有显著的抑制作用;不同浓度的油菜主茎浸提液对马齿苋的发芽率有一定的抑制作用,但差异不显著。31.3 g/L 的主茎浸提液对旱稗发芽率有促进作用,其他浓度对其具抑制作用,浓度间差异不显著。油菜主茎水浸提液对5种杂草发芽率的化感抑制效应表现为醴肠>马齿苋>反枝苋>旱稗>马唐。
由表3可知,不同浓度的油菜根水浸提液对醴肠和马唐发芽率有抑制作用,浓度为15.6 g/L的抑制作用最小,31.3 g/L及以上的抑制作用随着根水浸提液浓度的增加而增强,其中62.5 g/L及以上浓度对醴肠的抑制作用显著。7.8 g/L根浸提液促进反枝苋发芽,但抑制马齿苋发芽。156 g/L及以上浓度根浸提液抑制反枝苋发芽,但促进马齿苋发芽,在125.0 g/L时变化显著。油菜根水浸提液对旱稗发芽率具有促进作用,但作用不显著。油菜根水浸提液对其中3种杂草的化感抑制效应从大到小为醴肠>马唐>反枝苋。
随着油菜根和叶的水浸提液浓度增加,对马唐发芽率具一定的抑制作用,但差异不显著,其中125.0 g/L根水浸提液处理对马唐发芽率的抑制效应较同浓度的叶水浸提液高;主茎水浸提液对马唐发芽率则既有抑制作用也有促进作用。油菜秸秆水浸提液对旱稗发芽率没有显著影响;根水浸提液和31.3 g/L及以上浓度的叶水浸提液对旱稗发芽率有一定的促进作用,15.6 g/L和62.5 g/L及以上浓度主茎水浸提液对旱稗则有一定抑制作用。除去7.8 g/L根水浸提液处理促进反枝苋发芽外,其他浓度的根、主茎和叶水浸提液对反枝苋发芽率均具抑制作用;比较125.0 g/L油菜根叶、主茎、 根水浸提液的抑制效应可见,根水浸提液对反枝苋发芽率的抑制性最强。叶水浸提液对马齿苋发芽率的影响无规律性,主茎水浸提液和 7.8 g/L 根水浸提液处理抑制马齿苋发芽,15.6 g/L及以上浓度根水浸提液处理则会促进其发芽。
2.2 油菜秸秆水浸提液对5种杂草幼苗生长的影响
由表4可知,油菜叶水浸提液对旱稗、反枝苋和马齿苋的根长具有抑制作用,其中15.6 g/L及以上浓度处理对旱稗、125.0 g/L及以上浓度处理对反枝苋、31.3 g/L及以上浓度处理对马齿苋根的生长抑制作用显著。31.3 g/L及以下浓度处理对马唐、15.6 g/L处理对醴肠根生长具促进作用。油菜叶水浸提液促进反枝苋、马齿苋和醴肠茎的生长,其中15.6 g/L及以上浓度处理对反枝苋、62.5 g/L及以上浓度处理叶水浸提液对马齿苋茎的生长促进作用显著;各浓度油菜叶水浸提液对醴肠茎生长作用均不显著。62.5 g/L及以下浓度处理对马唐、31.3 g/L及以下浓度处理对旱稗茎的生长起抑制作用,其中15.6 g/L处理对旱稗茎生長的抑制作用显著,其他浓度处理的苗高变化不显著。
由表5可知,不同浓度的根水浸提液抑制马齿苋和醴肠的根长;当根水浸提液浓度分别在 15.6 g/L 及以上浓度和31.3 g/L及以上浓度时,对马齿苋和醴肠根长的抑制作用达显著水平。当油菜根水浸提液浓度在7.8~31.3 g/L之间时,促进旱稗和反枝苋根的生长。31.3~62.5 g/L处理的油菜根水浸提液促进马唐根生长,其他浓度处理则抑制马唐根的生长,其中125.0 g/L处理的抑制作用显著。浓度为7.8~15.6 g/L的根水浸提液抑制马唐茎的生长,但促进旱稗茎生长;31.3~62.5 g/L处理则促进马唐茎的生长,但抑制旱稗茎的生长,其中浓度为62.5~125.0 g/L的油菜根水浸提液对马唐的作用显著。
由表6可知,不同浓度油菜主茎水浸提液在一定程度上抑制马唐、旱稗、马齿苋和醴肠根的生长,对马齿苋和醴肠根生长的抑制作用随着浓度增加而增强,且与对照相比差异显著。浓度为156~62.5 g/L的主茎水浸提液促进反枝苋的根生长,浓度为125.0~250.0 g/L的油菜主茎水浸提液则抑制其生长。15.6 g/L主茎水浸提液抑制马齿苋苗高,31.3~250.0 g/L的主茎水浸提液则促进其苗高,且在125.0 g/L及以上浓度促进作用显著。15.6~31.3 g/L浓度的油菜主茎水浸提液促进旱稗苗生长,62.5~250 g/L浓度处理抑制旱稗苗生长。不同浓度的主茎水浸提液对醴肠苗高没有显著作用。
浓度为15.6~31.3 g/L的油菜叶水浸提液促进马唐根生长但抑制其苗高,125.0~250.0 g/L处理则反之。而浓度为7.8~15.6 g/L的根水浸提液抑制马唐根、茎生长,浓度为31.3~125.0 g/L 的根水浸提液则促进马唐根、茎生长;主茎水浸提液对马唐根、茎均具有抑制作用,且在250.0 g/L浓度处理下抑制作用显著。油菜叶和主茎水浸提液均会抑制旱稗的根长,浓度为 15.6~31.3 g/L的叶水浸提液抑制旱稗苗高,浓度为625~250.0 g/L的油菜叶水浸提液促进旱稗苗高。油菜根水浸提液在7.8~15.6 g/L浓度下促进旱稗根、茎生长,在62.5~125.0 g/L浓度下则起抑制作用。油菜秸秆水浸提液对反枝苋苗高均有促进作用,叶水浸提液对反枝苋的根生长起抑制作用,油菜根水浸提液、主茎水浸提液分别在78~31.3、15.6~62.5 g/L浓度下促进反枝苋根的生长,分别在62.5~125.0、125.0~250.0 g/L浓度下抑制反枝苋根的生长。油菜秸秆水浸提液均对马齿苋根生长起抑制作用,除156 g/L浓度下主茎水浸提液抑制苗高外,其他浓度油菜秸秆水浸提液均对苗高具有促进作用。
2.3 油菜水浸提液对5种杂草平均发芽时间和化感综合效应的影响
由表7可知,不同浓度油菜叶水浸提液对马唐、旱稗、反枝苋和醴肠的平均发芽时间存在显著影响,油菜叶水浸提液能够延长旱稗、反枝苋和醴肠的平均发芽时间。与对照相比,浓度为250 g/L的叶水浸提液可延长马唐、反枝苋和醴肠的平均发芽时间,且与对照相比差异显著。油菜叶水浸提液对马齿苋的平均发芽时间没有显著影响。
由表8可知,不同浓度油菜根水浸提液对马唐、反枝苋、马齿苋和醴肠的平均发芽时间存在显著作用。7.8 g/L浓度处理会缩短反枝苋和醴肠的平均发芽时间,15.6 g/L及以上浓度根水浸提液会延长反枝苋和醴肠平均发芽时间;浓度为 125.0 g/L 的根水浸提液会显著延长马唐、反枝苋和醴肠的平均发芽时间。
由表9可知,不同浓度油菜主茎水浸提液均能延长马唐、旱稗和醴肠的平均发芽时间,对同一种杂草,不同浓度的作用程度不同。浓度为 15.6 g/L 的主茎水浸提液会缩短反枝苋平均发芽时间,31.3~250.0 g/L则会延长反枝苋平均发芽时间,62.5 g/L及以上浓度处理作用显著;31.3~125.0 g/L处理会缩短马齿苋MGT,250.0 g/L处理延长其MGT,但差异不显著。与对照相比,250 g/L 油菜主茎水浸提液处理分别延长马唐、旱稗、反枝苋和醴肠平均发芽时间3.05、0.73、1.14、2.37 d。
与对照相比,油菜根水浸提液显著缩短马齿苋种子平均发芽时间,而叶和主茎水浸提液对其没有显著影响;250.0 g/L叶和主茎水浸提液处理及125.0 g/L根水浸提液处理显著延长马唐、反枝苋和醴肠的平均发芽时間;250.0 g/L叶和主茎水浸提液均延长旱稗MGT,125.0 g/L根水浸提液缩短旱稗平均发芽时间。
由表7可知,随着浓度增加,油菜叶水浸提液对马唐、旱稗和醴肠的抑制作用的化感综合效应呈现加强趋势;15.6~62.5 g/L叶水浸提液处理对反枝苋具化感促进效应,125.0~250.0 g/L处理对反枝苋表现为化感抑制效应;31.3 g/L叶水浸提液对马齿苋具化感抑制效应,其他浓度叶水浸提液对马齿苋表现为化感促进作用。250.0 g/L叶水浸提液对马唐、旱稗、反枝苋和醴肠的化感综合抑制效应最大。
由表8可知,7.8~31.3、125.0 g/L根水浸提液处理对马唐产生抑制性化感综合效应,而 62.5 g/L 处理则为促进性化感综合效应;7.8~15.6 g/L根水浸提液处理对旱稗起促进化感综合效应,31.3~125.0 g/L处理对其则起抑制化感综合效应;只有125.0 g/L根水浸提液处理对反枝苋表现出抑制性化感综合效应,对醴肠只有浓度为 7.8 g/L 的根水浸提液处理起促进性化感综合效应。7.8~31.3 g/L根水浸提液处理对马齿苋表现为化感综合抑制效应,62.5~125.0 g/L处理则为化感综合促进效应。
由表9可知,油菜主茎水浸提液对醴肠、马齿苋、马唐和旱稗的化感综合效应为抑制作用,且化感综合抑制效应为醴肠>马齿苋>马唐>旱稗;其中250.0 g/L主茎水浸提液对马唐、旱稗和醴肠的抑制效应最强,62.5 g/L处理对马齿苋的综合抑制效应最强;15.6~62.5 g/L主茎水浸提液处理对反枝苋具促进化感综合效应,且在31.3 g/L处理达到最大值,在250.0 g/L表现为化感综合抑制效应。
比较油菜3个组织水浸提液对5种杂草的化感综合效应表明,油菜叶水浸提液对旱稗和醴肠的化感综合抑制效应较强;根水浸提液对醴肠的化感综合抑制作用较强,对反枝苋的化感综合促进作用较大;主茎水浸提液对醴肠和马齿苋的化感综合抑制效应较强。
3 讨论与结论
已有研究表明,秸秆水浸提液对杂草发芽率的作用效果因杂草种类和浸提液浓度不同而存在差异;刺菜蓟叶水浸提液可降低反枝苋和马齿苋发芽率,延长反枝苋和马齿苋发芽平均时间[19]。贯叶连翘和药鼠尾草的水-乙醇浸提液对反枝苋发芽率抑制作用显著,对马齿苋发芽率没有影响[20]。赤桉叶水浸提液对马齿苋发芽率没有影响[21]。本试验中,油菜叶水浸提液抑制反枝苋萌发、延长其平均发芽时间,而对马齿苋的发芽率和平均发芽时间没有明显影响,与上述报道较一致。与对照相比,250.0 g/L油菜叶和主茎水浸提液抑制马唐、反枝苋、马齿苋和醴肠的发芽率,相对延长其平均发芽时间,但250.0 g/L叶水浸提液对马齿苋MGT、旱稗发芽率和平均发芽时间均没有影响,该浓度主茎水浸提液降低旱稗发芽率,延长其平均发芽时间。125.0 g/L根水浸提液抑制马唐、反枝苋和醴肠发芽率,延长其平均发芽时间,具化感抑制效应;促进马齿苋发芽率,缩短其平均发芽时间,起化感促进作用。
多数研究发现,化感物质在某个浓度抑制一些物种的生长,则可能在较低浓度促进相同物种或不同物种的生长[12]。本试验中高浓度(125.0 g/L)的油菜根水浸提液降低反枝苋的发芽率,而低浓度(7.8 g/L)则提高其发芽率;同样高浓度根水浸提液抑制旱稗根、茎和反枝苋根的生长,低浓度则促进其生长。本试验中较高浓度(125.0~250.0 g/L)油菜叶水浸提液抑制5种杂草根的生长。油菜主茎水浸提液抑制马唐、旱稗、马齿苋和醴肠根的生长,对反枝苋和马齿苋苗高则有促进作用,抑制马唐苗高,对旱稗的苗高既有抑制(62.5 g/L及以上浓度)作用,也有促进(15.6~31.3 g/L)作用,对醴肠苗高没有明显影响。
本试验结果表明,油菜秸秆不同部位的水浸提液对5种杂草均有一定的化感效应。同一浸提液浓度对不同受体植物种子萌发和幼苗生长阶段的化感效应不同,有促进作用、抑制作用和促进/抑制双重作用等多种形式,且不同测试种对同种化感资源的敏感性差异显著[22]。这与婆婆纳[23]、苦瓜[24]的水浸提液化感作用较一致。有研究认为,植物地上部分是化感物质的主要来源[25];同样,本试验中油菜叶和主茎水浸提液较根水浸提液对5种杂草的化感作用略强,有研究认为油菜地下部分在混合后前4 d产生的异硫氰酸盐呈现明显高峰[26-27],以上研究表明,植物不同部位的化感作用不同[12,23,27-32]。
隨着化学除草剂对环境和人类健康的有害影响以及抗除草剂杂草的不断出现,化感作用作为杂草防治的一项替代技术将逐步成为杂草综合治理技术中的重要部分。芸薹属植物因其化感作用可用于作物系统的杂草防治[13],本试验表明在长江流域大量种植的油菜秸秆可抑制部分杂草萌发和部分杂草根的生长,并延迟杂草种子萌发,从而让作物在杂草生长之前生根并获得对杂草的竞争优势。因此,本试验结果可为油菜秸秆用于防控农田杂草提供参考,在此基础上须要通过进一步的试验才能在实际中应用。
参考文献:
[1]马小艳,马 艳,彭 军,等. 我国棉田杂草研究现状及发展趋势[J]. 棉花学报,2010,22(4):372-380.
[2]Green J M. Evolution of glyphosate-resistant crop technology[J]. Weed Science,2009,57:108-117.
[3]Duke S O. Why have no new herbicide modes of action appeared in recent years?[J]. Pest Management Science,2012,68:505-512.
[4]Blackshaw R E,Harker K N,ODonovan J T,et al. Ongoing development of integrated weed management systems on the Canadian prairies[J]. Weed Science,2008,56:146-150.
[5]Rice E L. Allelopathy[M]. 2nd Edition. New York:Academic Press,1984.
[6]Norsworthy J K,McClelland M,Griffith G,et al. Evaluation of cereal and Brassicaceae cover crops inconservation-tillage,enhanced,glyphosate-resistant cotton[J]. Weed Technology,2011,25:6-13.
[7]Asaduzzaman M,An M,Pratley J E,et al. Canola (Brassica napus) germplasm shows variable allelopathic effects against annual ryegrass (Lolium rigidum)[J]. Plant Soil,2014,380(1/2):47-56.
[8]Uremis I,Arslan M,Uludag A,et al. Allelopathic potentials of residues of 6 Brassica species on johnsongrass[Sorghum halepense(L.) Pers.][J]. African Journal of Biotechnology,2009,8(15):3497-3501.
[9]Uremis I,Arslan M,Sangun M K,et al. Allelopathic potential of rapeseed cultivars on germination and seedling growth of weeds[J]. Asian Journal of Chemistry,2009,21(3):2170-2184.
[10]Nelly C B,Francois L. Physiological role of glucosinolates in Brassica napus. Concentration and distribution pattern of glucosinolates among plant organs during a complete life cycle[J]. Journal of the Science of Food and Agriculture,1991,56(1):25-38.
[11]Chon S U,Kim J D. Biological activity and quantification of suspected allelochemicals from alfalfa plant parts[J]. Journal of Agronomy and Crop Science,2002,188(4):281-285
[12]Turk M A,TawahaA M. Allelopathic effect of black mustard (Brassica nigra L.) ongermination and growth of wild oat (Avenafatua L.)[J]. Crop Protection,2003,22:673-677.
[13]Uremis I,Arslan M,Sangun M K,et al. Allelopathic potential of rapeseed cultivars on germination and seedling growth of weeds[J]. Asian Journal of Chemistry,2009,21(3):2170-2184.
[14]Walsh D,Sanderson D,Hall L M,et al. Allelopathic effects of camelina (Camelina sativa) and canola (Brassica napus) on wild oat,flax and radish[J]. Allelopathy Journal,2014,33(1):83-96.
[15]王同华,陈卫江,李 莓,等. 沣油737的选育及配套技术研究[J]. 湖南农业科学,2012(3):7-9.
[16]Williamson G B,Richardson D. Biossays for allelopathy:measuring treatment responses with independent controls[J]. Journal of Chemical Ecology,1988,14(1):181-187.
[17]周先容,江 波,龚小华,等. 大豆根系浸提液对茎瘤芥种子萌发和幼苗生长的化感作用[J]. 大豆科学,2016,35(1):74-79.
[18]刘克彪,姜生秀. 干旱和钠盐胁迫对罗布麻种子萌发的影响[J]. 草业学报,2016,25(5):214-221.
[19]Aurelio S,Alessia R,Gaetano P,et al. Allelopathic effects of Cynara cardunculus L. leaf aqueous extracts on seed germination of some Mediterranean weed species[J]. Italian Journal of Agronomy,2018,13(1021):119-125.
[20]Azizi M,Fuji Y. Allelopathic effect of some medicinal plant substances on seed germination of Amaranthus retroflexus and Portulaca oleraceae[J]. Acta Horticulturae,2006(699):61-67.
[21]Dadkhah A,AsaadiA M. Allelopathic effects of Eucalyptus camaldulensis on seed germination and growth seedlings of Acroptilon repens,Plantago lanceolata and Portulaca oleracea[J]. Research Journal of Biological Sciences,2010(5):430-434.
[22]An M,Pratley J E,Haig T,et al. Genotypic variation of plantspecies to the allelopathic effects of vulpia residues[J]. Australian Journal of Experimental Agriculture,1997,37(6):647-660.
[23]王 云,符 亮,龍凤玲,等. 2种婆婆纳属植株水浸提液对6种受体植物的化感作用[J]. 西北农林科技大学学报(自然科学版),2013,41(4):178-190.
[24]范愈新,颜仕龙,蔡 波,等. 苦瓜秸秆水浸提液对3种杂草的化感作用[J]. 草地学报,2017,25(5):1002-1006.
[25]Angus J F,Gardner P A,Kirkegaard J A,et al. Biofumigation:isothiocyanates released from Brassica roots inhibit growth of the take-all fungus[J]. Plant and Soil,1994,162(1):107-112.
[26]Gardiner J,Morra M J,Eberlein C V,et al. Allelochemicals released in soil following incorporation of rapeseed (Brassica napus) green manures[J]. Journal of Agricultural and Food Chemistry,1999,47(9):3837-3842.
[27]Besnard N C,Larher F. Physiological role of glucosinolates in Brassica napus concentration and distribution pattern of glucosinolates among plant organs during a complete life cycle[J]. Journal of the Science of Food and Agriculture,1991,56(1):25-38.
[28]李建波,方 丽,郝 雨,等. 野老鹳草水提取物对大豆、玉米、花生的化感作用[J]. 杂草学报,2018,36(1):31-36.
[29]Chon S U,Kim J D,Agron J. Biological activity and quantification of suspected allelochemicals from alfalfa plant parts[J]. Journal of Agronomy & Crop Science,2002,188(4):281-285.
[30]魏 进,刘 霞,张 静,等. 地桃花提取物对10种植物的抑制活性[J]. 杂草学报,2018,36(3):24-28.
[31]Economou G,Tzakou O,Gani A,et al. Allelopathic effect of Conyza albida on Avena sativa and Spirodela polyrhiza[J]. Journal of Agronomy and Crop Science,2002,188(4):248-253.
[32]李文红,张朝显,曹 丹. 6种杂草水浸提液对水稻种子发芽和幼苗生长的影响[J]. 杂草学报,2018,36(1):25-30.

