黏质沙雷氏菌Ha1培养条件优化及其与化学除草剂复配研究
李鑫 郭冉 杨娟 张瑜 杨毅清 马树杰 安鑫龙 张利辉 董金皋 张林旺

摘要:为了寻找高效安全的微生物除草剂,来减少或代替部分化学除草剂的使用,本研究优化了黏质沙雷氏菌Ha1的培养条件,并采用颗粒剂填埋法结合除草剂土壤封闭法测定了Ha1颗粒剂与化学除草剂复配的除草活性。结果显示,Ha1菌株培养的最优碳源、氮源和无机盐及其配比为蔗糖10 g/L、蛋白胨20 g/L、氯化钙 1 mol/L;最优培养条件:pH值为7、温度为20 ℃、转速为200 r/min。添加助剂比未添加助剂的Ha1颗粒剂的活菌数多0.9×109 CFU/g。当Ha1颗粒剂与70%推荐剂量的莠去津、精异丙甲草胺和扑草净复配使用时,对马唐的鲜重抑制率分别为96.35%、94.47%、97.61%,对稗草的鲜重抑制率分别为89.81%、86.50%、85.68%,对苘麻的鲜重抑制率分别为86.92%、79.53%、53.03%。表明添加助剂有助于菌株生长,化学除草剂与Ha1颗粒剂复配使用能够明显提高单独使用除草剂或者Ha1颗粒剂的防除效果。
关键词:黏质沙雷氏菌;除草活性;鲜重抑制率;化学除草剂;复配
中图分类号:S482.7 文献标志码:A 文章编号:1003-935X(2020)02-0021-12
Abstract:In order to find efficient and safe microbial herbicides to reduce or replace the use of chemical herbicides,the culture conditions of Serratia marcescens Ha1 were optimized. Its herbicidal activity was determined. The optimal nutrient sources,carbon,nitrogen and inorganic salts,and their ratio for Ha1 bacteria were as follow: sucrose 10 g/L, peptone 20 g/L,calcium chloride 0.1 mol/L. Optimal culture conditions consisted of pH 7,temperature 20 ℃,rotating speed 200 r/min. The count of active bacteria in HA1 granules with additives was 0.9×109 CFU/g more than that of HA1 without additives. The fresh weight inhibition rates of the application of Ha1 granules compounding with atrazine,metolachlor and prometryn at 70% recommended dose on Digitaria sanguinalis were 96%,94% and 98%,respectively. The fresh weight inhibition rates on Echinochloa crus-galli were 90%,86% and 86%,respectively. Fresh weight inhibition rates for Abutilon theophrasti were 87%,80% and 53%,respectively. Additives are useful for the growth of the bacteria strain. The combined application of herbicides and Ha1 granules could significantly improve the efficacy of herbicides or Ha1 granules applied separately.
Key words:Serratia marcescens;herbicidal activity;fresh weight inhibition rate;herbicide
微生物農药具有选择性高、对生态环境安全且不易产生抗药性的特点,已经成为新农药研究的热点之一[1]。黏质沙雷氏菌(Serratia marcescens)是一种革兰氏阴性菌,其在生长过程中会产生一种次生代谢产物——灵菌红素[2],该菌本身和其代谢产物都具有抗菌[3]、抗肿瘤和免疫抑制等活性[4],在疾病治疗和植物病虫草害防治方面发挥了重要作用。黏质沙雷氏菌FS14菌株中的赛拉菌素和塞拉利辛样蛋白酶(SPB)对棉铃虫幼虫具有毒杀作用[5];黏质沙雷氏菌YD25菌株对尖孢镰刀菌(Fusarium oxysporum)、小麦根腐病病菌(Bipolaris sorokiniana)、西瓜炭疽病病菌(Colletotrichum lagenarium)、辣椒炭疽病病菌(Colletotrichum capsici)和立枯丝核菌(Rhizoctonia solani)等均具有较好的抑制作用[6];此外,研究发现黏质沙雷氏菌Ha1菌株的代谢产物粗提物对马唐具有一定的抑制作用[7]。
微生物发酵过程中,发酵条件对微生物生长和代谢产物的产量起着关键性作用。微生物发酵条件主要包括培养基成分、温度以及pH值等。培养基主要以糖类为碳源,以蛋白胨为氮源,供给微生物生长所需的营养[8]。200 Gy的伽马辐射和最佳培养温度能够使黏质沙雷氏菌的代谢产物产量增加1倍,从而有效提高其抗菌等生物活性[9]。
在微生物农药的开发过程中,人们为增加其稳定性、贮藏期和货架期,通常在加工过程中添加助剂制成微生物制剂。常用的微生物农药制剂的助剂大致分为2种,一种是供病原菌生长繁殖所需的营养剂;另一种是作为微生物农药制剂在田间使用时,抵挡不良环境条件的保护剂[10]。在微生物制剂研究中还须要考虑助剂与微生物农药的相容性,保证菌株活性不受影响[11]。珍珠岩-膨润土混合物和吸附了20%喷雾干燥微胶囊的矿物载体制剂能够延长微生物制剂的贮藏期和保持微生物活性[12]。
由于微生物农药自身存在的不足,人们也致力于开展提高微生物农药速效性和防效的研究工作[13]。微生物农药复配能显著提高农药使用效率及其防治效果[14]。庄超等研究发现,齐整小核菌菌株SC64与禾长蠕孢菌稗草专化型HGE配合使用,提高了其对杂草的整体防治效果,扩大了单一微生物除草剂的杀草谱[15]。郑楠等研究发现,新月弯胞霉菌B6的悬浮体系与氰氟草酯混合使用,对水稻田各类杂草均具有较好的防治效果[16]。
本研究采用微生物除草剂和化学除草剂复配的方法,用黏质沙雷氏菌Ha1颗粒剂和3种化学除草剂进行复配,测定其对马唐(Digitaria sanguinalis)、稗草(Echinochloa crusgalli)和苘麻(Abutilon theophrasti Medicus)等的除草活性,旨在为黏质沙雷氏菌Ha1颗粒剂可以研发成为一种微生物除草剂提供可能,为今后解决杂草抗性问题和减少化学农药使用贡献力量。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 黏质沙雷氏菌Ha1菌株,由中国微生物菌种保藏管理委员会普通微生物中心保存。
1.1.2 供试杂草 马唐、稗草、苘麻,以上杂草种子均于2017年9月在河北省保定市南二环采集。
1.1.3 供试药剂 蛋白胨,购自北京双旋微生物培养基制品厂;酵母膏,购自太阳生物科技有限公司;琼脂,购自南京松冠生物科技有限公司;氯化钠、次氯酸钠,均购自福晨(天津)化学试剂有限公司;氢氧化钠,购自天津市大茂化学试剂厂;高岭土,购自保定市东亚化轻有限公司;粗面粉,购自保定市江城面粉厂;50%莠去津、50%扑草净,均购自山东滨农科技有限公司;960 g/L精异丙甲草胺,购自先正达(苏州)作物保护有限公司。
1.1.4 供试仪器 DHG-9070A 鼓风干燥箱,购自上海飞越实验仪器有限公司;PHS-2C pH仪,购自上海三信仪表厂;CP214 万分之一电子天平,购自福州华志科学仪器有限公司;KCB-80 湿法制粒机,购自北京开创同和科技发展有限公司;3WP-2000 行走式喷雾塔,购自农业农村部南京农业机械化研究所;MTN-2800 氮吹仪,购自美国Organomation公司。
1.2 试验方法
1.2.1 Ha1菌株培养基成分筛选及优化 培养基碳源(氮源、无机盐)的筛选:选用葡萄糖、淀粉、牛肉膏、蔗糖、酵母膏等5种碳源(硝酸铵、硫酸铵、蛋白胨、秸秆粉、尿素等5种氮源;氯化钙、磷酸钾、硝酸钾、硫酸镁等4种无机盐),固定LB液体培养基中的其他成分,将添加不同碳源(氮源、无机盐)的发酵液在20 ℃,200 r/min条件下振荡培养 72 h,通过比较Ha1菌株发酵后的菌体干质量来选择最优碳源(氮源、无机盐)。
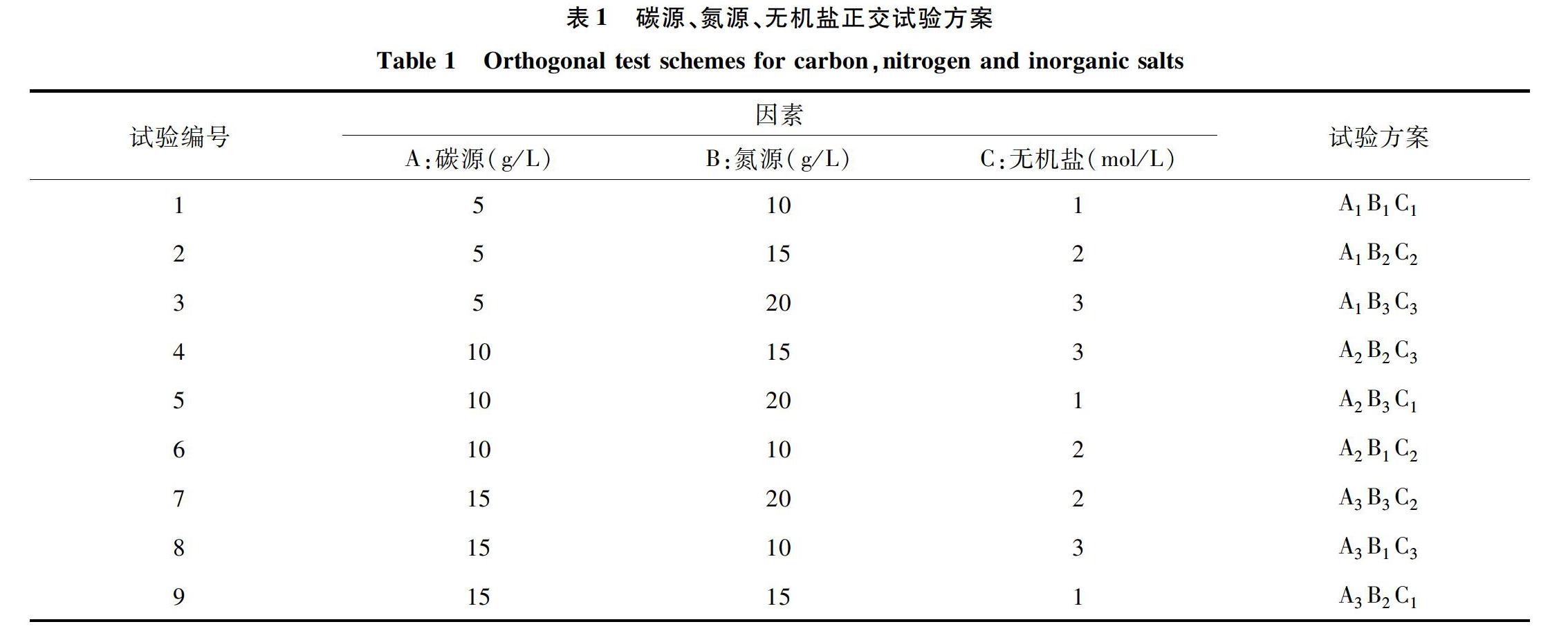
培养基多成分正交试验:在优化的碳源、氮源和无机盐基础上,固定其他成分的用量,采用3因素3水平,即L9(34)的正交试验,通过摇瓶发酵培养,比较Ha1菌株发酵产生的菌体生物量干质量来确定菌株培养最适的碳源(A)、氮源(B)和无机盐(C),每个处理设置4次重复,具体试验方案见表1。
1.2.2 Ha1菌株发酵条件优化 以初始pH值、振荡培养转速、培养温度为变量,进行发酵条件的优化试验,将发酵液的初始pH值分别设为5、7、9; 转速分别设为120、160、200 r/min;培养温度分别设为20、25、30 ℃。在单因素试验的基础上,采用Box-Behnken方法对影响黏质沙雷氏菌Ha1菌株发酵的初始pH值(A)、培养温度(B)、培养转速(C)进行3因素3水平试验设计,试验因素水平设计如表2、表3所示。通过Design Exper 10软件对试验数据进行拟合,得到拟合因素与响应值之间的函数方程,并对方程进行拟合分析和方差分析。
1.2.3 菌株培养 取200 μL Ha1菌种,均匀涂布在LB培养基上,静置5 min,待培养基表面干燥后放入20 ℃培养箱中倒置培养36 h。挑取单菌落,接种到100 mL LB液体培养基中作为种子液,20 ℃,200 r/min振荡培养48 h,得到菌悬液Ⅰ。然后将菌悬液Ⅰ按1%的接种量转接到100 mL LB液体培养基中,20 ℃,200 r/min振荡培养72 h,得到菌悬液Ⅱ,测定菌悬液Ⅱ的菌体生物量。
取菌懸液Ⅱ,4 000 r/min、4 ℃离心15 min,去上清。用无菌水洗涤沉淀物,60 ℃氮吹至干燥。称量菌体干质量,以每100 mL菌悬液中的菌体干质量(g)为菌体生物量的指标。将该菌悬液梯度稀释为10-1、10-2、10-3、…、10-8,各吸取100 μL涂板,20 ℃培养36 h,统计单菌落数量,每个梯度重复3次。
1.2.4 有效活菌数的测定 采用稀释涂布平板法计算1 g颗粒剂中的有效活菌数,称取4 g颗粒剂,加入40 mL无菌水静置20 min,然后振荡至颗粒剂完全溶解。吸取1 mL完全溶解的菌悬液,加入9 mL无菌水制成母液。将母液按“1.2.3”节中所述梯度进行连续稀释,分别吸取100 μL 10-6、10-7、10-8这3个稀释梯度的菌悬液,加入到预先倒好的固体培养基平板上,均匀涂布在培养基表面,每个浓度重复3次,有效活菌数计算公式:1 g颗粒剂样品的活菌数(CFU/g)=同浓度3次重复的菌落数量平均值×10×稀释倍数。
1.2.5 颗粒剂的制备 将粗面粉和高岭土置于171 ℃高温干热灭菌3 h。待其冷却后,取400 g粗面粉、200 g高岭土充分混匀,再向内缓慢加入400 mL含1010 CFU/mL的黏质沙雷氏菌Ha1菌株发酵液制成生面团。将生面团放入湿法制粒机中,挤压制造成颗粒剂,自然晾干后装入自封袋中,4 ℃保存备用。
1.2.6 添加大豆油助剂对Ha1颗粒剂活菌数的影响 配制添加精制大豆油的Ha1颗粒剂:50 mL 精制大豆油,200 g粗面粉,100 g高岭土,200 mL含1010 CFU/mL的Ha1菌株菌悬液,按照“1.2.5”节中颗粒剂制作方法进行样品制备,同时制备未添加精制大豆油的颗粒剂作对照,将制好的颗粒剂于4 ℃ 保存。连续9周测量颗粒剂内的活菌数,取 1 g 颗粒剂溶解于9 mL MgSO4缓冲液中,充分振荡15 min,吸取100 μL菌悬液均匀涂布于培养基上,20 ℃培养36 h,统计活菌数。每种样品3次重复,取3次重复的平均值。
1.2.7 化学除草剂与Ha1菌株的相容性 化学除草剂对Ha1菌株生长的影响:活化Ha1菌株,接种培养48 h制成种子液,然后按1%的接种量接种于液体培养基中,发酵培养72 h,制成菌悬液备用。将50%扑草净(推荐用量为100 g/667 m2)、960 g/L精异丙甲草胺(推荐用量为 100 mL/667 m2)和50%莠去津(推荐用量为90 g/667 m2)按推荐用量与培养基混匀,在每个培养皿中倒入15 mL带药培养基,制成带药培养基平板待用,设置不含药的对照平板,每个处理3次重复。吸取1 mL发酵好的Ha1菌株菌悬液到 9 mL 无菌水试管中,进行梯度稀释,然后吸取 100 μL 不同浓度的Ha1菌株菌悬液,注入带药培养基平板中,均匀涂开,20 ℃恒温培养48 h,观察3种化学除草剂对各浓度Ha1菌株活菌数的影响,试验重复3次。
化学除草剂与Ha1菌株的相容性:活化Ha1菌株,接种培养,然后将50%扑草净、960 g/L精异丙甲草胺和50%莠去津按照推荐用量与培养基混合。将发酵好的Ha1菌株菌悬液按1%的接种量接入带药培养基中,20 ℃、200 r/min发酵培养,设置不添加药剂的培养基接种菌悬液作为对照,每48 h测定1次活菌数,试验重复3次。
1.2.8 Ha1颗粒剂与70%推荐剂量化学除草剂复配的除草活性测定 对马唐、稗草和苘麻种子进行催芽、备用。选择口径为7 cm、高为10 cm的小花盆播种,装入适量的灭菌壤土,将Ha1颗粒剂按110 g/m2的添加量放入小花盆中,覆盖一层灭菌壤土,挑选发芽一致的杂草种子,每盆播种10粒,覆上1 cm厚的壤土。杂草未出芽之前,用喷雾塔定量喷施苗前化学除草剂,试验中复配药用量设计见表4,设置无颗粒填埋喷施清水的处理作为空白对照,每个处理重复3次。处理后封膜保湿,定期观察出芽情况,10 d后测量杂草地上部鲜重,计算杂草的鲜重抑制率。
鲜重抑制率=对照组鲜重-处理组鲜重对照组鲜重×100%。
1.3 数据分析
采用Excel和SPSS 17.0軟件进行数据整理和分析。
2 结果与分析
2.1 Ha1菌株培养基成分筛选及优化结果
培养基碳源、氮源和无机盐的筛选:黏质沙雷氏菌Ha1菌株发酵后的菌体干质量数据见表5至表7,当培养基中添加的碳源、氮源和无机盐分别为蔗糖、蛋白胨、氯化钙时,发酵培养的菌体干质量分别为0.45、0.93、0.65 g/100 mL,菌体干质量均达到不同培养条件的最大值。所以,黏质沙雷氏菌Ha1菌株发酵的最优基碳源、氮源和无机盐分别为蔗糖、蛋白胨和氯化钙。
培养基多成分正交试验:培养基碳源、氮源、无机盐优化的正交试验结果如表8所示,蔗糖、蛋白胨和氯化钙的添加量对黏质沙雷氏菌Ha1菌株的生长均能产生一定的影响,从极差的大小来看,各因子作用的顺序表现为B(蛋白胨)>C(氯化钙)>A(蔗糖),即蛋白胨用量对Ha1菌株的菌体干质量值影响最大,氯化钙次之,蔗糖的影响最小。以菌体干质量作为指标,最终选取在A2B3C1因素水平下进行培养,即菌株培养的最优碳源、氮源、无机盐分别为蔗糖、蛋白胨和氯化钙,最适配比为蔗糖 10 g/L,蛋白胨20 g/L,氯化钙1 mol/L。
2.2 Ha1菌株发酵条件优化结果
Ha1菌株二次回归拟合及方差分析:利用Design Expert 10软件对表9中的数据进行分析发现,Ha1菌株发酵的初始pH值(A′)、培养温度(B′)、培养转速(C′)与Ha1菌体干质量(R1)之间的回归方程为 R1=-0.310A′2-0.110B′2-0110C′2-0.038A′B′+0.093A′C′+1.475×10-3B′C′-0.091A′+0020B′+0.086C′+1.530。
由表10可知,试验中的回归模型达到显著水平(P=0.001)时,二次拟合回归方程的R2为0949 1,该模型能够解释有94.91%的变化,仅有总变异的5.09%不能用此模型来解释。失拟项在P=0.05 水平上不显著(P=0.092 3>0.05),说明回归方程预测与实际结果拟合度较高,可用该回归方程代替真实点对本试验结果进行分析。模拟一次项中对Ha1生长量的影响表现为A′(初始pH值)>C′(转速)>B′(培养温度);在模型二次项的回归方程关系中,A′2为极显著,B′2、C′2都为显著,说明初始pH值、转速、培养温度对菌株生长都有影响。在交互项分析中,A′B′、B′C′交互效应不显著,说明培养温度与初始pH值、培养温度与转速之间的交互作用对黏质沙雷氏菌Ha1菌株生长量影响较小,因此在一定范围内可以调节培养温度与初始pH值、培养温度与转速的关系来提高Ha1菌株的生物量干质量。
利用Design Expert 10软件对表9中的试验数据进行回归拟合后得到二次多项式回归方程的响应面图形及等高图形,如图1至图3所示。三维曲面图能直观地体现出各因素之间相互作用对响应面的影响,发现Ha1菌株最佳响应值(菌体干质量)为1.55 g/100 mL。试验中各因素的取值:pH值为6.802,培养温度为19.538 ℃,转速为193738 r/min。因此,对Ha1菌株进行发酵培养的条件为初始pH值为7,培养温度为20 ℃,转速为200 r/min,并设4次重复试验,所得到的固体发酵产物中生物量的平均值为1.549 g/100 mL,说明Design Expert 10软件对实际结果预测的较为准确,采用响应面法优化Ha1菌株摇瓶发酵条件方法可行。
2.3 添加大豆油助剂对Ha1颗粒剂活菌数的影响
颗粒剂中添加大豆油与未添加大豆油对Ha1活菌数有一定的影响。由图4可知,Ha1颗粒剂中的初始活菌数为2.5×1010 CFU/g,Ha1颗粒剂贮存9周后,添加大豆油的Ha1颗粒剂的活菌数为2.8×109 CFU/g,未添加大豆油的Ha1颗粒剂的活菌数为1.9×109 CFU/g,添加大豆油助剂比未添加大豆油助剂Ha1颗粒剂的活菌数多0.9×109 CFU/g。因此,添加大豆油助剂有利于Ha1菌株的贮存。
2.4 化學除草剂对Ha1菌株生长的影响
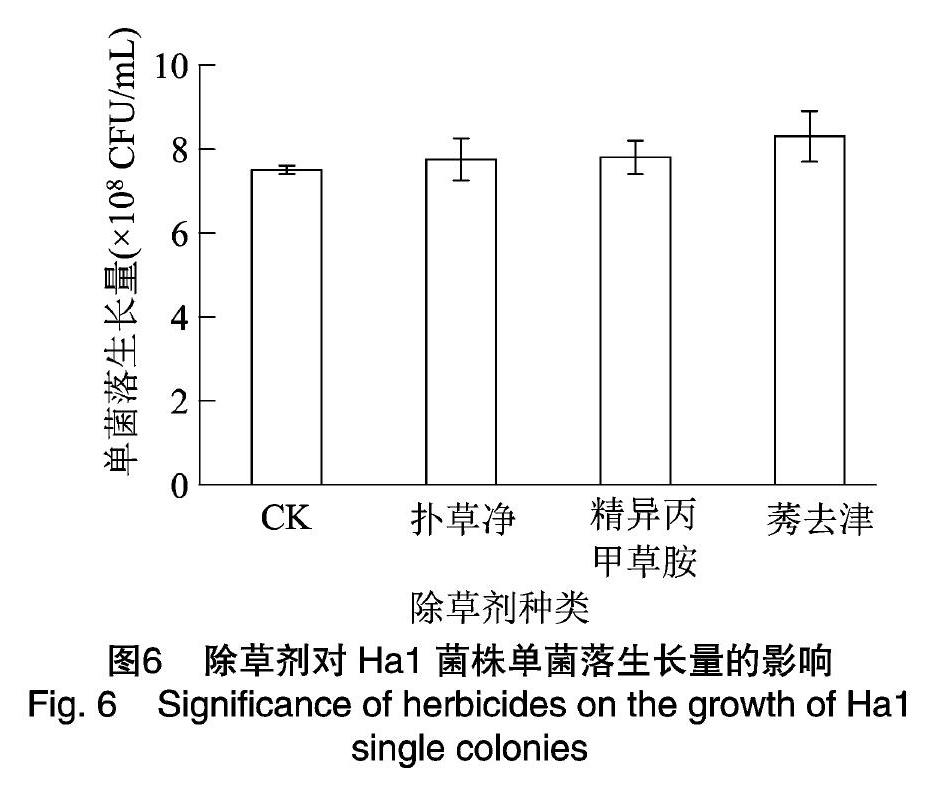
将50%扑草净、960 g/L精异丙甲草胺和50%莠去津按推荐用量分别添加到培养基中制成带药平板,研究不同除草剂对Ha1菌株生长的影响。由图5可知,在含有50%扑草净、960 g/L精异丙甲草胺和50%莠去津的平板中,Ha1菌株均能正常生长,活菌数与对照相比无明显差异,各处理与空白对照(CK)的单菌落生长势也基本相同。在含有50%扑草净、960 g/L精异丙甲草胺和50%莠去津的平板上生长的菌落与对照相比,活菌数分别多出0.25×108、0.30×108、0.80×108 CFU/mL(图6)。由此表明,50%扑草净、960 g/L 精异丙甲草胺和50%莠去津均不影响Ha1菌株的正常生长,可以复配使用。
2.5 化学除草剂与Ha1菌株的相容性
由图7可知,50%扑草净、960 g/L精异丙甲草胺和50%莠去津与Ha1菌株的相容性均较好。随着共培养时间的延长,这3种化学除草剂对菌株的生长均无明显影响,且在不同培养时间内产生的活菌数整体高于对照,其中50%莠去津在144、168、192 h培养时间下活菌数明显高于对照。
2.6 Ha1颗粒剂与70%推荐剂量的化学除草剂复配的除草活性
施药7 d后,马唐、稗草和苘麻均表现出生长减缓、发芽率降低、植株弱小、倒伏等的生长情况。由图8可知,单独使用70%推荐剂量的扑草净、精异丙甲草胺和莠去津时,对马唐的鲜重抑制率分别为67.47%、66.59%、78.27%,对稗草的鲜重抑制率分别为73.64%、80.00%、78.35%,对苘麻的鲜重抑制率分别为43.50%、37.50%、7449%。单独使用Ha1颗粒剂时,对马唐、稗草和苘麻的鲜重抑制率分别为59.42%、58.01%、40.47%。70%推荐剂量的扑草净、精异丙甲草胺、莠去津与Ha1颗粒剂复配时,对马唐鲜重的抑制率分别为97.61%、94.47%、96.35%,对稗草的鲜重抑制率分别为85.68%、86.50%、8981%,对苘麻的鲜重抑制率分别为53.03%、79.53%、86.92%。70%推荐剂量的化学除草剂与Ha1颗粒剂复配使用,对马唐、稗草和苘麻的防除效果明显高于单独使用除草剂或者Ha1颗粒剂的防除效果。
3 结论与讨论
进行微生物发酵工艺的优化,能在很大程度上提高发酵生产的效率,降低生产成本。王瑞龙等优化了链霉菌(Streptomyces sp.)6803菌株的发酵工艺,显著提高了其菌丝产量和除草活性[17]。朱海霞等采用单因素分析法和正交试验筛选得到层出镰孢菌(Fusarium proliferatum)GD-5菌株的最适培养条件,提高了菌株的除草活性[18]。本试验筛选了黏质沙雷氏菌Ha1菌株的发酵条件,不仅简化了试验过程,还明确了各因素之间的交互影响,为提高黏质沙雷氏菌Ha1菌株的生长量及其除草活性奠定了基础。
现阶段微生物农药还无法代替化学农药,广大学者纷纷从微生物农药复配方面展开研究,以期通过微生物菌株混合使用或微生物菌株与减量的化学农药复配使用,来达到提高微生物农药广谱性和协同增效,减少化学农药用量的目的[19]。生防菌株NJ13分别与50%嘧菌环胺水分散粒剂(WG)、10%苯醚甲环唑WG复配对人参黑斑病的联合毒力和田间防效具有增效作用[20]。新型杀菌剂氟吡胺与生防菌甲基芽孢杆菌TA-1联合施用对番茄灰霉病具有协同增效作用[21]。微生物农药与化学农药复配之所以能够提高防治效果,可能是因为微生物菌株利用了化学农药中的营养物质,或者是化学农药中的成分增强了菌株活性,从而促进菌株生长或产生次生代谢产物来防除病虫草。在微生物农药与化学农药复配使用时,两者的相容性也是非常重要的。苏云金芽孢杆菌(Bacillus thuringiensis)SV2与替美福司(双硫磷)协同作用相容性较好且降低了单个农药使用的半数致死量(LD50)[22]。Ha1颗粒剂如同大多数微生物除草剂一样,相比化学除草剂的除草效果相对较低,对杂草严重发生情况或者恶性难除杂草的防治效果不理想,所以笔者所在课题组考虑将其与化学除草剂复配从而提高其自身除草效果。本试验采用扑草净、精异丙甲草胺、莠去津与Ha1菌株复配,相容性均较好,除草活性也相比单一使用化学除草剂或Ha1颗粒剂高。
选择菌药复配的目的是提高单个农药的广谱性,不同化学农药与微生物农药复配的防治效果不同[23],相同化学农药不同浓度与微生物农药复配的防治效果也存在一定差异。一般情况下,高浓度化学农药对有害生物具有较高的防除效果,但是高浓度的化学农药对微生物也有一定的毒害作用,因此筛选适宜复配的化学农药浓度与种类是微生物农药与化学农药复配研究的重点及难点。本试验用扑草净、精异丙甲草胺、莠去津与Ha1颗粒剂复配提高了单一使用化学除草剂或Ha1颗粒剂的除草活性,但还须筛选化学除草剂不同减量处理与Ha1颗粒剂复配的除草效果,尽可能地减少化学除草剂的用量。
参考文献:
[1]周文冠,孟永杰,陈 锋,等. 除草剂研发及其复混使用的现状与展望[J]. 草业科学,2018,35(1):93-105.
[2]Albert B. Bergeys manual of determinative bacteriology. Eighth edition [J]. American Journal of Public Health,1975,65(3):315.
[3]Clements T L,NdlovuT,Wesaal K. Broad-spectrum antimicrobial activity of secondary metabolites produced by Serratia marcescens strains [J]. Microbiological Research,2019,229:126329.
[4]Clements T,Ndlovu T,Khan S,et al. Biosurfactants produced by Serratia species:classification,biosynthesis,production and application [J]. Microbiology and Biotechnology,2019,103(2):589-602.
[5]Wu D X,Li P P,Zhou J L,et al. Identification of a toxic serralysin family protease with unique thermostable property from S. marcescens FS14 [J]. International Journal of Biological Macromolecules,2016,93:98-106.
[6]白腾飞,刘月芹. 沙雷氏菌抗生性次级代谢产物合成机制[J]. 微生物学杂志, 2017,37(4):115-119.
[7]Yang J,Wang W,Yang P,et al. Isolation and identification of Serratia marcescens Ha1 and herbicidal activity of Ha1‘pesta granular formulation [J]. Journal of Integrative Agriculture,2015,14(7):1348-1355.
[8]Xia W,Li Z,Xu Y L,et al. Progress in the influence of the fermentation feedstocks on bacterial cellulose production [J]. Science & Technology of Food Industry,2017,38(2):358-363.
[9]Elkenawy N M,Yassin A S,Elhifnawy H N,et al. Optimization of prodigiosin production by,Serratia marcescens,using crude glycerol and enhancing production using gamma radiation [J]. Biotechnology Reports,2017,14:47-53.
[10]刘振华,邢雪琨. 微生物农药助剂研究进展[J]. 基因组学与应用生物学,2016,35(8):2109-2113.
[11]马 娟,董金皋. 微生物除草剂与生物安全[J]. 植物保护,2006,32(1):9-12.
[12]Borowski S,Matusiak K,Powalowski S,et al. A novel microbial-mineral preparation for the removal of offensive odors from poultry manure [J]. International Biodeterioration & Biodegradation,2017,119:299-308.
[13]苏正川,熊仁科,罗小艳. 解淀粉芽孢杆菌的作用及其产品开发[J]. 农药科学与管理,2019,40(6):21-30.
[14]郎 博,胡 强,许 泉,等. 微生物肥料宁盾与农药的兼容性[J]. 黑龙江农业科学,2017,96(3):78-83.
[15]庄 超,张羽佳,唐 伟,等. 齐整小核菌和禾长蠕孢菌稗草专化型复配防除直播稻田杂草的试验研究[J]. 中国生物防治学报,2015,31(2):242-249.
[16]郑 楠,赵 敏. 真菌新月弯孢霉的研究进展[J]. 黑龙江医药,2010,23(2):165-167.
[17]王瑞龙,黄 珂,石木标,等. 化感链霉菌6803菌株液体发酵工艺优化的研究[J]. 生态环境学报,2012,21(5):870-875.
[18]朱海霞,马永强,郭青云. 层出镰孢菌GD-5固态发酵培养条件及对藜和密花香薷的除草活性[J]. 植物保护学报,2018,45(5):1154-1160.
[19]王 祺,李 艳,张红艳,等. 生物药肥功能及加工工艺评述[J]. 磷肥與复肥,2017,32(8):13-17.
[20]陈长卿,金 辉,姜 云,等. 生防菌株NJ13与化学农药复配对人参黑斑病的联合毒力及田间防效[J]. 农药,2019,58(5):381-384.
[21]Ji XX,Li JJ,Meng Z,et al. Synergistic effect of combined application of a new fungicide fluopimomide with a biocontrol agent Bacillus methylotrophicus TA-1 for management of gray mold in tomato [J]. Plant Disease,2019,103(8):1991-1997.
[22]Narkhede C P,Patil C D,Suryawanshi R K,et al. Synergistic effect of certain insecticides combined with Bacillus thuringiensis on mosquito larvae [J]. Journal of Entomological and Acarological Research,2017,49(1):22-27.
[23]束长龙,曹蓓蓓,袁善奎,等. 微生物农药管理现状与展望[J]. 中国生物防治学报,2017,33(3):297-303.

