大豆乳清中分离干酪乳杆菌GJ00412的种子培养基优化
韩 伟,孙 博,苗海江,庄绪会,罗小红,邹海杰,陈红娟,谢嫣琪
大豆乳清中分离干酪乳杆菌GJ00412的种子培养基优化
韩 伟,孙 博,苗海江,庄绪会,罗小红,邹海杰,陈红娟,谢嫣琪
(国家粮食和物资储备局科学研究院,北京 100037)
从大豆乳清中分离得到一株菌GJ00412,经16S rRNA基因测序、比对,初步鉴定为干酪乳杆菌,为降低种子培养基成本并提高其生物量,以便进一步应用,在传统乳酸杆菌(MRS)培养基基础上,采用响应面法对培养基组分进行优化。首先通过Plackett-Burman实验设计,从葡萄糖、大豆蛋白胨、酵母浸粉、胰蛋白胨、MgSO4、MnSO4、吐温80、pH等因素中,筛选出葡萄糖、酵母浸粉、MgSO4,吐温80和pH等5个对菌体生物量有显著影响的因子。采用响应面实验设计对上述5个因素进一步优化。优化后的培养基组成(w/v)如下:2.5%葡萄糖,1.8%大豆蛋白胨,0.4%酵母浸粉,0.08%MgSO4,0.04%MnSO4,0.08%吐温80,pH7.17。优化后的培养基与MRS培养基相比,降低成本,生物量无显著差异。
大豆乳清;干酪乳杆菌;响应面;Plackett-Burman设计
我国是大豆分离蛋白(soy protein isolate,SPI)的重要生产国,大豆乳清(soy whey)是其主要副产物。大豆乳清中的化学需要量(COD)超过10 000 mg/L,直接排放会造成环境污染,且通过絮凝、厌氧污泥、好氧污泥等方式处理的成本相对较高。然而,它含有蛋白质、低聚糖、胰蛋白酶抑制剂、异黄酮类化合物、大豆皂甙、植酸、植酸盐、酚酸等多种成分[1-3],微生物,尤其是乳酸菌,可利用大豆乳清中营养成分,达到增殖或获得代谢产物的目的[4-5]。
干酪乳杆菌是一种具有很高工业价值的微生物,也是易从大豆乳清中分离的乳酸菌,广泛应用于医疗保健、发酵食品、饲料添加剂等领域。干酪乳杆菌的益生性能也得到越来越多的研究支持。Pablo等[6]临床试验证实干酪乳杆菌对纤维肌痛患者的认知、情绪产生影响。陆文伟等[7]建立小鼠模型,认为干酪乳杆菌对小鼠肠道菌群具有一定的调节作用,并且对肠道转运有良好的促进作用。王四新等[8]在饲粮中添加干酪乳杆菌可改善北京黑猪育肥阶段的生长性能和饲料利用率,而对其肌肉中营养成分含量无显著影响。如果干酪乳杆菌能利用大豆乳清营养并大量增殖,将为大豆乳清的利用提供新的思路。
对于很多实验室或者中试发酵平台,MRS培养基被常用作乳酸菌的种子培养基,但是MRS培养基成分复杂、配制工作繁琐,且牛肉膏等成分的成本相对较高,不适用于工业生产线使用。因此,优化干酪乳杆菌的种子培养基,是一项不可忽视的工作。在关于培养基优化的统计学工具中,响应面(RSM)方法功能强大,并早已成功运用于发酵工艺过程的优化,其中即包括生物量培养方面[9]。
在本研究中,通过16S rRNA基因测序方法鉴定一株大豆乳清中分离的菌株,即GJ00412。采用响应面法优化干酪乳杆菌GJ00412的种子培养基,以期增加GJ00412生物量并降低发酵成本。
1 材料和方法
1.1 材料和试剂
GJ00412,GenBank登录号为MN650243。实验中采用的所有试剂均为国产分析纯或化学纯。
计数用培养基:MRS培养基,即:20 g葡萄糖,10 g牛肉膏,5 g酵母粉,5 g乙酸钠,2 g磷酸氢二钾,2 g柠檬酸二铵,0.58 g硫酸镁,0.25 g硫酸锰,8 mL吐温80,1 000 mL去离子水,初始pH7.0。
1.2 16S rRNA基因测序
方法参见参考文献[10]。正向(上游)引物: 5′-GAG TTT GAT CCT GGC TCA GGA CGA-3′,反向(下游)引物:5′-CGC ACC TTC CGA TAC GGG CTA CCT-3′由上海英骏生物技术有限公司合成。上游引物(24 bp)1 μL,下游引物(24 bp)1 μL,10×Buffer 5 μL,Mg2+4 μL,dNTP2 μL,Ex Taq 酶1 μL,模板3 μL,ddH2O 35 μL。反应程序:预变性95 ℃,5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸50 s,30个循环;72 ℃延伸5 min。取10 μL扩增产物加入2 μL溴酚蓝染色液,混匀加在1%琼脂糖凝胶(含goldview 1 μL),1×TAE缓冲液中恒压80 V电泳40 min,用凝胶成像仪观察结果。将PCR产物与T载体连接,扩增,提取质粒,测序。
1.3 活菌数量检测
活菌数检测,参照参考文献[11]。
1.4 Plackett-Burman设计
在Plackett-Burman设计[12-13]中,每一个变量均有高(+)和低(–)两个水平。高的水平值约是低水平值的1.25倍。其是基于一阶多项式模型:

是响应值(生物量),0是模型的截距,是线性系数,是自变量的水平。采用JMP软件包进行PB设计。在实验设计中,共考虑了8个因素,分别是葡萄糖(1)、大豆蛋白胨(2)、酵母浸粉(3)、胰蛋白胨(4)、硫酸镁(5)、硫酸锰(6)、吐温80(7)、初始pH值(8)。根据这一实验设计,共包括8因素的12次实验。
1.5 Box-Behnken设计
通过Plackett-Burman设计[14-15]发现葡萄糖、酵母浸粉、MgSO4,吐温80和pH五个因素对生物量影响显著,因此选取这五个因素,进一步采用响应面优化以确定最优条件。根据Box-Behnken设计原则,用于预测最优点的二项式模型如下:
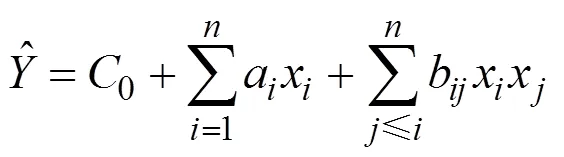
是预测的响应值,0、a和b分别是常量、线性及二次回归系数。响应面设计在Design- Expert Version 6.0.5软件中进行,每个因素选择三个水平,生物量作为响应值,具体因素编码及水平见表1。实验结果采用回归分析和方差分析来确定模型的回归系数和统计学显著性。

表1 Box-Behnken设计的因素水平和编码值
注:单因素实验确定水平和中心点,数据略。
1.6 验证实验
按1%(v/v)的接种量将GJ00412分别接种至50 mL MRS液体培养基和50 mL优化后的培养基中(培养基装于250 mL摇瓶),于摇床上150 rpm、37 ℃培养18 h,按1.3所述方法进行活菌数检测。
2 结果和讨论
2.1 菌株初步鉴定
GJ00412的16S rRNA基因序列见图1。经PCR,GJ00412在1 000~2 000 bp间有一个明显的条带,大约1.5 Kb左右,这表明PCR反应扩增出了预期长度的16S rDNA序列。再将测得的基因序列应用于BLAST程序、在Genebank数据库中进行相似性比较,得出16S rRNA基因鉴定结果:GJ00412与干酪乳杆菌(M15-1)的同源性为100%。
2.2 影响生物量的主效因素筛选
Plackett-Burman设计实验结果见表2和表3。采用分布检验对每个变量的显著性进行分析,结果见表4。从表4和表5可看出,初始pH(< 0.01)、硫酸镁、酵母浸粉、吐温80、葡萄糖(< 0.05)对GJ00412的生物量有统计学显著性影响。因此对这五个因素采用Box-Behnken 设计进一步优化。大豆蛋白胨和硫酸锰对生物量贡献不显著,但是作为主要的氮源和无机盐离子,又是培养基不可或缺的,所以根据Plackett-Burman设计的结果对这两个因素分别选取1.8%和0.04%。此外,根据模型的回归系数得出胰蛋白胨对生物量的贡献小于0.664%,因此胰蛋白胨未被考虑在最终的培养基配方中。

图1 GJ00412的16S rRNA基因序列

表2 通过Plackett-Burman设计的不同变量水平
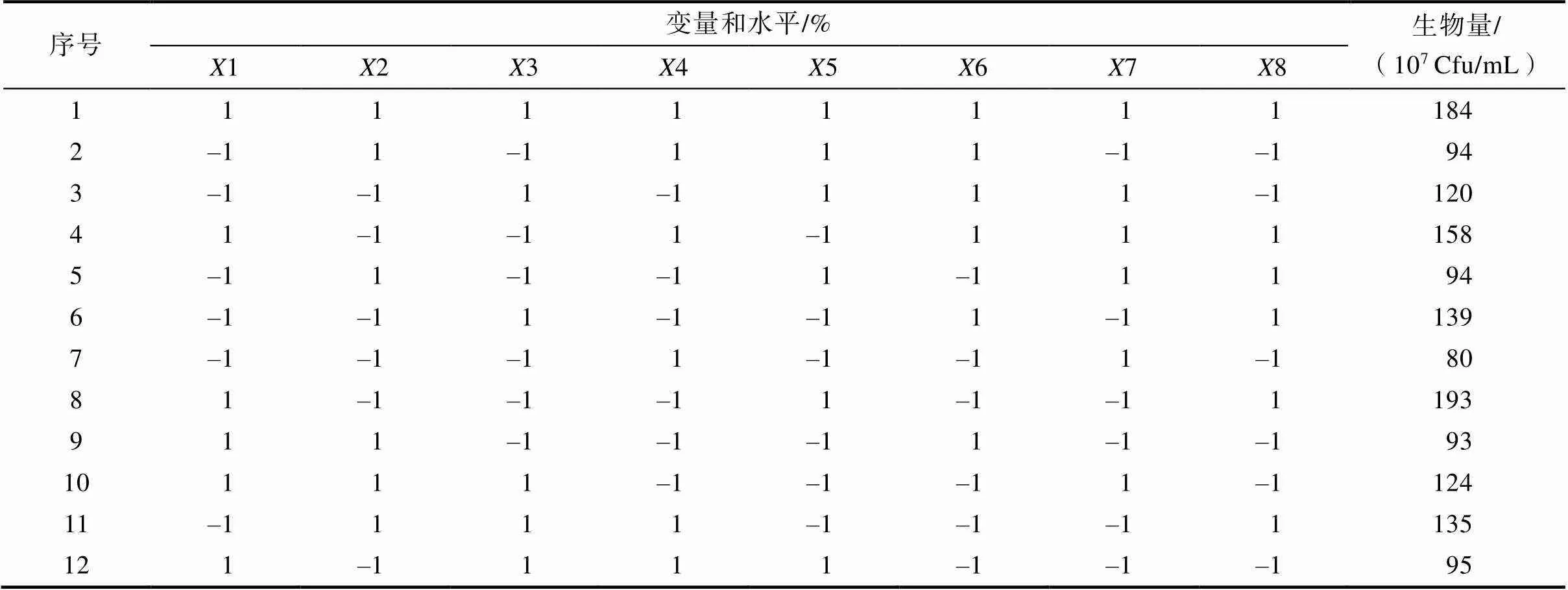
表3 通过Plackett-Burman设计的实验结果

表4 Plackett-Burman设计实验的数据分析
注:2(拟合值)=0.982 4;2adj(调整后的拟合值)=0.961 2。
2.3 培养基成分的优化
响应面设计的实验结果见表5。实验结果的均方差分析见表6。从上述2表的结论得到生物量和各因素的二次回归方程为:
=67.33–1.88–27.31+0.56–1.44+0.063– 12.442+22.812–1.192–2.692–13.522–9–5.5+2.5+0.5–1.25+5.25–0.25– 3.5+1.5–4.5
表7列出了二项式模型的方差分析结果。模型值为11.28,<0.000 1,表明该拟合模型具有很高的显著性。2为0.900 3,表明生物量的90.03%是由培养基成分贡献的,只有9.97%未在本模型中体现出来,说明此方程适合于响应值(生物量)的预测。另外从表6还可以得出,因素(酵母浸粉)对生物量的线性效应显著,2(葡萄糖),2,2(初始pH)对生物量的曲面效应显著。
图2中,实验建立三维响应面绘图,预测不同变量值下的生物量并对不同因素间相互作用进行分析。三维响应面立体图以z-轴为响应值来表示两个变量的交互作用,同时保持其他变量的最优水平。另外,运用迭代法计算出各个变量的最优水平,并对回归方程的最大值进行计算。用相应因素的编码的浓度水平代入回归方程,计算出生物量的最大预测响应值。五个因素的最优水平见表8。因此,得到优化后培养基配方(w/v):2.5%葡萄糖,1.8%大豆蛋白胨,0.4%酵母浸粉,0.08% MgSO4,0.04% MnSO4,0.08%吐温80,pH 7.17。
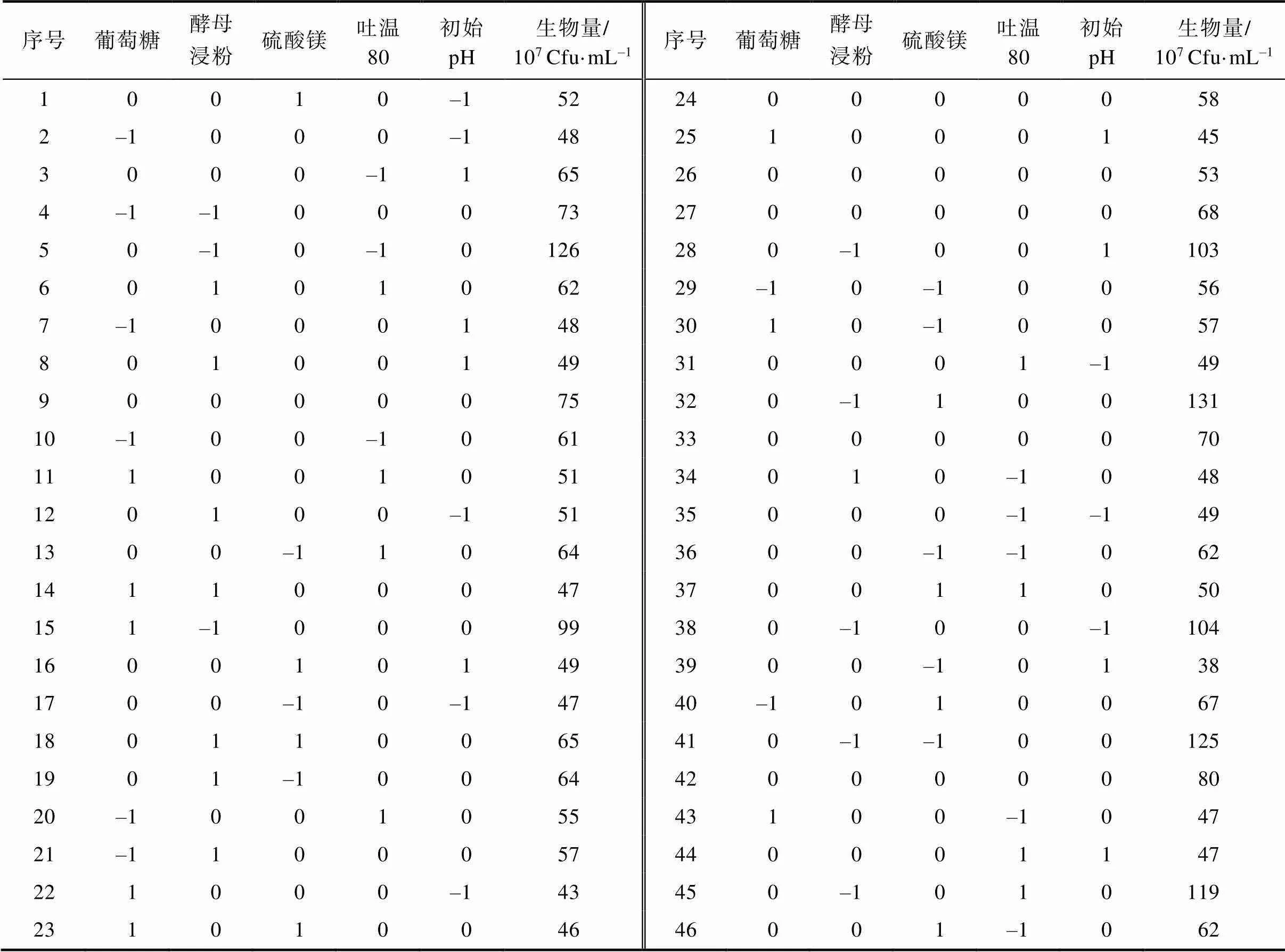
表5 Box-Behnken设计和结果
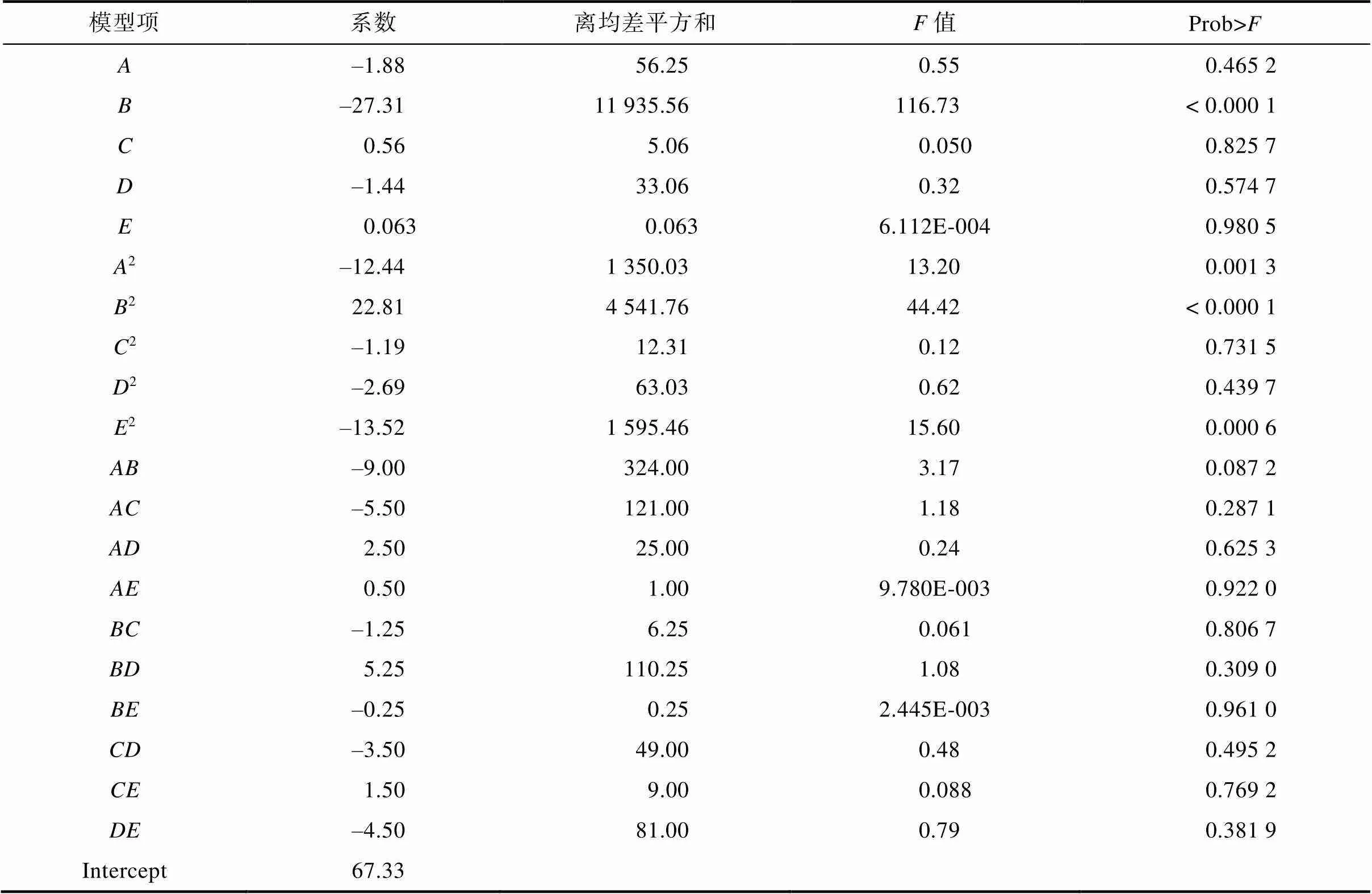
表6 试验结果的均方差分析

表7 二项式模型的方差分析
注:2=0.900 3;2adj=0.820 5。

从左至右:A和B,B和C,A和D,A和E,C和E,D和E交互作用。

表8 响应面试验的优化结果
2.4 优化后的培养基的验证
在优化后的培养基和MRS培养基分别培养GJ00412,经过37 ℃下培养18 h,其生物量比较如表9,GJ00412在2种培养基中得到的生物量并无显著性差异(<0.01)。

表9 优化后培养基和MRS培养基培养GJ00412的对比实验
注:培养时间为18 h。
3 结论
在本研究中,通过Plackett-Burman和Box- Behnken实验设计对干酪乳杆菌GJ00412的传统MRS培养基进行优化。得到优化后的种子培养基配方(w/v)如下:2.5%葡萄糖,1.8%大豆蛋白胨,0.4%酵母浸粉,0.08% MgSO4,0.04% MnSO4,0.08%吐温80,pH 7.17。优化后的培养基与MRS培养基相比,减少4个培养基成分且降低成本。通过同等条件下实验对比,GJ00412在优化后的培养基中生物量相对MRS培养基并无显著差异(<0.01)。以上结果表明,优化后的培养基可应用于干酪乳杆菌GJ00412工业化种子扩培。
[1] 李兴飞. 豆乳清蛋白与多糖的复合作用以及蛋白质组分的选择性提取[D]. 无锡: 江南大学, 2016.
[2] LIU W, ZHANG H X, WU Z L, et al. Recovery of isoflavone aglycones from soy whey wastewater using foam fractionation and acidic hydrolysis[J]. Journal of Agricultural and Food Chemistry, 2013, 61(30): 7366-7372.
[3] 刘国庆, 王占生. 从大豆乳清废水中回收生理活性物质的研究现状与发展前景[J] . 食品研究与开发, 2001, 22(S1): 3-7.
[4] SINGH A, BANERJEE R. Peptide enriched functional food adjunct from soy whey: astatistical optimization study[J]. Food Science Biotechnology, 2013, 22(S): 65-71.
[5] MITRA D, POMETTO A L, KHANAL S K, et al. Value-added production of nisin from soy whey[J]. Applied Biochemistry and Biotechnology, 2010, 162: 1819-1833.
[6] PABLO R, ANGELES F E, ALONSO M, et al. A pilot randomized controlled trial to explore cognitive and emotional efects of probiotics in fibromyalgia[J]. Scientific Reports, 2018, 8: 10965.
[7] 陆文伟, 胡文兵, 曹文金, 等. 干酪乳杆菌LC01对小鼠肠道菌群和肠道转运调节作用的剂量效应[J]. 食品科学, 2019, 40(15): 211-217.
[8] 王四新, 季海峰, 王红卫, 等. 干酪乳杆菌对北京黑猪育肥阶段生长性能和肌肉营养成分含量的影响[J]. 动物营养学报, 2019, 31(1): 469-476.
[9] HUAI L H, CHEN N, BAI G, et al. Optimization of enzyme production conditions ofTS1138 by response surface methodology[J]. Food Science, 2007, 28(12): 336-339.
[10] BOTINA S G, SUKHODOLETS V V. Speciation in bacteria: comparison of the 16S rRNA gene for closely relatedspecies[J]. Genetika-Belgrade, 2006, 42: 325-330.
[11] 食品安全国家标准食品微生物学检验——菌落总数测定: GB 4789. 2—2010[S].
[12] DENG L Y, TANG B. Design selection and classification of Hadamard matrices using generalized minimuma berration criteria[J]. Technometrics, 2002, 44: 173-184.
[13] LOFTY W A, GHANEM K M, EL-HELOW E R. Citric acid production by a novalisolate: II. Optimization of process parameters through statistical experimental designs[J]. Bioresource Technology, 2007, 18: 3470-3477.
[14] QUINN G P, KEOUGH M J. Experimental design and data analysis for biologists[M]. New York: Cambridge University Press, 2002.

Optimization of the seed medium ofGJ00412 isolated from soy whey
HAN Wei, SUN Bo, MIAO Hai-jiang, ZHUANG Xu-hui, Luo Xiao-hong, Zou Hai-jie, Chen Hong-juan, Xie Yan-qi
(Academy of National Food and Strategic Reserves Administration, Beijing 100037, China)
Soy whey (SW) is generated as a process waste during soy isolate protein preparation. SW has low content of soluble sugar and high content of oligosaccharide, which is suitable for the growth of lactic acid bacteria (LAB). In this study, a strain ofGJ00412 (by 16S rRNA genesequencing and identification) was isolated from soy whey. In order to reduce the cost of culture medium, improve its biomass, and facilitate the next utilization, Response surface methodology (RSM) was employed to optimize the composition of seed medium ofBy Plackett-Burman design, sucrose, yeast power, MgSO4, Tween80 and pH value were found to have significant effects on biomass, and were further analyzed by Box-behnken design, an application of response surface. The optimized medium was as follows (w/v): 2.5% sucrose, 1.8% soy peptone, 0.4% yeast powder, 0.08% MgSO4, 0.04% MnSO4, 0.08% Tween80, pH 7.17. The results showed that the cost of the optimized medium was decreased and the biomass ofhas no significant difference when compared with MRS medium.
soy whey;; response surface; Plackett-Burman design
TS214;Q939.97
A
1007-7561(2020)02-0108-07
2019-11-19
中央级公益性科研院所基本科研业务费专项资金课题(ZX1712)
10.16210/j.cnki.1007-7561.2020.02.018
韩伟,1983年出生,男,副研究员,研究方向为粮油食品检验与质量控制.

