Fe3O4@SiO2@Ag复合材料的制备及其光催化性能研究
李晓玲,李 墨,周丹红,刘 磊
宿州学院化学化工学院,安徽宿州,234000
1 相关研究与问题提出
经济高速发展的今天,人们越来越意识到环境保护的重要性。因此,利用催化剂催化降解印染行业的有机废水成为势在必行的研究。在催化剂研究的过程中,人们发现磁性的纳米材料具有其他普通纳米材料所不具备的特点,如量子尺寸效应、表面效应、超顺磁性、高磁化率等诸多优异的性质[1]。磁性纳米Fe3O4材料因其廉价、良好生物相容性、无毒的特点在众多领域中有巨大的应用价值,如在医药方面的药物载体、靶向给药、肿瘤热疗的应用,生物方面的组织修复、细胞分离的应用[2];应用在工业催化及水环境中的重金属吸附、有机染料脱色[3]中。但是,磁性纳米Fe3O4本身也存在很多局限性,其由化学方法制备,容易表面附带一些有机分子官能团,不能直接应用于生物体内,而在水溶液内,易发生团聚和氧化消磁的问题[4]。为了扩大磁性纳米Fe3O4应用范围,通常采取物理或化学方法进行表面改性。物理方法通常指采取吸附、沉积、涂敷等手段将一些无机物质、有机分子和聚合物大分子包覆在磁性纳米Fe3O4材料表面。而化学方法则可以采用经典的Stober法,在酸性或碱性条件下,加入正硅酸四乙酯,水解生成SiO2溶胶包覆于Fe3O4表面。通常采用SiO2作为包覆磁性纳米Fe3O4表面的材料,因为SiO2本身无毒、性质稳定、耐酸,其良好的生物相容性可以包覆在磁性纳米Fe3O4材料表面直接应用于生物体内[5]。且SiO2外壳可以屏蔽磁偶极子相互作用,提高磁性纳米Fe3O4材料的稳定性和分散性,减少团聚现象,由于SiO2外壳具有大量羟基官能团,还可以将某些贵金属Au、Ag等及一些功能分子修饰在SiO2表面,拓展Fe3O4@SiO2复合材料在医药、生物和工业催化方面的应用。由于Ag在医学上优异的抗菌性能及其复合材料对于有机废水的有效催化性能,在有机染料、工业废水的催化应用中均有研究。如周彦昭等[6]采用多步法合成核壳结构的Fe3O4@SiO2-Ag复合材料,使用硼氢化钠为还原剂,在催化降解有机染料罗丹明B的实验中,表现出良好的催化性能,循环催化率达89 %。赵士夺等[7]运用共沉淀法制备出Ag@Fe3O4催化剂,在以硼氢化钠为还原剂,对于对硝基苯酚的催化还原实验中,表现出较高的催化活性。
目前,根据大量相关研究结果表明,以SiO2为包覆材料,磁性Fe3O4颗粒为核结构,并在核壳结构的表面修饰功能性的Ag单质,在有机染料催化降解方面,或作为工业催化剂,医疗抗菌材料等诸多领域中具有巨大的应用价值。本研究采用多步法制备Fe3O4@SiO2@Ag磁性复合材料,并以NaBH4为还原剂,研究该复合材料对有机染料亚甲基蓝和甲基橙的催化性能和循环催化降解率。
2 实验部分
2.1 主要仪器
DX-2600型X射线衍射仪(辽宁丹东方圆仪器有限公司)、ZS90-纳米粒度及Zeta电位分析仪(英国马尔文仪器有限公司)、傅里叶红外光谱仪(美国尼高力公司)、真空干燥箱(上海一恒科学仪器有限公司)、pHS-23型精密PH计(上海尚阔有限公司)、分析天平(常州市天之平仪器设备有限公司)、H/T16MM台式高速离心机(湖南赫西仪器装备有限公司)、722可见分光光度计(上海元析仪器有限公司)。
2.2 实验试剂
聚乙烯吡咯烷酮(GR,国药集团化学试剂有限公司)、七水合硫酸亚铁(AR,国药集团化学试剂有限公司)、六水合氯化铁(AR,国药集团化学试剂有限公司)、硝酸银(AR,西陇科学有限公司)、正硅酸乙酯(AR,西陇科学有限公司)、亚甲基蓝(AR,国药集团化学试剂有限公司)、甲基橙(AR,国药集团化学试剂有限公司)、硼氢化钠(AR,国药集团化学试剂有限公司)。实验用水为超纯水。
2.3 样品的制备
2.3.1 磁性Fe3O4粒子的制备(共沉淀法)
本实验采用共沉淀法制备磁性Fe3O4粒子,因为此合成方法具有简单、高效的特点。首先,制备物质的量之比为1:1的铁盐溶液,配置0.008 mol FeCl3·6H2O和0.008 mol FeSO4·7H2O经超声分散于80 mL去离子水中。其次,配置1 mol/L 的KOH水溶液,随后将铁盐溶液放置在磁力搅拌器上,保持60 ℃恒温、1 000 r/min转速下搅拌0.5 h,并缓慢滴加NaOH(1 mol/L)水溶液至溶液呈黑色,然后继续滴加溶液至pH=11,再加入0.784 g柠檬酸钠,升温至80 ℃恒温磁力搅拌1 h。最后冷却至室温,经去离子水、乙醇洗涤,高速离心后,放入烘箱60 ℃真空干燥12 h,即可制备出亮黑色的磁性Fe3O4粒子。
2.3.2 复合材料Fe3O4@SiO2的制备
取上述制备的磁性Fe3O4粒子,利用传统的Stober法制备Fe3O4@SiO2复合材料。取2 g Fe3O4超声分散于50 mL乙醇水溶液(醇水比3∶1),随后放入磁力搅拌器上,保持30 ℃恒温、300 r/min转速下搅拌,再加入8 mL氨水(25%~28%)和0.6 mL正硅酸四乙酯(TEOS),加热0.5 h后继续加入3 mL正硅酸四乙酯。最后磁力搅拌2 h后,经去离子水、乙醇洗涤,高速离心后,放入烘箱60 ℃ 真空干燥12 h。即可制备棕灰色的Fe3O4@SiO2。
2.3.3 复合材料Fe3O4@SiO2@Ag的制备
取0.1 g上述棕灰色的Fe3O4@SiO2样品加入少量蒸馏水溶解,超声分散,随后加入20 mL 10 mmol/L[Ag(NH3)2]+溶液和葡萄糖乙醇水溶液,并加入30 mL聚乙烯吡咯烷酮(PVP),保持45 ℃ 磁力搅拌1 h。最后,经高速离心、乙醇和去离子水洗涤后,放置于真空干燥箱60 ℃ 烘干,即可制备出Fe3O4@SiO2@Ag复合材料。
3 实验结果与分析
3.1 复合材料Fe3O4@SiO2@Ag的表征
3.1.1 XRD表征分析
图1所示,(a)(b)(c)分别是Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@Ag样品的XRD图谱,其中(a)的六处尖锐的衍射峰位置与标准物质Fe3O4的标准卡(JCPDS NO.72-2303)完全对应,其2θ 数值为30.2、35.4、43.2、53.8、57.2、62.8分别对应Fe3O4的(220)(311)(400)(422)(511)和(440)晶面。而(b)中的SiO2是非晶体,没有明显的吸收峰,与(a)的XRD图谱没有明显区别。从(c)的XRD图谱可以看出,其凸出4处衍射峰,经过标准物质Ag的标准卡(JCPDS NO.04-0783)比对,对应衍射峰位置完全一致。(c)的2θ =38.0、44.2、64.2、77.2分别对应Ag的(110)、(200)、(220)、(311)的晶面。经XRD图谱分析,表明该复合材料成功负载了单质Ag颗粒。
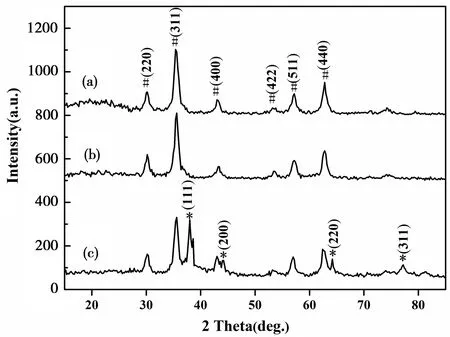
图1 Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@Ag的XRD图谱
3.1.2 傅里叶红外光谱表征分析
图2(a)(b)(c)分别是Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@Ag样品的傅里叶红外光谱曲线,581 cm-1处是物质Fe3O4对应的是特征峰,由图可以看出,(b)(c)在470 cm-1、800 cm-1、1 093 cm-1处有吸收峰,经分析认为在470 cm-1、800 cm-1处的吸收峰是Si-O对称伸缩振动峰,而在1 093 cm-1附近的是最为显著Si-O-Si反振动伸缩振动峰[8]。这证明了(b)和(c)中均含有SiO2物质,其中,处于1 629 cm-1、3 434 cm-1两处的吸收峰都是H2O的特征吸收峰,说明制备的样品表面含有水分。由于红外对金属没有吸收峰,因此Ag不会产生任何红外吸收峰,与所测傅里叶红外图谱展示结果一致,并没有多余特征吸收峰。结合XRD的分析结果,说明成功制备了Fe3O4@SiO2@Ag复合材料。
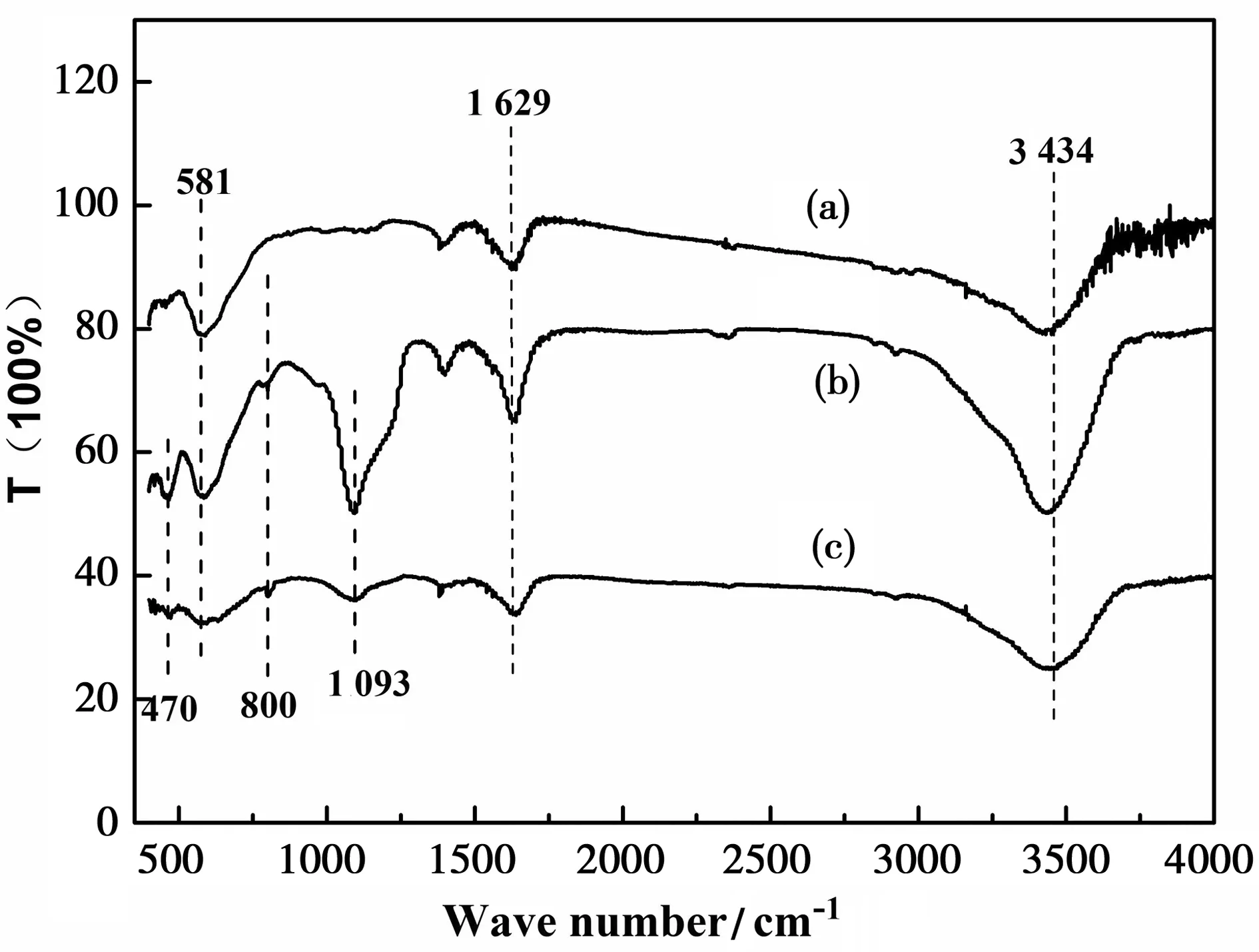
图2 Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@Ag的FT-IR图谱
3.1.3 粒度分析
图3所示,(a)(b)(c)分别是Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@Ag样品的粒度分布图,Fe3O4的样品粒径大致集中在71 nm,Fe3O4@SiO2颗粒粒径集中分布在127 nm,而Fe3O4@SiO2@Ag样品粒径大致集中分布在230 nm,表明制备出的Fe3O4属于纳米结构材料,Fe3O4@SiO2属于微纳结构材料,Fe3O4@SiO2@Ag属于微纳结构材料。
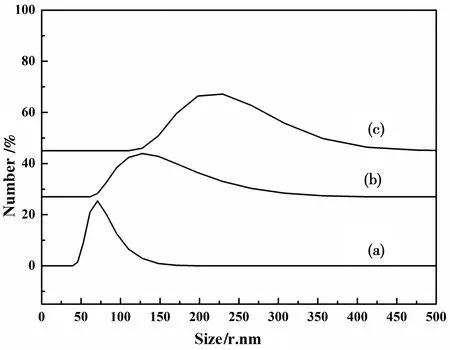
图3 Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@Ag的粒度分布
3.1.4 利用磁铁对样品进行吸引
在室温条件下,通过磁铁分别吸引Fe3O4粒子,复合材料Fe3O4@SiO2及Fe3O4@SiO2@Ag,验证了制备的样品具有较好的磁性。
4 复合材料的催化性能研究
4.1 有机染料亚甲基蓝的催化降解实验
实验在避光、磁力搅拌下完成,以有机染料亚甲基蓝的脱色率作为衡量催化性能的指标,取50 mL 10 mg/L的亚甲基蓝于100 mL烧杯中,随后加入5 mL 0.1 mmol/L的硼氢化钠溶液,分别加入5、10、20、30、40 mg的Fe3O4@SiO2@Ag复合催化剂,反应为每间隔5 min测量一次吸光度变化。取样并离心后,在660 nm波长下,测量的吸光度值用公式(1)计算出脱色率(η),以脱色率表征催化剂的催化率。
η=(A0-At)/A0×100 %
(1)
公式(1)中,η为脱色率(催化率),A0有机染料初始吸光度值,At反应t时的吸光度值。
从图4可以看出,当加入催化剂的质量为10 mg时,达到最高的催化效率为96.0 %,而当加入的催化剂量较少时(5 mg),催化效率为92.3%明显低于10 mg时的催化效果,可能是催化剂的加入量较少,催化效果不明显。当催化剂加入量较多时(40 mg),其催化效率也降低了(93.7 %)。可能是加入的催化剂浓度过高,易于团聚从而降低催化效率。
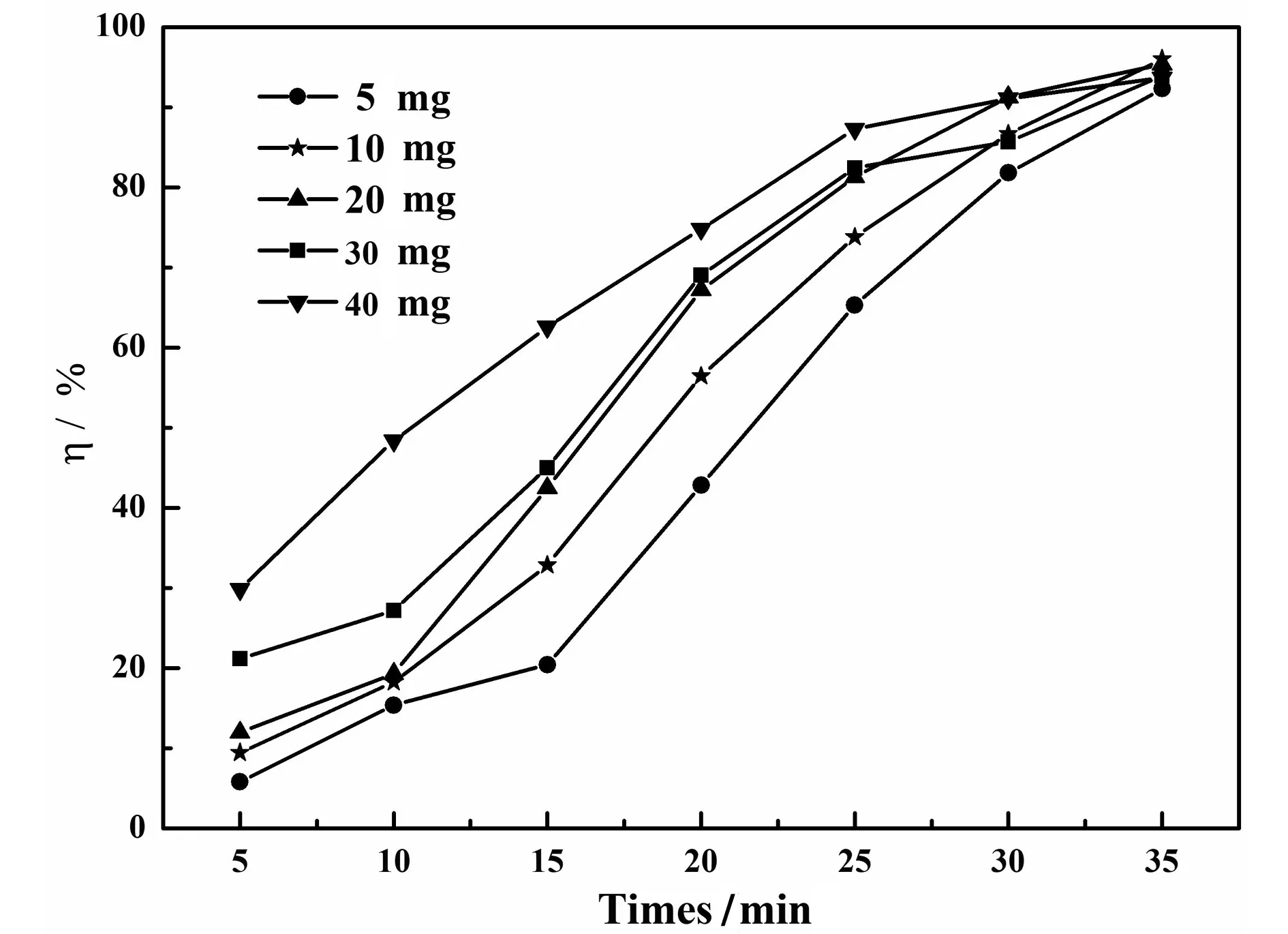
图4 催化效率与反应时间
4.2 循环催化降解性能(亚甲基蓝)
由于复合材料中Fe3O4磁性内核可以回收,重复利用,所以,选择加入质量为10 mg的复合催化剂,在避光下进行循环催化降解实验。
从图5可以看出,Fe3O4@SiO2@Ag复合催化剂经过5次循环后,催化降解率为83 %,表现出较好的循环催化能力。据分析,循环催化能力下降的因素可能是循环过程中催化剂质量的损失或测试过程中加入的还原剂(硼氢化钠)对核壳表面的刻蚀作用,造成单质Ag的脱落[9],从而降低了循环催化性能。
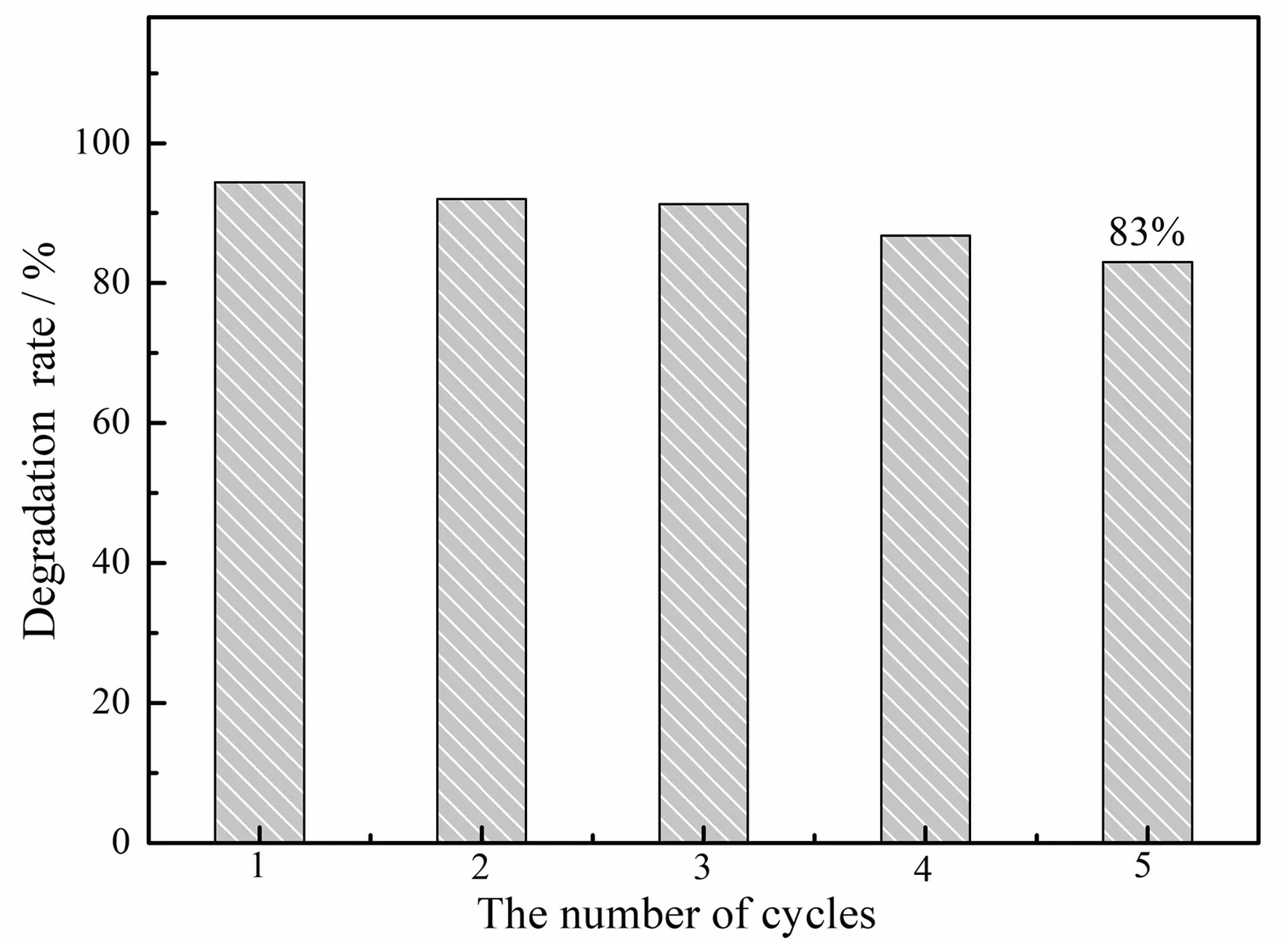
图5 循环催化次数与降解率
4.3 有机染料甲基橙的催化降解实验
甲基橙是印染工业的一种常见染料,本文选用Fe3O4@SiO2@Ag复合催化剂对甲基橙进行催化降解,通过公式(1)计算出的脱色率作为表征催化剂催化效果的指标。实验在避光环境中进行,先取100 mL 20 mg/L的甲基橙溶液作为降解的底物;再加入10 mg 的Fe3O4@SiO2@Ag复合催化剂,超声分散3 min后,在避光环境中进行磁力搅拌0.5 h,以达到吸附-脱附平衡;最后加入5 mL 0.1 mmol/L的硼氢化钠溶液,每间隔5 min取一次溶液,离心后在463 nm波长下测出吸光度值并计算出脱色率。
从图6可以看出,Fe3O4@SiO2@Ag的催化性能较好,其脱色率最高为89%,说明其能够催化降解甲基橙染料,且用时短暂(20 min)。
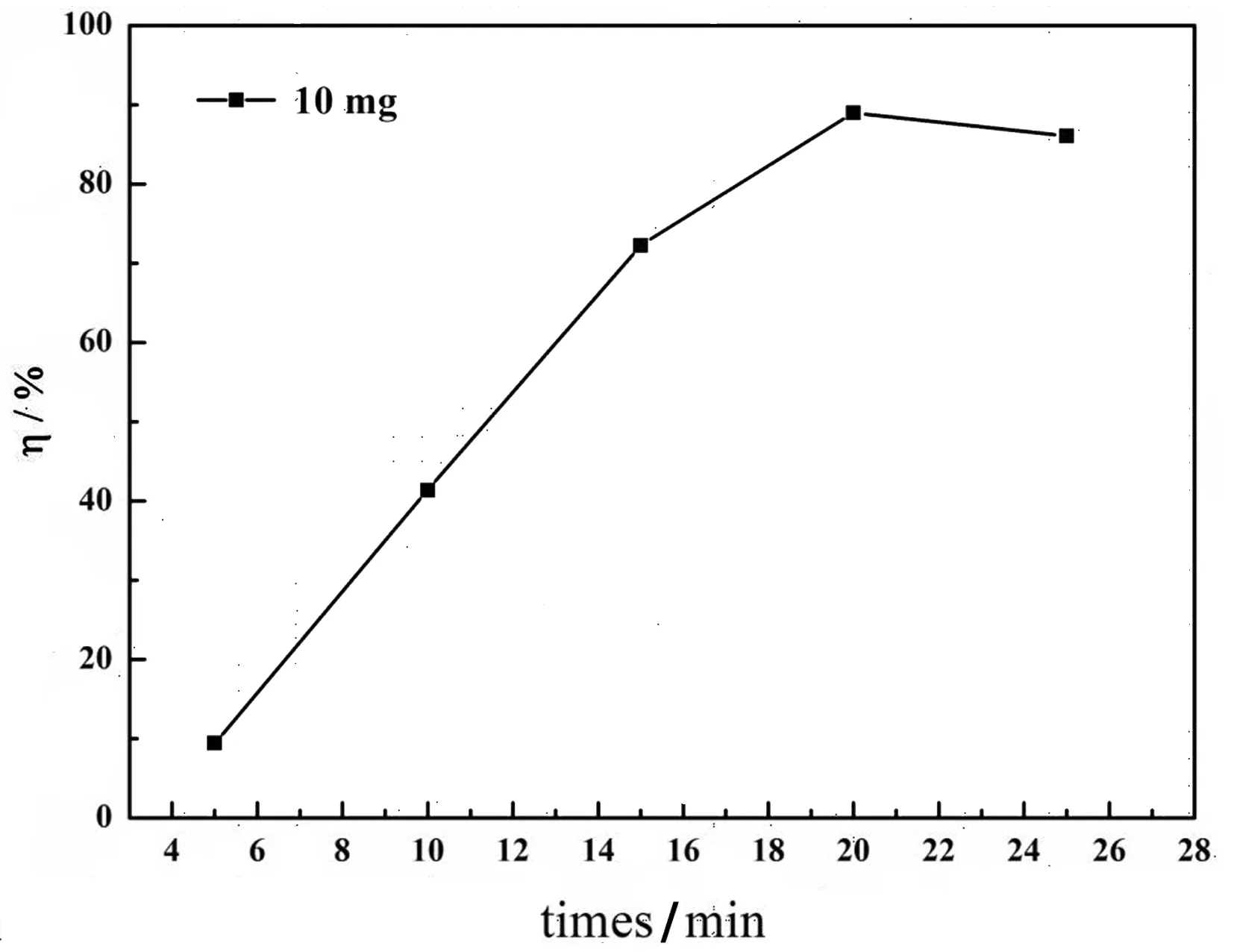
图6 催化效率与反应时间
4.4 循环催化降解性能(甲基橙)
催化实验完成后,利用磁分离将样品收集。并用乙醇和去离子水多次洗涤,最后,放入真空干燥箱保持60 ℃进行烘干12 h,进行循环催化性能实验。从图7可以知道,经过5次循环催化后,Fe3O4@SiO2@Ag的催化性能逐渐降低,催化降解率为82.2%。经分析可能是在回收过程中造成的催化剂质量损失。
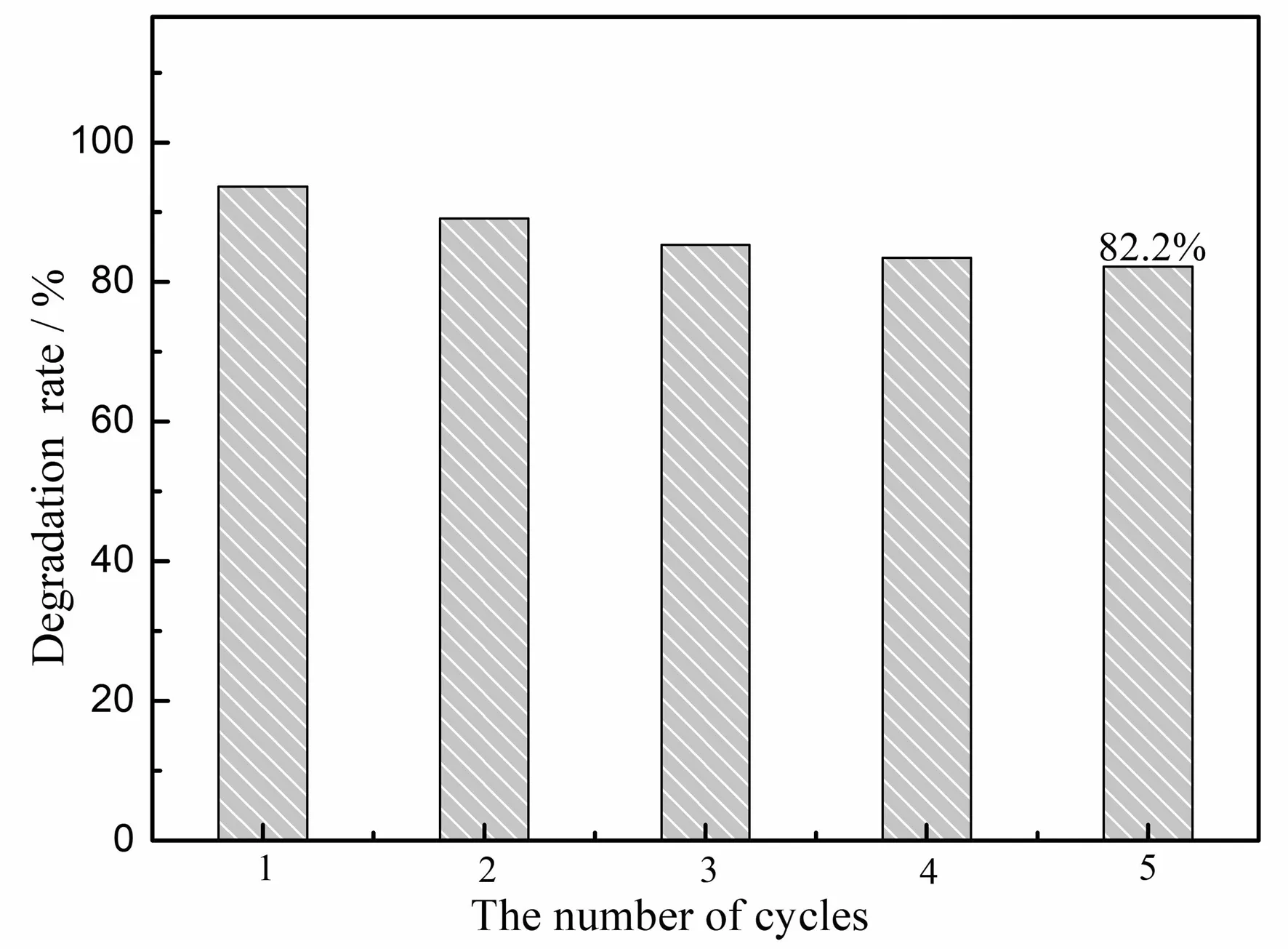
图7 循环催化次数与降解率
5 结 论
本文以多步法制备出Fe3O4@SiO2@Ag磁性复合催化剂,用聚乙烯吡咯烷酮(PVP)为分散剂和稳定剂,分散溶液中的Ag离子,以葡萄糖乙醇水溶液作为还原剂,使Ag离子还原为单质Ag附着于Fe3O4@SiO2外壳表面。选用有机染料甲基橙和亚甲基蓝作为催化底物并加入染料还原剂(硼氢化钠),在避光、磁力搅拌下,进行催化性能实验和循环催化实验。
结果表明,Fe3O4@SiO2@Ag对亚甲基蓝、甲基橙底物催化后的脱色率分别为96.0%、89.0%,表现出较好的催化降解性能,经5次循环催化后,复合催化剂的循环催化性能仍为83.0 %、82.2 %,说明以磁性Fe3O4作为内核,循环回收率较好,有望作为一种可循环回收利用、高效催化的复合催化剂。

