SDF-1/CXCR4在子宫内膜异位症合并不孕患者子宫内膜表达
姚燕婷 赵 霞 宋 勤
浙江省杭州市第三人民医院(310009)
不孕症女性合并子宫内膜异位症为25%~40%,而子宫内膜异位症患者中合并不孕症占比达30%~50%[1]。子宫内膜异位症与不孕症有关是临床共识,提出 “子宫内膜异位症相关不孕症”概念。目前认为解剖结构变化、心理因素、内分泌及免疫因素是子宫内膜异位症患者发生不孕的主要原因,但具体机制未明确[2]。趋化因子受体4(CXCR4)与基质细胞衍生因子-1(SDF-1)与肿瘤细胞增殖和侵袭有关,两种因子在子宫内膜异位症的发生发展中也发挥着重要作用[3]。而子宫内膜异位症细胞异常增殖和侵袭导致的解剖结构异常是引起不孕的重要原因[4]。本研究观察CXCR4、SDF-1在子宫内膜异位症患者子宫内膜表达水平,分析其与子宫内膜异位症合并不孕的相关性。
1 资料与方法
1.1 一般资料
回顾性收集本院2016年12月-2019年5月收治的子宫内膜异位症患者为异位症组。入组标准:子宫内膜异位症按相关诊治指南[5]确诊;病理标本经手术或宫腔镜检查获取,病理资料完整;入组前3个月未接受激素类药物治疗。排除标准:合并严重代谢性或免疫疾病;重要脏器功能障碍;凝血功能障碍;合并恶性肿瘤。另选取同期行手术治疗的子宫肌瘤患者为子宫肌瘤组。研究经医院医学伦理委员会批准,患者均签署知情同意书。
1.2 研究方案
根据病情分期及是否合并不孕症对异位症组分组,按病情分期分为Ⅰ期组、Ⅱ期组、Ⅲ期组、Ⅳ期组,按否合并不孕症分为不孕组和非不孕组。采用免疫组化检测各组患者病理标本中CXCR4、基质金属蛋白酶-9(MMP-9)、SDF-1及血管内皮生长因子(VEGF)水平,分析与不孕症相关性。
1.3 免疫组化分析
标本常规固定、包埋、切片并脱蜡,磷酸缓冲液浸泡300 s,热抗原修复(PH 6.0);3%双氧水去离子水孵育标本600 s,消除内源性过氧化氢酶;山羊血清工作液封闭标本,23~264℃ 900 s。1%稀释CXCR4、MMP-9、SDF-1及VEGF一抗,将一抗稀释液滴入标本4℃过夜;将对应的二抗滴入在374℃ 900 s;最后加入辣根酶标记链霉卵白素工作液,37℃ 900 s;二氨基联苯胺法显色,依次复染、脱水、透明并封片;采用S-P法进行染色。胞浆显示棕黄色颗粒者判为阳性染色细胞。采用自动图像分析软件分析染色结果,平均光密度作为各因子的相对表达强度。每张切片随机检查5个视野(×400),取平均值作为结果。
1.4 统计学分析
2 结果
2.1 一般临床资料
异位症组164例,年龄(38.8±4.2)岁(32~43岁),体质指数(BMI)(22.4±0.7)kg/m2,病程(6.8±2.4)个月。子宫肌瘤组50例,年龄(38.5±4.6)岁(30~45岁),BMI(22.4±0.7)kg/m2,病程(6.9±2.5)个月。两组比较无差异(P>0.05)。
2.2 不同分期患者免疫组化结果比较
异位症组SDF-1、CXCR4、MMP-9及VEGF水平随患者病情进展而增高,且均高于对照组 (P<0.05), 见表1、图1~4。相关性分析,SDF-1、CXCR4表达水平均与MMP-9和VEGF表达水平呈正相关(r=0.683,0.701,0.695,0.674)。
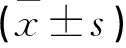
表1 异位症不同病情分期与对照组免疫组化结果比较
2.3 不孕组与非不孕组免疫组化结果比较
异位症组中不孕患者SDF-1、CXCR4、MMP-9及VEGF水平均高于非不孕患者 (P<0.05)。见表2。
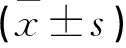
表2 异位症组不孕症与免疫组化结果比较

图1 子宫内膜异位组织中SDF-1表达(×400)

图2 子宫内膜异位组织中CXCR4表达(×400)

图3 子宫内膜异位组织中MMP-9表达(×400)

图4 子宫内膜异位组织中VEGF表达(×400)
3 讨论
不孕症多在中重度子宫内膜异位症患者中发生,主要与患者盆腔解剖结构改变有关[6]。内膜细胞广泛散播种植,引起盆腔腹膜粘连使器官位置及解剖结构改变。而以上改变可能对输卵管和卵巢功能产生影响。研究显示,病灶分布在输卵管浆膜面时可导致输卵管扭曲粘连,严重者可导致输卵管梗阻[7]。同时,粘连还可对输卵管蠕动产生影响,导致卵细胞摄取和受精卵运行过程受到影响。而分布于卵巢的病灶可导致卵巢因粘连包裹无法排除卵子。还有研究发现,病灶破坏卵巢实质后卵子生成也会减少[8]。病灶分布在宫旁组织时可能导致因子宫后倾精子无法进入宫腔[9]。因此,子宫内膜细胞的异常增殖和侵袭是导致不孕症发生的重要原因。
SDF-1是CXC趋化因子的一种亚型,而CXCR4是它的特异性受体。近年研究发现SDF-1与CXCR4结合后形成的SDF-1/CXCR4与肿瘤发病紧密相关[10]。Xu等[11]研究证实,SDF-1/CXCR4可促进肿瘤细胞增殖和侵袭,构成了肿瘤细胞形成和转移的基础。进一步研究发现,SDF-1/CXCR4主要通过促进基质金属蛋白酶的高水平表达提高肿瘤细胞侵袭作用[12]。还有研究发现,SDF-1/CXCR4还可通过激活PI3K/AKT信号通路促进VEGF高水平表达,进而促进肿瘤细胞生长和转移[13]。有研究将小鼠CXCR4基因敲除后发现VEGF生成量减少,转移瘤的生长和血管生成也受到抑制,提示SDF-1/CXCR4对肿瘤细胞核侵袭极其重要[14]。
子宫内膜异位症与恶性肿瘤有着相似的生物学特征,近年来研究证实SDF-1/CXCR4在子宫内膜异位症组织中高水平表达,介导了子宫内膜增殖和侵袭过程[15]。本次研究也发现,子宫内膜异位症患者SDF-1、CXCR4、MMP-9及VEGF水平随病情的进展而增高且均高于对照组。相关性分析SDF-1、CXCR4表达水平均与MMP-9和VEGF表达水平呈正相关。证实SDF-1/CXCR4与子宫内膜异位症的发生发展有关,可能主要通过影响VEGF和MMP-9的表达水平实现,具体机制还有待进一步研究。本次研究还发现,异位症组不孕患者的SDF-1、CXCR4、MMP-9及VEGF水平均高于非不孕者,表明SDF-1/CXCR4的高水平表达加重了子宫内膜异位症病情,进而导致不孕症。
既往研究发现。SDF-1/CXCR4可促进人类胚胎着床过程[16]。通过调节母-胎界面的滋养层细胞侵袭作用,使其粘附在子宫壁完成妊娠生理过程[17]。同时还可激活抗凋亡信号传导途径,保证滋养层细胞保持存活状态[18]。有研究证实SDF-1/CXCR4基因表达下降可导致辅助生育技术植入失败[19]。但在子宫内膜异位症患者中,由于卵巢储备功能及卵子质量下降,即使采用辅助生殖技术也无法有效改善卵巢反应性和临床妊娠率。同时,子宫内膜异位症患者局部或全身炎症、以及激素表达紊乱均可能对胎盘血管生长、滋养细胞浸润等过程产生不良影响,导致胎盘功能减退[20]。因此,综合作用下SDF-1/CXCR4对胚胎着床的促进作用无法实现。
综上所述,SDF-1/CXCR4可能通过参与了子宫内膜增殖、侵袭过程而导致不孕发生。

