镍对红裸须摇蚊幼虫的毒性效应
石雅峰 龙辰 赵枞 李若群 闫春财 刘文彬

摘要 [目的]以紅裸须摇蚊(Propsilocerus akamusi)幼虫为暴露对象,研究重金属镍对红裸须摇蚊幼虫的毒性及其对抗氧化酶系统的影响。[方法]采用急性毒性试验方法,计算半数致死浓度(LC50)。采用考马斯亮蓝G-250法测定蛋白质含量,采用可见光法测定CAT活性,采用WST-1法测定SOD活性,采用比色法测定POD活性。[结果]重金属镍对红裸须摇蚊4龄幼虫24、48、72、96 h LC50分别36.58、 12.36、2.21和0.66 mmol/L。镍胁迫红裸须摇蚊24 h后,各浓度组SOD和CAT活性均没有显著变化。48 h和72 h后,各浓度组与对照组存在显著差异;96 h后,SOD活性仅在高浓度时表现为显著增强的效应,各浓度组CAT活性表现为增强效应。
在24 h和48 h后,POD活性均没有显著变化,72 h后各浓度组POD活性呈现增强的趋势,96 h后POD 活性逐步下降。[结论]CAT和SOD活性在急性暴露期受到显著诱导,表现出相似的变化规律。POD活性表现为先下降后上升的趋势。
关键词 红裸须摇蚊;重金属镍;急性毒性试验;抗氧化酶
中图分类号 X 174文献标识码 A
文章编号 0517-6611(2020)04-0084-04
doi:10.3969/j.issn.0517-6611.2020.04.025
开放科学(资源服务)标识码(OSID):
Toxic Effects of Nickel Exposure on Propsilocerus akamusi Larva
SHI Ya-feng,LONG Chen,ZHAO Cong et al (College of Life Sciences,Tianjin Key Laboratory of Animal and Plant Resistance,Tianjin Normal University,Tianjin 300387)
Abstract [Objective] To investigate the toxicity of heavy metal Ni to the larvae of Propsilocerus akamusi and its influences on the antioxidant enzymes system with P.akamusi as exposure object.[Method] Using acute toxicicity test method,the medium lethal concentration (LC50) was calculated by using SPSS software.The protein content was determined by Coomassie Brilliant Blue G-250 method,CAT activity was determined by visible light method,SOD activity was determined by WST-1 method,and POD activity was determined by colorimetry.[Result]LC50 of heavy metal nickel to 4-instar larva of P.akamusi for 24,48,72 and 96 h were 36.58,12.36,2.21,and 0.66 mmol/L,respectively.There was no significant change in SOD and CAT activities after Nickel exposure to P.akamusi larvae 24 h. After 48 and 72 h, there were significant differences between each concentration group and the control group.After 96 h,SOD activity was only significantly enhanced at high concentrations,while CAT activity was enhanced in each concentration group. POD activity showed no significant change after 24 h and 48 h,and POD activity in each concentration group showed an enhanced trend after 72 h and POD activity gradually decreased after 96 h.[Conclusion]The activities of CAT and SOD were significantly induced during acute exposure,showing similar changes.POD activity presented an first decreasing and then increasing trend.
Key words Propsilocerus akamusi;Heavy metal Nickel;Acute toxicity test;Antioxidant enzymes
在过去的几十年里,有毒重金属导致的水体污染引起了人们的广泛关注[1-3],与有机污染物不同的是重金属污染物无法被生物降解、具有很强的生物富集效应且对土壤的污染不可逆,对环境有较大的破坏力[4]。镍是一种在自然界中广泛存在的重金属,镍和镍化合物有较高的生产价值,比如镍矿的开采和提纯、电镀和镍镉电池的生产等[5]。工业化进程加重了水生生态系统的重金属污染状况。在常规水体环境中,Ni2+浓度为1~10 μg/L,但在一些严重污染的水体中镍的排放量会增加50~100倍[6]。
摇蚊幼虫是典型的水生无脊椎动物,主要生活于淡水水域的底栖环境中,不仅是经济鱼类的饵料,而且是水环境生物监测良好的指示生物[7]。红裸须摇蚊幼虫抗逆性强、易于获取、价格低廉,具有广阔的市场前景。目前对红裸须摇蚊幼虫的毒理学研究主要集中在重金属铜、铬、汞等、农药及其他有机污染物方面,以单一或复合污染物暴露的方式开展急性和慢性毒性试验,并对污染物胁迫下抗氧化酶系和解毒酶系的活性水平进行了广泛深入的研究[8-10]。此外,在基因组学、蛋白质组学方面也取得了一定的进展[11]。
动物体内的抗氧化酶系,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等是抗氧化应激的第一道防线,可以在个体遭遇不良环境时,清除体内不断产生的氧自由基,保护细胞免受氧化损伤,从而使个体耐受性增强。关于逆境胁迫下红裸须摇蚊幼
虫体内酶活性的变化,耿飞飞等[8]研究发现红裸须摇蚊对Hg2+胁迫的敏感性较强,Hg2+刺激后其体内过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、谷丙转氨酶(GST)都有显著变化。郑先云等[12]研究发现红裸须摇蚊对Cd2+胁迫的敏感性较低,在Cd2+短时间作用下CAT活性没有显著变化。
综上可知,国内外学者对重金属Cd2+、Cd2+、Hg2+及多种有机物的毒性试验[13-14]已取得较大进展,但Ni2+胁迫下红裸须摇蚊的毒性效应研究较少涉及。笔者探究红裸须摇蚊体内不同抗氧化酶对重金属镍的响应水平,旨在为红裸须摇蚊的生物监测及Ni2+的排放标准制定提供理论依据,为进一步揭示Ni2+对水生无脊椎动物的毒性作用机理提供数据支撑。
1 材料与方法
1.1 材料
红裸须摇蚊幼虫购于天津花鸟鱼虫市场,以头壳宽度鉴定龄期,选取活性较高、体长一致的4龄摇蚊幼虫作为试验材料。幼虫的平均体重为(0.017±0.004)g,平均体长为(0.95±0.11)cm。在开始试验前,幼虫用曝气除氯48 h的自来水(pH 8.2,溶解氧含量7.7~9.6 mg/L,总硬度7.1 mmol/L,水体温度20 ℃)在自然光照下驯养7 d,试验期间每天换水1次,每天多次监测水质指标,发现异常时及时换水并将死亡的摇蚊幼虫挑出,直至幼虫的自然死亡率稳定且小于1%时开展试验,驯养期间水体持续曝气,幼虫采用饥饿处理。
氯化镍(NiCl2·6H2O),由天津市津科精细化工研究所提供。过氧化物酶(POD)测试盒、超氧化物歧化酶(SOD)测定试剂盒、过氧化氢(CAT)试剂盒、Bradford蛋白质定量试剂盒,购自南京建成生物工程研究所。
1.2 方法
1.2.1 重金屬的急性毒性试验。
试验依据《化学品 沉积物-水系统中摇蚊毒性试验》国家标准[15]以及OECD[16]等相关规定进行,严格遵守实验室安全规范。采用静水染毒法进行毒性测定,在预试验的基础上,用蒸馏水等比例配制成镍离子浓度分别为4.21、8.42、16.84、33.68、67.36 mmol/L的5个剂量组,在200 mL烧杯中进行试验,每个容器中放入50只摇蚊幼虫并以蒸馏水作为空白对照。每个浓度设置3个重复,试验期间不投喂饵料。在试验开始后24、48、72、96 h,观察并记录红裸须摇蚊幼虫的存活情况及活动状态。用玻璃棒以中等力度触碰摇蚊幼虫腹部5~6节处,若摇蚊幼虫未出现蜷缩运动则视为死亡。
1.2.2 酶活的测定。
1.2.2.1 酶液的制备。在急性毒性试验的基础上,以96 h LC50为参照,设置0、0.10、0.20、0.40、0.80、1.60 mmo/L的镍离子浓度梯度进行急性暴露试验。在暴露24、48、72、96 h时取不同Ni2+浓度胁迫下存活的摇蚊幼虫12只,各浓度组和对照组均进行3次重复,取出的摇蚊幼虫用滤纸吸干体表水分,按照1∶9(m/V)的比例加入生理盐水,在冰水浴条件下用研磨棒将摇蚊幼虫研磨成10%的组织匀浆,2 500 r/mi下离心10 min后,取上清液进行测定。
1.2.2.2 酶活测定方法。严格按照SOD、POD、CAT试剂盒所标示的方法测定酶活,采用考马斯亮蓝G-250法测定蛋白质含量,采用可见光法测定CAT活性,采用WST-1法测定SOD活性,采用比色法测定POD活性。
1.2.3 数据处理。
采用SPSS软件中的Probit模块计算红裸须摇蚊在不同浓度、不同时间处理下的半数致死浓度(LC50)、线性回归方程、95%置信区间和相关系数。采用ANOVA方差分析进行LSD多重比较,分析同一时间不同浓度以及不同时间相同浓度条件处理下各种酶活的变化。
2 结果与分析
2.1 红裸须摇蚊幼虫的中毒表现
接触重金属镍溶液初期,试验组摇蚊幼虫活动剧烈,出现虫体间缠绕的现象;暴露24 h后,各浓度组幼虫活动情况与对照组均无显著差异,但体色由红色变为偏棕黄色;暴露48~72 h时,各浓度组摇蚊幼虫活力显著降低,处于静止状态,但触碰活体摇蚊幼虫腹部仍能观察到蜷缩反应,对照组摇蚊自由游动。暴露96 h后,观察到死亡的红裸须摇蚊幼虫身体发黑变软,漂浮于溶液表面。
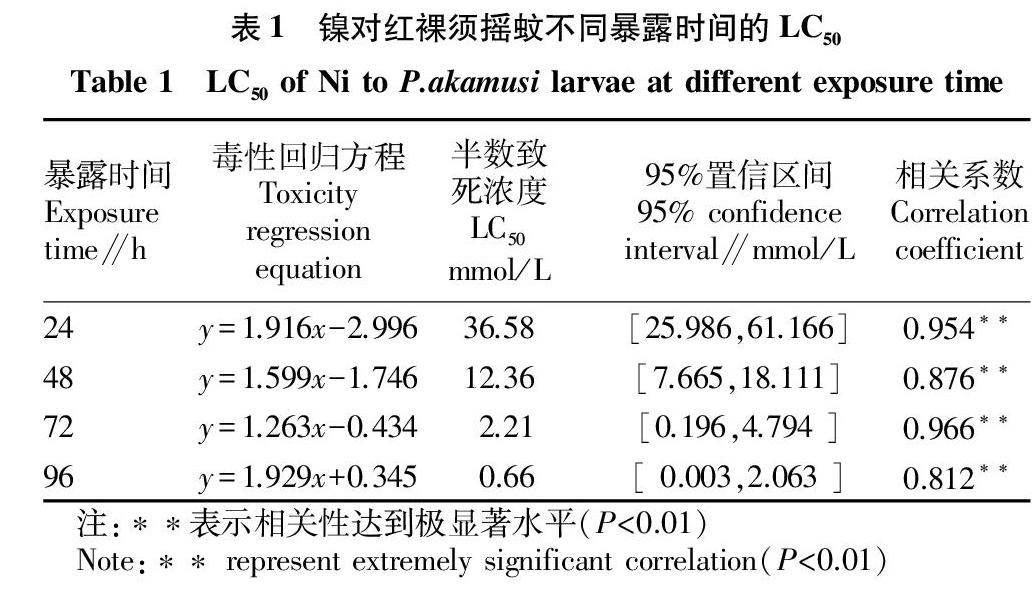
2.2 金属镍对红裸须摇蚊幼虫的急性毒性
由表1可知,重金属镍对红裸须摇蚊4龄幼虫24、48、72、96 h的LC50分别为36.58、 12.36、2.21和0.66 mmol/L。
2.3 红裸须摇蚊幼虫抗氧化酶对Ni2+的胁迫响应
2.3.1 镍胁迫对红裸须幼虫不同暴露时间蛋白质含量的影响。
由表2可知,24 h时,低浓度组的镍离子对蛋白质含量无显著影响,而高浓度组会使蛋白质含量显著降低,当镍离子达到最高浓度(1.6 mmol/L)时蛋白质含量降至(35.35±0.18) g/L。48 h时,与对照组相比,高浓度组的蛋白质含量存在显著变化,而其余组别与对照组无明显差异。72 h时,随着Ni2+浓度的增大,Ni2+诱导蛋白质含量升高的作用增强。96 h时,与对照组相比,各浓度组蛋白质含量均显著升高。由此可见,高浓度的镍短时间内可对红裸须摇蚊幼虫的靶标酶产生抑制作用,但随着作用时间的延长,体内其他靶标酶被诱导增强,提高了蛋白质浓度。
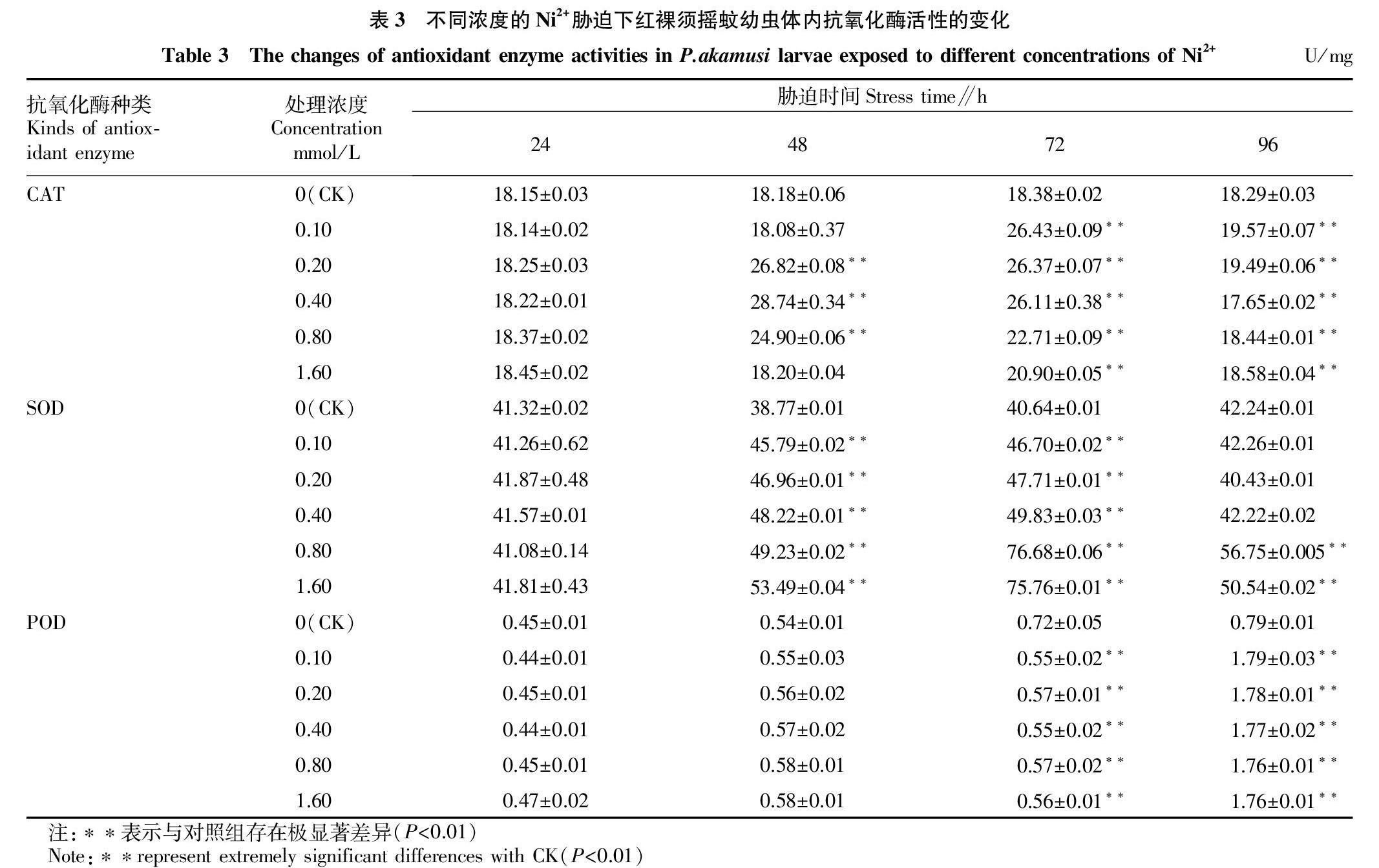
2.3.2 镍胁迫对红裸须摇蚊幼虫体内抗氧化酶活性的影响。
红裸须摇蚊幼虫在不同浓度梯度的Ni2+胁迫24、48、72、96 h后体内抗氧化酶活性的变化见表3。
2.3.3 镍胁迫对红裸须摇蚊幼虫体内SOD活性的影响。
如图1所示,镍胁迫红裸须摇蚊24 h时,各浓度组的SOD活性与对照组相比没有显著变化。48 h后,各浓度组的SOD活性均显著升高,当Ni2+浓度为1.6 mmol/L时SOD活性达到最大值。72 h,在0.80 mmol/L的Ni2+胁迫下SOD受到的诱导程度最大,为(76.75±0.005) U/mg。96 h,SOD活性在高浓度时显著下降,但SOD活性仍高于对照组。
2.3.4 镍胁迫对红裸须摇蚊幼虫体内CAT活性的影响。由图2可知,24 h时各浓度组CAT活性无显著变化;48 h时,Ni2+浓度分别为0.2、0.4、0.8 mmol/L的试验组CAT活性显著增强(P<0.01)。72和96 h,各浓度组CAT活性均极显著升高(P<0.01)。72 h,各浓度组CAT活性均高于对照组;96 h,CAT活性相对于72 h时有所下降,但始终高于对照组。
2.3.5
镍胁迫对红裸须摇蚊幼虫体内POD活性的影响。从图3可以看出,24、48 h时各浓度组POD活性与对照组相比无明显变化;72 h,POD活性明显下降(P<0.01);96 h,POD活性显著增强(P<0.01)。POD活性整体上呈现出前期无明显变化、中后期先下降后上升的变化趋势。
3 讨论
通过急性毒性试验发现,重金属镍对红裸须摇蚊4龄幼虫24、48 h的LC50分别为36.58和12.36 mmol/L,与闫宾萍等[17]研究镍对羽摇蚊幼虫的急性毒性结果相比,紅裸须摇蚊幼虫比羽摇蚊幼虫对镍有更强的耐受性。Wentsel等[18]的研究结果为摇蚊具有较强耐受重金属的能力提供了数据支撑。
近年来,大量研究结果表明,抗氧化酶活性可作为环境监测的生物标志物。该试验通过镍对红裸须摇蚊幼虫进行24、48、72、96 h的急性暴露试验,监测幼虫体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性的变化,进而揭示环境水体中重金属镍的生物响应情况。该试验结果表明,短时间内红裸须摇蚊幼虫对镍的敏感程度低,随着作用时间的延长,SOD活性呈现显著增强的趋势,诱导产生的SOD用来消除镍对红裸须摇蚊幼虫的活性损伤,96 h后氧自由基减少,SOD活性又逐渐恢复到正常状态。CAT活性的变化趋势与SOD活性大致相同,但96 h后CAT活性仍被显著诱导,用来清除SOD作用氧自由基后产生的H2O2。72 h后,各浓度组POD活性与对照组相比显著降低,但96 h POD活性又逐渐回升至显著高于对照组的水平。
综上所述,重金属镍对红裸须摇蚊体内抗氧化酶活性有较大影响,CAT、SOD和POD活性均可作为监测重金属镍对环境影响的指标,CAT活性与SOD活性具有相同的变化趋势,但CAT活性的变化响应在SOD活性之后表现出协同作用。
POD活性呈现出先下降后上升的变化趋势,有可能是CAT、SOD活性的显著增强抑制了POD的活性,随着作用时间的延长,SOD活性在逐步减弱的同时,POD活性显著上升。然而,此变化的分子机理还有待进一步研究。
参考文献
[1]
RAI P K.Heavy metal phytoremediation from aquatic ecosystems with special reference to macrophytes[J].Critical reviews in environmental science and technology,2009,39(9):697-753.
[2] 张建江,贾继民,马永红.中国重要水系的有毒重金属污染状况[J].职业与健康,2011,27(1):89-91.
[3] 朱贤英.论有毒重金属污染对人体健康的危害及饮水安全[J].湖北教育学院学报,2006,23(2):72-74.
[4] NAGAJYOTI P C,LEE K D,SREEKANTH T V M.Heavy metals,occurrence and toxicity for plants:A review[J].Environmental chemistry letters,2010,8(3):199-216.
[5] 陈素秋.镍的性质及用途[J].重有色冶炼,1980(10):59-62.
[6] EISLER R.Nickel hazards to fish,wildlife,and invertebrates:A synoptic review[R].Patuxent Wildlife Research Center,1998.
[7] ARMITAGE P D,CRANSTON P S,PINDER L C V.The Chironomidae.The biology and ecology of non-biting midges[M].London:Chapman and Hall,1995.
[8] 耿飞飞,于洪贤,刘曼红,等.汞胁迫对红裸须摇蚊幼虫抗氧化酶活性的影响[J].东北林业大学学报,2018,46(4):97-100.
[9] 葛士林,曹传旺,王志英.3种农药对红裸须摇蚊体内蛋白质质量分数和AChE活性的影响[J].东北林业大学学报,2011,39(1):108-109,126.
[10] 李浩.铜和镉对羽摇蚊幼虫(Chironomus plumosus)和红裸须摇蚊幼虫(Propsilocerus akamusi)的毒性效应[D].武汉:华中农业大学,2012.
[11] ZHENG X Y,XIE Z Y,WANG S,et al.Determination of the protein expression profiles of Propsilocerus akamusi(Tokunaga) Malpighian tubules response to cadmium stress by iTRAQ coupled LC-MS/MS[J].Journal of proteomics,2017,164:85-93.
[12] 鄭先云,龙文敏,郭亚平,等.Cd2+对红裸须摇蚊Propsilocerus akamusi的急性毒性研究[J].农业环境科学学报,2008,27(1):86-91.
[13] CAO C W,LI X P,GE S L,et al.Enzymatic activities as potential stress biomarkers of two substituted benzene compounds in Propsilocerus akamusi (Diptera:Chironomidae)[J].Africa journal of aquatic socience,2012,37(3):265-270.
[14] 赵燕,汤保华,蔡磊明,等.杀菌剂戊唑醇对花翅摇蚊(Chironomus kiiensis)幼虫的急性毒性和抗氧化酶系统的影响[J].农药,2012,51(6):445-448.
[15] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.化学品 沉积物-水系统中摇蚊毒性试验 加标于沉积物法:GB/T 27859—2011[S].北京:中国标准出版社,2012.
[16] OECD.Guideline 235:Chirnomus sp.,Acute Immobilisation Test [S].Paris:OECD,2004
[17] 闫宾萍,宋志慧.Ni2+、Hg2+和五氯酚对羽摇蚊(Chironomus plumosus)幼虫的毒性和生物浓缩[J].青岛科技大学学报(自然科学版),2006,27(5):411-414.
[18] WENTSEL R,MCINTOSH A,ATCHISON G.Evidence of resistance to metals in larvae of the midge Chironomus tentans in a metal contaminated lake[J].Bulletin of environmental contamination and toxicology,1978,20(4):451-455.

