左室重建装置研发及临床应用进展
病理性左心室重构是机械因素、神经体液因素、基因等共同作用的结果,最终引起慢性心力衰竭(心衰)症状,影响患者远期的心功能及预后[1]。传统的药物治疗可减缓或逆转左心室重构的进程,但无法改善机械因素在左心室重构中的作用。
已证实左室收缩末期容积(LVESV)和左室舒张末期容积(LVEDV)是心衰预后的独立预测因子[2]。基于此,对急性心肌梗死(AMI)后左心室重构的患者,通过左室重建术重建心室几何结构,可能改善患者心功能及预后。
1 外科左室重建术的临床疗效及意义
1985年,Jatene等[3]先后提出外科心室重建术(SVR)的概念,强调通过手术重建左心室几何结构,使心肌肌束尽可能恢复至AMI前的方向和位置。1989年Dor等[4-5]采用心内补片旷置无运动但无法切除的梗死区域,并同期行冠状动脉旁路移植术(CABG)。
RESTORE研究入组了1 198例行SVR的室壁瘤患者,其30 d死亡率为5.3%,左室容积显著缩小,左室射血分数(LVEF)改善,5年随访生存率为(68.6±2.8)%[6]。然而,SVR具有较高的风险和创伤,其适应证及疗效存在争议。STICH研究入选了1 000例前壁AMI患者,比较CABG联合SVR与单纯CABG的治疗效果,结果显示联合治疗虽能降低心室容量,但死亡率、心血管住院率等指标与单纯CABG组相比无明显差异。术后4个月时亚组分析显示,将左室收缩末期容积指数(LVESVI)降至70 mL/m2以下,联合治疗组患者的生存率显著改善,SVR仍具临床治疗价值[7-8]。SVR一般与CABG等同期手术,因此,寻找创伤更小、治疗效果更佳的左室重建方法成为研究重点[9]。
2 左室重建装置研发及临床应用
2.1 微创杂交左室重建术
Coapsys装置被设计用于左室扩大合并功能性二尖瓣反流(FMR)的患者。该装置由置于心室前壁和后壁二尖瓣乳头肌附近心外膜的补片和连接线组成,通过收紧补片之间的连接线拉近乳头肌与二尖瓣距离,在减小LVEDV的同时可改善二尖瓣环几何结构(见图1)。RESTOR-MV随机对照研究拟入组250例将行CABG且伴有FMR的患者,随机分为CABG或CABG+二尖瓣修复术组和CABG+Coapsys植入组,用以判断该装置的疗效。虽然该研究由于资金不足提前结束,但是后期分析发现,即使在对照组患者FMR程度更轻的情况下,165例接受Coapsys 植入的患者2年随访生存率更高(87%对77%,P=0.038)[10]。改进后的iCoapsys可在左室造影指导下,通过体外穿刺达到左室重建的效果,已在山羊动物试验中取得成功[11],但后续未公布临床试验或设备研发计划。
2.2 微创左室减容术
微创心室减容术是通过美国BioVentrix公司的Revivent心肌锚定系统实现,该装置由2颗锚定装置和1根连接线组成。术中经心尖切口穿刺至右心室,将2颗锚定装置先后置于室间隔右室侧和左室侧壁心外膜侧,然后收紧连接线将左室游离壁与室间隔锚定,隔离无法切除的前间壁瘢痕和室壁瘤腔,降低心室容积。包括11例患者的首次临床试验结果显示,患者1年随访时LVESV[(72.6±26.9) mL/m2对(43.9±22) mL/m2,P<0.000 1]及LVEDV[(102.5±27.3) mL/m2对(69.5±27.2) mL/m2,P<0.000 2]较基线均显著下降[12]。
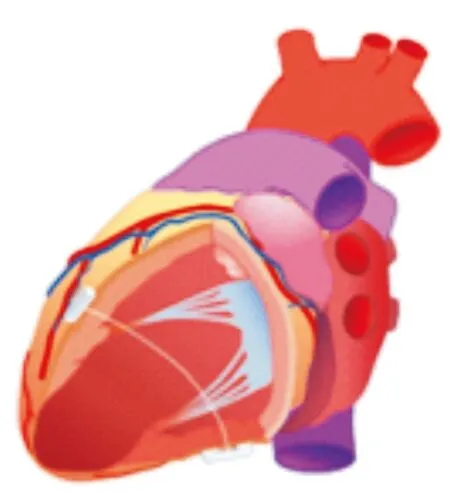
图1 Coapsys装置示意图
经改进的装置称Revivent-TC,由心内科介入医生和心外科医生共同完成装置植入,首先经颈静脉将抓捕器送入右心室,再通过胸前小切口穿刺室壁瘤左室游离壁和室间隔至右心室并送入导丝,用右心室的抓捕器进行抓捕,建立颈内静脉-上腔静脉-右心房-三尖瓣-右心室-室间隔-左心室-左室游离壁轨道。沿此轨道送入锚定装置,继而收紧分别位于右心室和左室游离壁的上述锚定装置,完成室壁瘤隔离。多数患者仅需要2~4个锚定装置即可完成左室重建(见图2)。这一杂交手术方式与传统的心外科手术相比,无需心脏停跳和体外循环支持,无需大切口开胸和心室切开,显著减小手术创伤。
一项纳入51例接受Revivent患者和20例接受Revivent-TC患者的研究显示,术后30 d内死亡率为5.6%,经过1年随访,患者LVESVI和LVEDVI分别由基线时的70.9 mL/m2和102.3 mL/m2下降至49.7 mL/m2和74.2 mL/m2(P均<0.001),LVEF、6 min步行试验(6MWT)及纽约心脏病协会(NYHA)心功能分级均显著改善[13]。Revivent-TC是左室重建治疗中的重要里程碑,它完成了从传统外科向微创介入治疗的转化,已获准在欧洲上市。一项前瞻性、多中心、单臂研究入选了89例AMI后左室扩张的心衰患者,其中86例患者完成Revivent-TC治疗;院内死亡4例,其中3例为手术相关,总体1年生存率为90.6%,术后1年随访,患者LVEF较术前改善[(29.8±8)%对(34±9)%,P均<0.005)],LVESVI、LVEDVI均显著下降;患者心功能分级、明尼苏达生活质量评分以及6MWT均显著改善[14]。该研究的局限性在于未设置对照组,为进一步验证该装置的有效性,一项用于比较在标准药物治疗基础上加用Revivent-TC是否对治疗效果有影响的随机对照研究正在进行中。
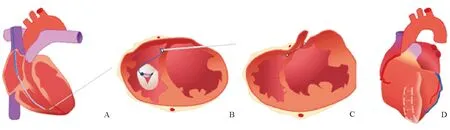
A示沿颈静脉-上腔静脉将抓捕器送入右心室,经心尖小切口穿刺至右心室送入导丝,右心室内抓捕器抓捕导丝,建立右心室-室间隔-左心室-左室游离壁轨道;B示沿建立的轨道将第一个锚定装置送至室间隔右心室侧;C示第二个锚定装置经心尖切口送至左室游离壁心外膜侧,收紧2个锚定装置间连接线;D示2~4个装置即可完成室壁瘤隔离
图2 Revivent-TC装置治疗示意图
2.3 经皮左室重建术
经皮左室重建术采用的左室隔离装置由镍钛金属骨架、聚四氟乙烯膜以及底座构成,形状类似降落伞。通过输送系统将折叠的左室隔离装置送入左室心尖部,并用球囊扩张器扩张,使其支撑于心室壁,伞面将心室隔离为功能活动区域与无功能静止心腔,消除室壁瘤区域的逆向运动,提高心室机械效率,降低心室容积,减小室壁应力(见图3)。

A示通过输送系统将左室隔离装置送入左心室,借由底座完成装置定位;B示通过输送系统自带球囊撑开左室隔离装置,支架顶端的倒刺将装置固定于室壁,完成室壁瘤隔离;C示左室隔离装置成功隔离室壁瘤
图3 左室隔离装置示意图
Cardiokinetix公司研发的左室隔离装置PARACHUT首次人体试验于2005年在美国和欧洲同时开展。该研究共入选39例室壁瘤患者,随访1年的结果显示患者LVEDVI及LVESVI较基线显著下降,随访3年时患者LVEDVI较基线显著下降,但LVESVI与基线无统计学差异,且患者LVEF较基线有所下降[15-16]。
PARACHUTE CHINA研究于2014年9月在我国开展。该研究共招募31例室壁瘤患者,其中30例患者成功植入装置,1例术后1个月时因出血性卒中死亡,死亡原因与抗凝治疗相关。3个月随访结果显示,患者LVESVI[(77.5±20.0)mL/m2对(53.1±17.0)mL/m2,P<0.001]和LVEDVI(110.8±26.1)mL/m2对(82.1±21.3)mL/m2,P<0.001]显著下降,LVEF及NYHA心功能分级均有所改善[17]。左室隔离装置植入围术期抗凝方案目前尚未统一,一般采用术后1年口服阿司匹林100 mg/d和华法林(维持国际标准化比值2.0~3.0),PARACHUTE首次人体试验3年的缺血性和出血性卒中事件发生率为15.9%(2例缺血性卒中、2例出血性卒中),PARACHUTE CHINA随访3个月有1例出血性卒中,无缺血性卒中。
在欧洲开展的PARACHUTE Ⅲ研究为一项前瞻性、非随机对照研究,共纳入100例患者,12个月的随访结果显示,患者LVESVI[(84.0±24.2)mL/m2对(70.5±24.5)mL/m2,P<0.0001]和LVEDVI(117.3±26.3)mL/m2对(99.1±27.3)mL/m2,P<0.000 1]均显著下降,心源性死亡率为8.4%,心衰再住院率为24.1%。需要注意的是,即使术后服用低剂量阿司匹林联合华法林治疗不少于12个月,仍有3.3%的患者经超声心动图发现器械表面血栓形成[18]。
PARACHUTE Ⅳ级为首个随机对照试验,计划纳入478例NYHA心功能Ⅲ~Ⅳ级、LVEF 15%~35%、左室活动异常的患者,随机分为药物治疗组及左室隔离装置植入组,主要终点为死亡或心功能恶化导致的住院。遗憾的是该研究在入组了331例患者后,因围手术期血栓事件及公司运营原因于2017年6月终止,同期在欧洲开展的PARACHUTE Ⅴ上市后研究也已终止,不知相关研究将来能否继续。
一项PARACHUTE植入后CT影像研究发现,舒张早期血流速度与舒张早期二尖瓣间隔组织速度比值显著降低,而这一改变与患者临床表现改善相关[19]。另一项研究发现PARACHUTE通过缩短乳头肌间距离,改善了二尖瓣几何形态[20]。一项病理学研究观察了3例因接受心脏移植而取出PARACHUTE以及4例与器械植入无关的死亡患者的PARACHUTE装置,发现装置膜的两面均有生长良好的心内膜组织,但植入时间超过2年的装置表面心内膜出现钙化,这种钙化理论上可能导致远期的器械衰败或装置膜的破裂[21]。
我国经皮左室重建术尚处于起步阶段,由心瑞医疗科技有限公司研发的Heartech左室隔离装置于2016年在上海交通大学医学院附属瑞金医院完成首例植入。该装置首次人体研究共入选16例患者,其中15例成功植入,1例由于左室结构原因未能植入。30 d随访结果显示,患者LVESVI[(72.47±22.77)mL/m2对(50.13±13.36)mL/m2,P<0.001)]及LVEDVI[(106.27±28.01)mL/m2对(83.20±16.87)mL/m2,P=0.001]均显著下降,此外LVEF、6MWT、欧洲五维健康量表评分均较基线改善[22]。Heartech左室隔离装置Ⅱ期临床试验正在开展。
2.4 生物材料注射
上述器械主要针对AMI后已经发生心室几何结构变化的患者,而生物材料注射主要用于发生左心室重构的早期。研究者将羟磷灰石微球注射入31只AMI绵羊模型的心肌中,结果显示,该方法能抑制AMI后的左心室扩张,改善LVEF。注射羟磷灰石微球的AMI绵羊模型中心肌胶原含量较未干预的AMI绵羊模型更少,纤维化程度更低[23]。该材料尚未被用于人体。
心肌基质水凝胶由猪的心肌组织通过脱细胞加工而成。在大鼠和猪的动物实验中,注射基质水凝胶可增加梗死区的存活心肌细胞、维持心脏功能[23-24]。目前Ⅰ期临床试验正在招募AMI后患者,以研究基质水凝胶的安全性。新材料如人羊膜基质水凝胶也在动物实验中证实可改善AMI后左室功能及梗死面积[25]。
通过冠状动脉注射生物材料被证实同样可行。一项研究纳入27例AMI患者,在AMI发生7 d后,通过冠状动脉注射2 mL 1%海藻酸钠+0.3%葡萄糖酸钙,患者耐受良好。该研究基于假设:生物材料注射后可渗透梗死组织,形成生物可吸收心脏基质[26]。PRESERVATION Ⅰ研究是一项随机对照研究,纳入303例AMI后2~5 d患者,并以2∶1分为研究组和对照组,研究组经梗死相关冠状动脉注射生物可吸收心脏基质,对照组使用生理盐水作为安慰剂。该研究最终虽然未能证明两组患者在6个月随访时LVEDVI或不良事件发生率有显著差异,但改变注射剂量或注射时机能否产生更佳效果,值得进一步研究[27]。
LoneStar Heart公司研制的Algisyl-LVR是一种含海藻酸钠和海藻酸钙的凝胶混合液,手术时将两者混匀,按1 cm针距环左心室注入心肌内。左心室厚度增加可使室壁应力下降,左心室容积降低,从而延缓心衰进程。AUGMENT-HF研究是一项多中心前瞻性随机对照试验,评价海藻凝胶酸盐左室重建术的有效性与安全性。研究共纳入78例心衰患者,45例研究组中有40例成功注射Algisyl-LVR,对照组仅接受标准药物治疗,研究组术后30 d有3例死亡(8.57%),术后6个月随访结果显示患者心肌峰值摄氧量、6MWT及NYHA心功能分级均较对照组明显改善。1年随访结果显示研究组上述指标继续改善,但研究组死亡率高于对照组(22.5%对10.5%)。AUGMENT-HF研究未设盲、样本量较小,因此需要更大规模的双盲试验提供证据[28]。
3 展望
外科左室重建术和经皮左室重建术均改善了患者的生活质量和心脏功能状态,但尚无明确证据表明能使患者远期生存获益。外科左室重建术的临床研究设计对象局限于计划行CABG、二尖瓣置换术等手术治疗的患者。而创伤小、操作便捷的经皮左室重建术的出现使相关临床研究的设计突破了这一局限,后期开展的更大规模的研究将论证此类器械的安全性和有效性。相较于依赖杂交手术的锚定系统,左室隔离装置的优势在于可完全经导管完成放置。对于围绕器械相关的诸如手术适应征、术前影像分析、介入时机、器械植入后抗凝方案等问题亟需相关临床研究来解答。

