热休克蛋白70在家族性腺瘤性息肉病中的表达及意义
沈晓东 张 天 宋 文
FAP是一种常染色体显性遗传病,中国人发生率约是1/10000,受累个体在青春期长出成千上万的大肠息肉,未经治疗则100%癌变,患者将无一例外死于大肠癌[1]。FAP的治疗主要是全结肠切除或全结肠及直肠切除,但手术后并发症较多,患者生活质量差,并且术后仍可能复发转移或其他部位形成恶性肿瘤等风险,需要接受非手术治疗,故FAP免疫治疗等非手术治疗方面的研究非常必要[2]。目前研究表明,FAP发病与抑癌基因APC突变有关[3],大多数APC基因突变使APC蛋白呈“截短”改变,导致其结合β-catenin 的区域异常,引起β-catenin降解障碍,细胞质内β-catenin大量集聚,进入细胞核后与TCF因子结合并激活转录,诱发肠道息肉形成及癌变。Apc基因敲除小鼠ApcΔ716/+是国际公认的研究人FAP的小鼠模型,具有高度遗传稳定性,广泛应用于人FAP方面的的研究[4~6]。
热休克蛋白(heat shock protein, HSP)是细胞受到高热等有害因素刺激时大量表达的一类特殊应激蛋白,其主要作用是通过与细胞内变性蛋白质结合而维持其正常的构象及功能[7]。根据同源程度及分子量大小将HSP家族成员分为HSP90、HSP70、HSP60及小分子HSP等10余种,其中HSP70最受研究者们关注,它在正常细胞中表达水平较低,但细胞受到应激时合成量最多、表达水平最高,特别是恶性肿瘤的缺氧、酸中毒和营养缺乏等不良环境,可诱导肿瘤细胞大量表达HSP70[8];HSP70作为“分子伴侣”c-Myc等基因突变后的产物相互作用,稳定肿瘤细胞异常增殖[9];肿瘤来源的HSP70 具有强大的免疫原性和肿瘤特异性, 因而HSP70可能在FAP息肉发生、恶变及免疫反应中发挥重要作用[10]。
近年来研究表明HSP70在许多肿瘤中大量表达,并且在肿瘤免疫治疗中发挥重要作用,但在FAP肠道息肉发生、发展中的表达情况及作用目前国内外尚未见报道[11]。本研究采用ApcΔ716/+小鼠作为FAP模型鼠,研究不同周龄的小鼠肠道息肉HSP70表达的变化,从而明确HSP70在FAP发生、发展中的作用,为HSP70应用于FAP的抑制息肉癌变、延缓病情发展及免疫治疗提供依据。
材料与方法
1.材料:鼠抗人HSP70单克隆抗体(ab2787)及辣根过氧化物酶标记的兔抗鼠多克隆抗体 (ab6728)由英国艾博抗公司提供,增强化学发光试剂盒由英国阿默舍姆制药生物技术公司提供,Trizol试剂盒由美国英杰生命技术公司提供,标第1链合成系统Ⅱ由美国赛默飞生命科学公司提供。SYBR Green PCR 预混液及ABI PRISM®7000 序列检测系统由美国PE应用生物系统公司提供。其他试剂及仪器均为实验研究使用。
2.实验动物:ApcΔ716/+(C57BL/6)小鼠由Oshima教授提供,SPF环境中饲养,ApcΔ716/+雄性小鼠与野生型雌性小鼠进行交配,通过基因鉴定选出ApcΔ716/+小鼠作为本研究使用[5,6]。
3.ApcΔ716/+小鼠肠道息肉数目、大小及良恶性判定:分别于1~16周选取各周龄ApcΔ716/+小鼠,每周6只共96只,不分性别,颈椎脱臼法处死小鼠,分离出肠道,剪开肠道,甲醛溶液固定。体视显微镜×20视野,观测并记录每个息肉;观测完成后将肠组织卷起,常规石蜡包埋及切片;通过HE染色判断息肉良恶性,并与小鼠周龄及息肉的大小对照。通过体视显微镜观察及HE染色等方法确定息肉开始出现的周龄为4周,绝大部分直径为0.5~1.0mm,全部为良性腺瘤性息肉;息肉开始癌变的周龄为8周,癌变的息肉直径多>3.0mm,尤其是≥4.0mm者均发生癌变。
4.ApcΔ716/+小鼠肠息肉HSP70免疫组织化学染色:选取4周、8周、12周ApcΔ716/+小鼠,每组6只,分离整个肠道并依次固定及石蜡包埋;5μm切片,水化,通过HE染色选取癌变的息肉;3%双氧水过氧化物酶阻断,微波抗原修复,山羊血清封闭,滴加HSP70一抗, 4℃密封过夜,滴加相应二抗, 37℃温育30min,各步骤间PBS振洗, DAB显色、复染、脱水、透明及封片。免疫组化染色阳性判定标准:棕黄色颗粒沉积的部位为染色阳性,肿瘤细胞主要是细胞核着色,部分肿瘤细胞细胞质轻微着色,少部分正常上皮细胞细胞质和细胞膜轻微着色。HSP70的相对表达量由染色细胞比率及着色强度的乘积来判定,每个切片在×400视野下在典型部位随机选取10个视野,各视野共检测100个细胞[12]。染色细胞阳性比例判断标准:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;染色强度的判断标准:细胞内无染色为0分,淡黄色为1分,棕色为2分,棕褐色为3分。由两名病理科医生双盲下独立评分。
5.Western blot法检测ApcΔ716/+小鼠肠道息肉中HSP70的表达:采取4周正常肠黏膜、0.5mm刚形成的肠道良性息肉及8周小鼠肠道4.0mm以上最大的息肉、12周小鼠5.0mm癌变息肉(8周及12周标本留取小部分组织通过HE染色证实已经癌变)的细胞提取液进行10% SDS-PAGE凝胶电泳及半干式转膜,一抗选用鼠抗人HSP70单克隆抗体,二抗选用辣根过氧化物酶标记的兔抗鼠多克隆抗,增强化学发光试剂盒显像。
6.RT-PCR法检测ApcΔ716/+小鼠息肉HSP70的 mRNA的表达:选取4周、8周、12周ApcΔ716/+小鼠各6只,处死小鼠,无RNA酶状态下分离肠道,切取4周0.5mm左右息肉、8周4.0mm以上最大的息肉、12周5.0mm息肉(8周及12周标本留取小部分组织通过HE染色证实已经癌变)及4周正常肠黏膜,Trizol 试剂盒提取息肉及肠黏膜的总RNA,操作方法依照Trizol 试剂盒的使用说明书;应用标第1链合成系统Ⅱ试剂盒合成相应cDNA, HSP70引物序列:上游引物:5′-GAAGGTGCTGGACAAGTGC-3′,下游引物:5′-GCCAGCAGAGGCCTCTAATC-3′[13]。PCR扩增应用SYBR Green PCR预混液,ABI PRISM®7000 序列检测系统检测结果,内参选用β-actin。
7.统计学方法:应用SPSS 19.0统计学软件对数据进行统计分析,计量资料采用方差分析检验,组间比较采用SNK法,以P<0.05为差异有统计学意义。
结 果
1.ApcΔ716/+小鼠肠道息肉发生及发展情况:通过对1~16周龄共96只小鼠肠道息肉的体视显微镜观察及HE染色发现,小鼠肠道1~3周基本无肠道息肉,于4周左右肠道开始出现息肉,详见表1,息肉均为刚形成的良性腺瘤性息肉,体积较小约0.5~1.0mm,详见图1;5~7周小鼠肠道息肉大量形成、快速增大,但均为良性腺瘤性息肉;8周龄小鼠肠道息肉大量形成,部分较大(>3.0mm)的息肉开始出现癌变,发展成肠腺癌,直径>4.0mm的息肉绝大部分癌变; 9~11周小鼠肠道息肉形成速度明显减慢,但息肉体积进行性增大,呈现浸润性生长;12周龄肠道息肉数目进一步增加,体积也进一步增大,癌变的息肉也大幅度增加,部分小鼠出现肠梗阻、腹腔积液、恶病质等并发症,小鼠开始出现死亡;13~15周小鼠肠道仍有少许新发肠道息肉,体积进行性增大,最大者超过10mm,小鼠大量死亡;16周内绝大部分小鼠死亡,平均生存期限14.12±6.70周,死亡时小鼠肠道息肉总数为90.6±13.8。因ApcΔ716/+小鼠4周左右开始出现息肉,8周左右较大的息肉开始出现癌变,12周左右小鼠开始出现死亡,故选取4、8和12周小鼠检测HSP70的表达情况。正常小鼠肠道作为对照,在正常小鼠肠道内未见息肉。

表1 ApcΔ716/+小鼠肠道息肉总数恶变息肉数及HSP70相对表达量
与4周比较,*P=0.000;与8周比较,#P>0.05,ΔP=0.000

图1 4周、8周及12周ApcΔ716/+小鼠肠息肉及正常小鼠肠道的体视显微镜观察A.正常;B.4周;C.8周;D.12周;标尺:2mm
2.ApcΔ716/+小鼠肠道息肉的HSP70免疫组织化学染色:不同周龄ApcΔ716/+小鼠肠道息肉HSP70的相对表达量明显不同(F=167.423,P=0.000),详见图2。HSP70在4周时肠息肉内相对表达量很低(1.60±0.37),仅见少数HSP70阳性细胞,着色强度也很弱;8周时部分息肉开始出现癌变,HSP70相对表达量明显升高(6.37±0.56),与4周时比较差异有统计学意义(P=0.000);12周时癌变的息肉快速增多,并呈浸润性生长,HSP70相对表达量升高(7.02±0.70),与4周时比较差异有统计学意义(P=0.000),但与8周时比较略有升高。正常小鼠肠道HSP70免疫组织化学染色作为对照,在正常小鼠肠道中未见明显HSP70染色阳性细胞。
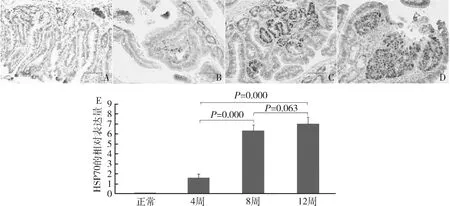
图2 ApcΔ716/+小鼠肠道腺瘤性息肉及正常小鼠肠道的HSP70免疫组织化学染色A.正常;B.4周;C.8周;D.12周;标尺为50μm
3.ApcΔ716/+小鼠肠道息肉的HSP70蛋白表达:正常肠黏膜HSP70表达量极低,条带仅隐约可见;4周时息肉开始出现,HSP70表达量略升高,但蛋白条带仍然较弱;而8周及12周肠道息肉的HSP70蛋白条带明显增强,与正常肠黏膜及4周时肠息肉比较明显不同,详见图3。
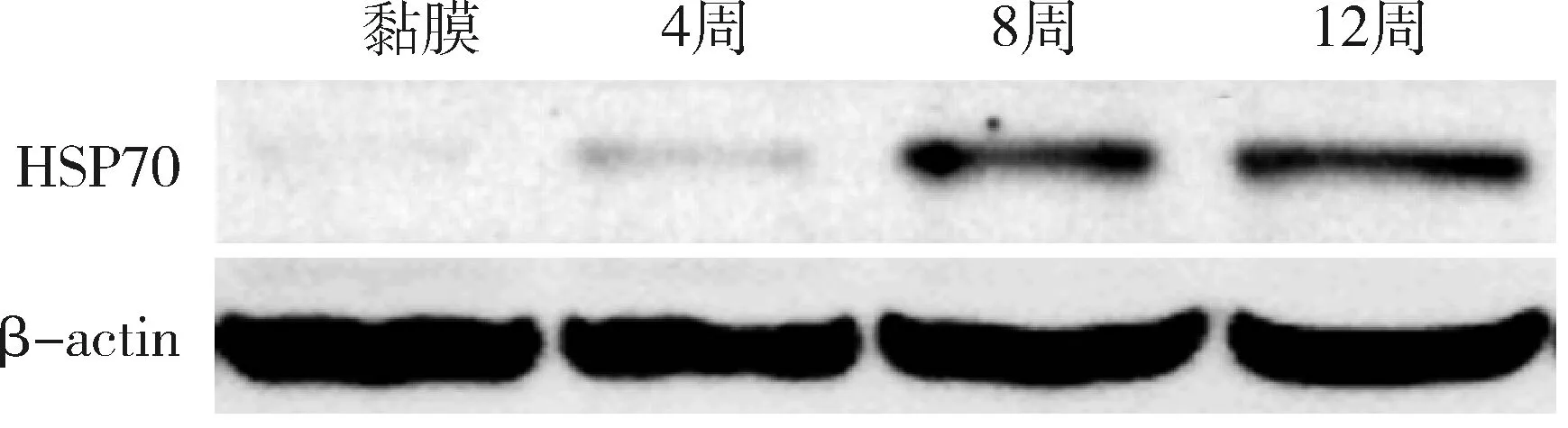
图3 HSP70在不同周龄ApcΔ716/+小鼠肠道息肉及正常肠黏膜(M)中的表达
4.ApcΔ716/+小鼠肠道息肉的HSP70 RT-PCR结果:不同周龄小鼠肠道息肉HSP70的mRNA相对值也明显不同(F=62.661,P=0.000),详见图4。正常肠黏膜HSP70的mRNA表达量极低,为0.06±0.03,4周肠息肉开始出现时HSP70的mRNA表达量略有升高,为0.17±0.09,与正常黏膜比较差异无统计学意义;8周肠道癌变息肉HSP70的mRNA表达量明显升高(0.69±0.14),与4周时肠息肉比较差异有统计学意义;12周时肠息肉内HSP70的mRNA表达量为0.82±0.16,较4周息肉明显升高,但较8周息肉仅略有升高,差异无统计学意义(P<0.05)。
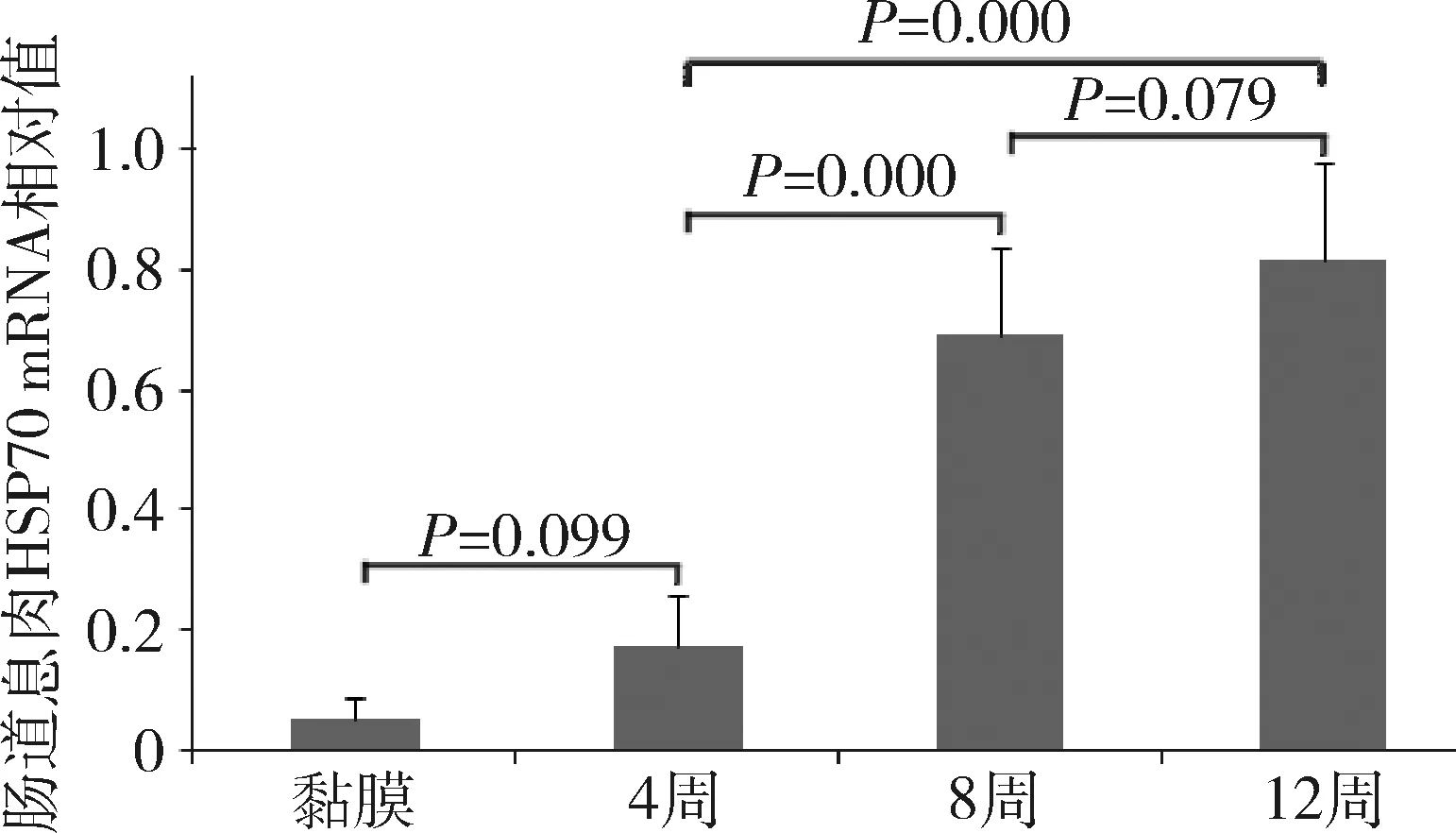
图4 ApcΔ716/+小鼠肠道息肉HSP70的mRNA相对值
讨 论
FAP患者息肉终生癌变率几乎是100%,但如果及时发现、及时治疗可以预防息肉癌变,故预防FAP患者息肉癌变非常重要[14]。目前研究表明HSP70在许多恶性肿瘤发生、发展及治疗中发挥重要的作用,而且HSP70对恶性肿瘤的免疫治疗已进入临床试验阶段[6~9,15]; HSP70与恶性肿瘤放、化疗敏感度低下有关[16]。上述一系列研究说明,HSP70参与恶性肿瘤的发生、发展、诊断、治疗、耐药及预后等一系列临床过程,适合作为FAP息肉癌变、发展恶化及免疫治疗等方面的靶点而深入研究。
本研究显示,在4周左右ApcΔ716/+小鼠开始出现肠道息肉,息肉开始形成时均为良性腺瘤性息肉,通过免疫组织化学染色、蛋白质免疫印迹分析及RT-PCR等实验方法证明,4周时0.5mm左右刚形成的息肉HSP70表达较正常肠黏膜略有升高,但表达仍较低,差异无统计学意义,说明HSP70在FAP息肉形成过程中作用不明显。8周时小鼠肠道息肉开始出现癌变,息肉癌变组织中HSP70表达显著升高,说明HSP70在息肉癌变中发挥重要的作用。12周时ApcΔ716/+小鼠很多息肉已经癌变,发展成肠腺癌,并呈浸润性生长,其HSP70表达较4周息肉显著升高,较8周息肉开始癌变时略有升高,提示HSP70在结直肠癌发展中也发挥重要作用。以上结果表明,HSP70在息肉开始癌变时及癌变后持续升高,直至小鼠死亡,说明HSP70在息肉癌变及肠癌形成后的生长、浸润及转移等发展过程中有重要作用。由于FAP具备典型的息肉-腺瘤-癌变过程,是大肠癌发病机制研究的最佳样本,所以通过上述结果,可推测HSP70在结直肠癌形成及发展过程中也具有重要作用。
HSP70参与FAP息肉癌变及肠癌发展的机制尚不清楚,目前研究表明,WNT信号通路中β-catenin 等活性升高是FAP息肉癌变的重要特征,HSP70通过活化WNT信号通路,提高β-catenin等蛋白数量及稳定性,引起β-catenin转录活性增高,促进肿瘤细胞的生长及增殖[17,18];HSP70在肿瘤细胞中能通过分子伴侣作用减轻蛋白毒性应激反应,使肿瘤细胞在营养缺乏、蛋白毒性应激、缺氧等不良生存环境中存活[19];HSP70使肿瘤细胞抵抗正常细胞凋亡信号[20]。综合上述研究可推测HSP70可能通过使WNT信号通路中β-catenin等蛋白数量及活性升高、减轻蛋白毒性应激反应及抑制肿瘤细胞凋亡等作用机制,促进FAP息肉癌变及肠癌进展,需要进一步研究明确HSP70 促进FAP肠息肉癌变中的具体作用机制。
综上所述,本研究中4周息肉开始出现时HSP70表达略有升高,在8周息肉开始癌变及12周肠癌生长浸润时HSP70表达持续性显著升高,提示HSP70在息肉的形成过程中作用不明显,但在肠息肉癌变及肠癌浸润生长发挥重要的作用。本研究探索了HSP70在FAP肠道息肉中表达的变化情况及其意义,为FAP患者预防息肉癌变及结直肠癌免疫治疗提供新策略。

