碳酸钠与碳酸氢钠鉴别方案的设计与评价
朱怀义
(江苏省睢宁县第一中学 221200)
实验是化学的学科特征.实验对化学学习而言,如羽翼于飞鸟,划桨于轻舟.课堂若以不同实验的展开为载体,肯定可以浓厚学生学习的兴趣、深化学生对知识的理解,激发富有创意的能力生长.下面围绕“碳酸钠与碳酸氢钠”鉴别方案的设计为例,浅谈实验如何促进知识向能力转化.
方案1利用二者水溶性的差异来设计.课本对二者性质的比较的文字表述为“二者均为易溶物质.在相同温度下,碳酸钠的溶解度大于碳酸氢钠”.由于缺少相应的数字辅佐,二者水溶性的差异究竟有多大?学生建立不起感性的认知,能力的生长自然也失去了相应的土壤.
通过简单的文献资料,可查知在常温下,碳酸钠在水中溶解度为21.5 g,碳酸氢钠为9.6 g.所以,教师可加以引导,若各取2.5 g粉末,加水使之刚好溶解,分别需要12 mL和26 mL的水,形成的饱和溶液的体积明显不同.再者,将二者水溶性的差异数字化,对理解侯氏制碱原理、分析向饱和碳酸钠溶液中持续通入过量二氧化碳气体有不溶物质析出也是十分必要的.
方案2利用二者溶液酸碱性的差异来设计.教材对此表述为“二者溶液均显碱性.在物质的量浓度相同时,碳酸钠溶液的pH比碳酸氢钠溶液的大”.同样,由于没有将差异量化表述,也错失了引导学生追求精细的训练机会.
可以粗略配制物质的量浓度均为0.1 mol·L-1的溶液,然后用pH计测定二者溶液的pH,分别为10.3、8.4.通过实验,巩固了溶液配制的技能、了解pH计的使用,这都是培养学生操作能力非常良好的实验契机.进而向溶液中各滴加两滴无色酚酞试液,二者溶液的显色也有明显区别,而这既是培养学生注重精细的好素材,也为以后理解酸碱滴定历程变化预设伏笔.
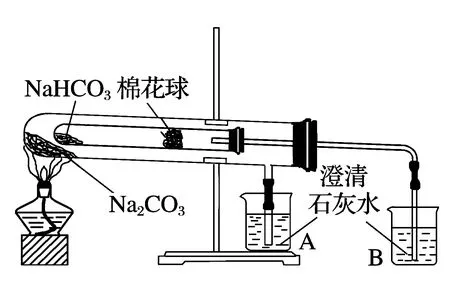
方案3利用二者热稳定性的差异来设计.碳酸氢钠受热分解,释放可以使澄清石灰水变浑浊的CO2气体.经查,碳酸氢钠受热在50℃开始分解,在270℃分解完全.此方案为学生容易接受,但对此方案原理的考查,大多落在对“功能性实验装置(如图)”能否证明实验结论,从而考查学生思维的严谨性.若图中,碳酸钠与碳酸氢钠位置颠倒,则注明不了碳酸氢钠的热不稳定性.这也启迪学生,要注明自己优秀,就不能让自己占有较为有利的客观条件.
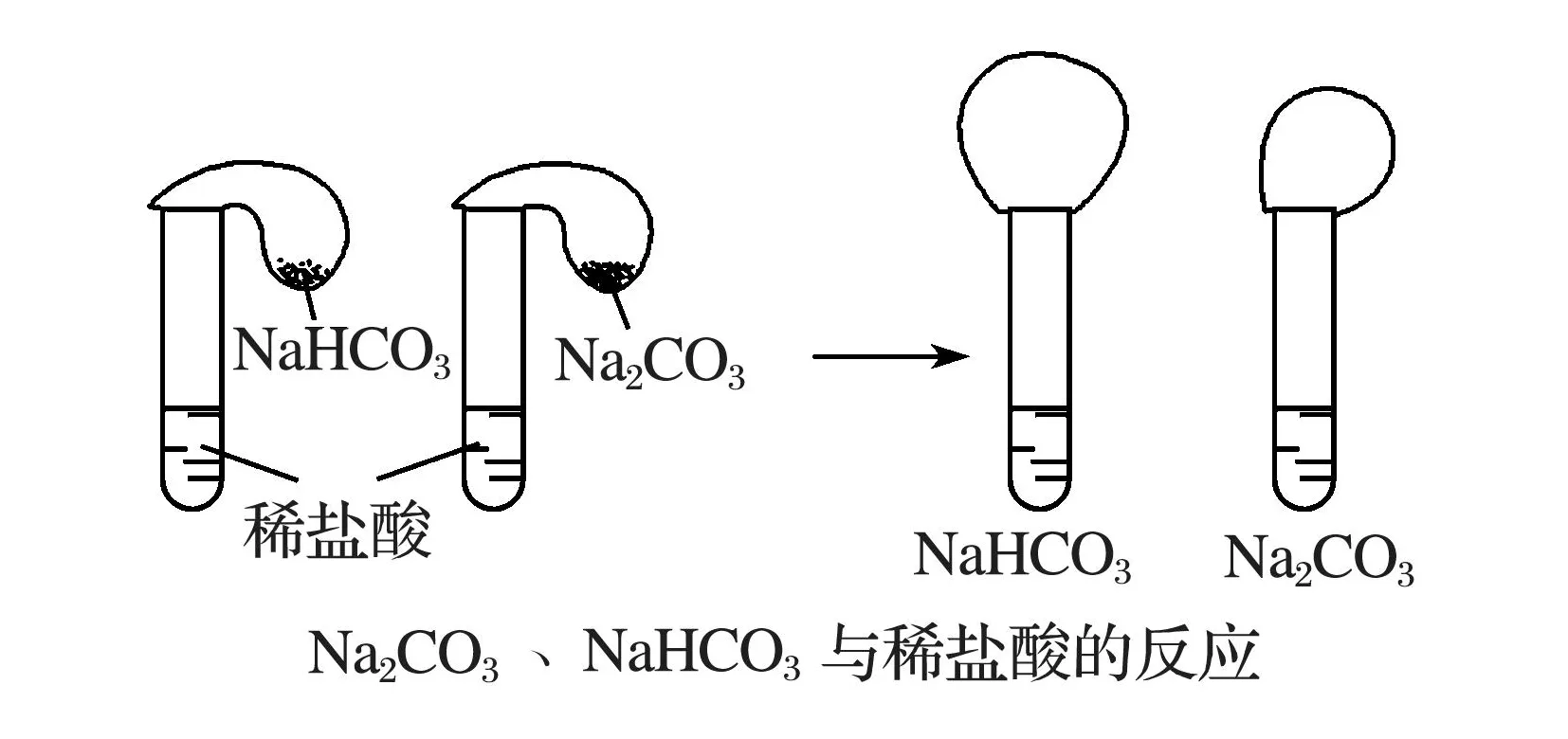
方案4利用二者与酸反应剧烈程度的差异来设计.影响反应剧烈程度的因素较多,如反应物粉末颗粒大小、使用酸的温度和物质的量浓度大小等;在高一开始学习时,也不便揭示碳酸钠与酸反应的历程.因此,鉴别方案最好表述为“等质量的固体与足量酸反应,产生气体体积大小”;经简单推算,可知等质量的碳酸钠和碳酸氢钠与足量酸反应时,产生气体体积体积比约为4∶5.
方案5利用二者与氯化钙溶液混合的现象差异来设计.在两支洁净的试管中分别取相同体积的碳酸铵溶液和碳酸氢钠溶液,再分别向其中滴加氯化钙溶液,振荡.可观察到碳酸钠溶液与氯化钙溶液混合后有浑浊现象出现,而盛有碳酸氢钠溶液的试管内仍保持澄清.

课本习题传递的信息,也可为设计和评价鉴别方案提供支持.苏教2018版《化学1》第62页第7题:(1)碳酸氢钠是一种酸式盐,既可以与酸反应,又可以与碱反应.请写出碳酸氢钠溶液分别与盐酸和氢氧化钠溶液反应的离子方程式.(提示:碳酸氢钠溶液与氢氧化钠溶液反应生成碳酸钠和水)(2)少量碳酸钠与足量盐酸反应,有二氧化碳气体放出;而少量盐酸与过量碳酸钠反应,则生成碳酸氢钠和氯化钠,无气体放出.请写出上述反应过程中发生的离子方程式.
根据7(1)信息,可判断想当然认为二者与氢氧化钙溶液混合的现象差异来鉴别的方案是错误的.碳酸氢钠溶液与氢氧化钙溶液混合,无论比例如何,也都会出现浑浊现象.反应的化学方程式如下:


方案7利用将酸慢慢滴向二者溶液中产生的现象不同来鉴别.在化学实验操作中,物质的量的多少可通过不同溶液简相互滴加的方向不同来保证,所以,只要将少量盐酸分别滴向二者溶液,碳酸钠溶液中没有气体放出,而碳酸氢钠溶液中有气体放出.发生反应的化学方程式如下:


碳酸钠和碳酸氢钠性质相似中有差异.对待这些差异,如果通过实验视角,使学生在做中看到、体会出来,那才是对知识的深化思考,最终必然促使知识和能力齐头并进.

