中华蜜蜂磷酸丙糖异构酶基因克隆及生物信息学分析
樊兆斌 , 张淑萍 , 葛中东 , 周宛蓉 , 张 凯 , 夏宇欣 , 姜莉莉 , 蒋培红
(1. 菏泽学院药学院 , 山东 菏泽 274015 ; 2. 菏泽市食品药品检验检测研究院 , 山东 菏泽 274000)
(磷酸丙糖异构酶(Triosephosphate isomerase,Tpi)作为一种代谢酶,参与机体细胞质内的葡萄糖分解代谢,可催化磷酸二羟丙酮(DHAP)与3-磷酸甘油醛(GAP)之间的转化[1],在糖酵解、脂肪酸合成等途径中发挥着重要作用[2-3]。目前已从人、兔、鼠、绵羊、牛、果蝇、蚊、黄粉虫等多种生物中克隆了该酶的基因。高等动物体内Tpi的变异或缺乏会引起身体多种系统疾病,甚至导致死亡[4-5]。蜜蜂作为重要的农业经济昆虫,在地球生态系统中占据重要地位,并发挥重要作用。本文旨在对中华蜜蜂幼虫Tpi基因进行克隆、测序及序列分析,并利用生物信息学软件对该基因编码蛋白进行生物学信息学分析,以期为Tpi的功能研究提供有价值的参考资料。
1 材料与方法
1.1 主要试剂 动物组织总RNA提取试剂盒、FastQuant cDNA第一链合成试剂盒、2×TaqPCR Master Mix、D 2 000 Marker、质粒小提试剂盒、pGM-T载体、T4 DNA 连接酶等,均购自天根生化科技(北京)有限公司;限制性内切酶BamH I与XhoⅠ,购自Thermo Fisher公司。
1.2 主要仪器 PCR仪(ABI美国),离心机(湖南湘仪公司)。
1.3 试验动物 5~7日龄中华蜜蜂幼虫由本实验中心提供。
1.4 试验方法
1.4.1 引物设计 根据GenBank中已发表的意蜂Tpi基因序列(XM_017060592.2)设计中华蜜蜂Tpi(AcTpi)基因扩增引物F/R,F:5′-ATCGGATCCGCCATGGGTCGTAAATT-3′(BamH I位点),R:5′-AGTCTCGAGTCACTGCTTAGCGTTAAC-3′(XhoⅠ位点),引物由华大基因有限公司合成。
1.4.2AcTpi基因PCR扩增 按照试剂盒说明书进行蜜蜂幼虫总RNA提取和cDNA合成。以提取的cDNA为模板,用引物F/R进行目的基因扩增。PCR反应体系50 μL:2×TaqPCR Master Mix 25 μL,cDNA 模板 1 μL,上下游引物(10 pmol/L)各 1 μL,ddH2O 22 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性 30 s,50 ℃退火 30 s,72 ℃延伸 1 min,共35个循环;72 ℃延伸 7 min。PCR产物经1.0%琼脂糖凝胶电泳检测。
1.4.3 PCR产物连接、转化及测序 经胶回收试剂盒回收PCR产物,16 ℃条件下过夜连接pGM-T载体,产物转化大肠杆菌(DH5α)感受态细胞,涂布LB(A+)平板,37 ℃过夜培养,挑取单个圆滑白色菌落摇菌并提取质粒。经PCR筛选阳性重组质粒,选取3个阳性克隆送华大基因有限公司测序。
1.4.4 序列分析 使用DNASTAR软件将扩增的AcTpi基因序列与GenBank上已发表的中华蜜蜂(KP994676.1)、意大利蜜蜂(EU760983.1)、大蜜蜂(XM_006622725.2)、小蜜蜂(XM_003691109.2)、欧洲熊蜂(XM_012314761.2)、东方熊蜂(XM_012389323.2)、红斑石蜂(XM_029195143.1)、苜蓿切叶蜂(XM_003700486.2)、东南蓝莓蜜蜂(XM_017942917.1)、集蜂(XM_015574859.1)、麦茎蜂(XM_015745758.2)以及短管赤眼蜂(XM_014372053.2)的Tpi基因序列进行同源性比对,由MEGA 5软件绘制Neighbor Joining系统进化树;在NCBI中进行Tpi基因序列开放阅读框的识别并翻译成氨基酸序列。
1.4.5 生物信息学分析 利用 Protparam在线程序预测AcTpi编码氨基酸的基本理化性质;利用NCBI的 Conserved Domain Database对AcTpi编码蛋白进行氨基酸保守结构域的预测。利用Protscale、TMHMM 2.0 等在线软件分析AcTpi编码氨基酸序列的疏水性、跨膜结构。采用SignalP-5.0 Server预测蛋白信号肽,利用NetPhos 3.1 Server,NetOGlyc 4.0和NetNGlyc 1.0进行潜在磷酸化位点及潜在O、N糖基化位点预测。利用网站http://Imed.med.ucm.es/Tools/antigenic.pl进行抗原决定簇预测。利用ABC pred在线软件对AcTpi进行B细胞表位预测,利用SOP-MA和Swiss-Model预测AcTpi的二级和三级结构。
2 结果
2.1AcTpi基因PCR扩增结果 扩增产物经过琼脂糖凝胶电泳检测,得到大小为750 bp的特异性条带(图1),与预期的片段大小相符。
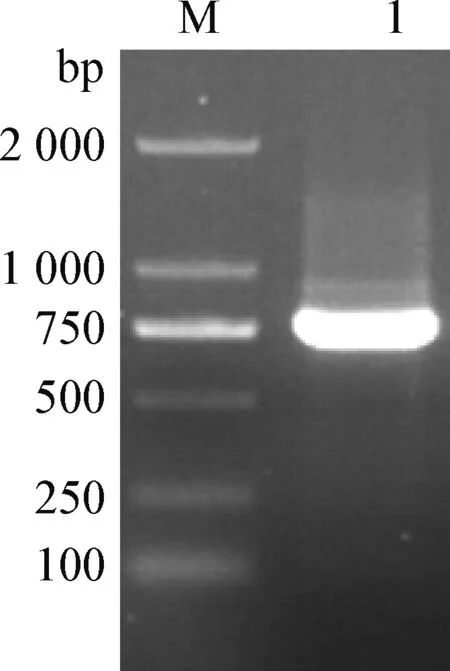
图1 AcTpi基因PCR扩增Fig.1 Amplification of AcTpi gene by PCRM:D 2 000 DNA相对分子质量标准; 1:AcTpi PCR产物M:D 2 000 DNA marker; 1:PCR product of AcTpi
2.2AcTpi基因同源性比对及系统进化树构建 应用DNAMAN 软件分析测序结果显示,AcTpi基因的CDS区全长744 bp,共编码247个氨基酸,碱基组成分别为A(36.96%)、T(29.44%)、C(11.96%)、G(21.64%),(G+C)%为33.60%。将AcTpi基因序列与GenBank中参考物种进行同源性比对,结果见图2。结果表明,AcTpi基因与已发表的中华蜜蜂、意大利蜜蜂、大蜜蜂、小蜜蜂、欧洲熊蜂、东方熊蜂、红斑石蜂、苜蓿切叶蜂、东南蓝莓蜜蜂、集蜂、麦茎蜂以及短管赤眼蜂的Tpi基因核苷酸序列同源性分别为100%、98.9%、98.3%、96.9%、88.8%、88.6%、88.4%、88%、87.9%、85.1%、78.9%和77.6%。
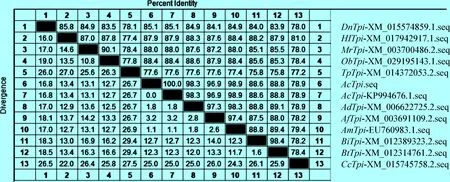
图2 中华蜜蜂与其他物种Tpi基因同源性比对Fig.2 Homology comparison of Tpi gene between Apis cerana cerana and other species注(Note):Ac:中华蜜蜂(Apis cerana); Am:西方蜜蜂(Apis mellifera);Ad:大蜜蜂(Apis dorsata); Af:小蜜蜂(Apis florea); Bt:欧洲熊蜂(Bombus terrestris); Bi:东方熊蜂(Bombus impatiens); Ob:石蜂(Osmia bicornis); Mr:苜蓿切叶蜂(Megachile rotundata); Hl:东南蓝莓蜜蜂(Habropoda laboriosa);Dn:集蜂(Dufourea novaeangliae); Cc:麦茎蜂(Cephus cinctus); Tp:短管赤眼蜂(Trichogramma);下同(The same as below)
利用MEGA 5软件对中华蜜蜂与GenBank中参考物种Tpi基因序列绘制Neighbor Joining系统进化树,结果见图3。由图3可见,Tpi基因进化树总体分为两大支,中华蜜蜂最先与意大利蜜蜂聚在一起,与大蜜蜂和小蜜蜂聚为一小支,然后再与东南蓝莓蜜蜂、东方熊蜂和欧洲熊蜂聚在一起,之后再与集蜂、苜蓿切叶蜂和野蜂聚为一大支。麦茎蜂和短管赤眼蜂聚为一支。
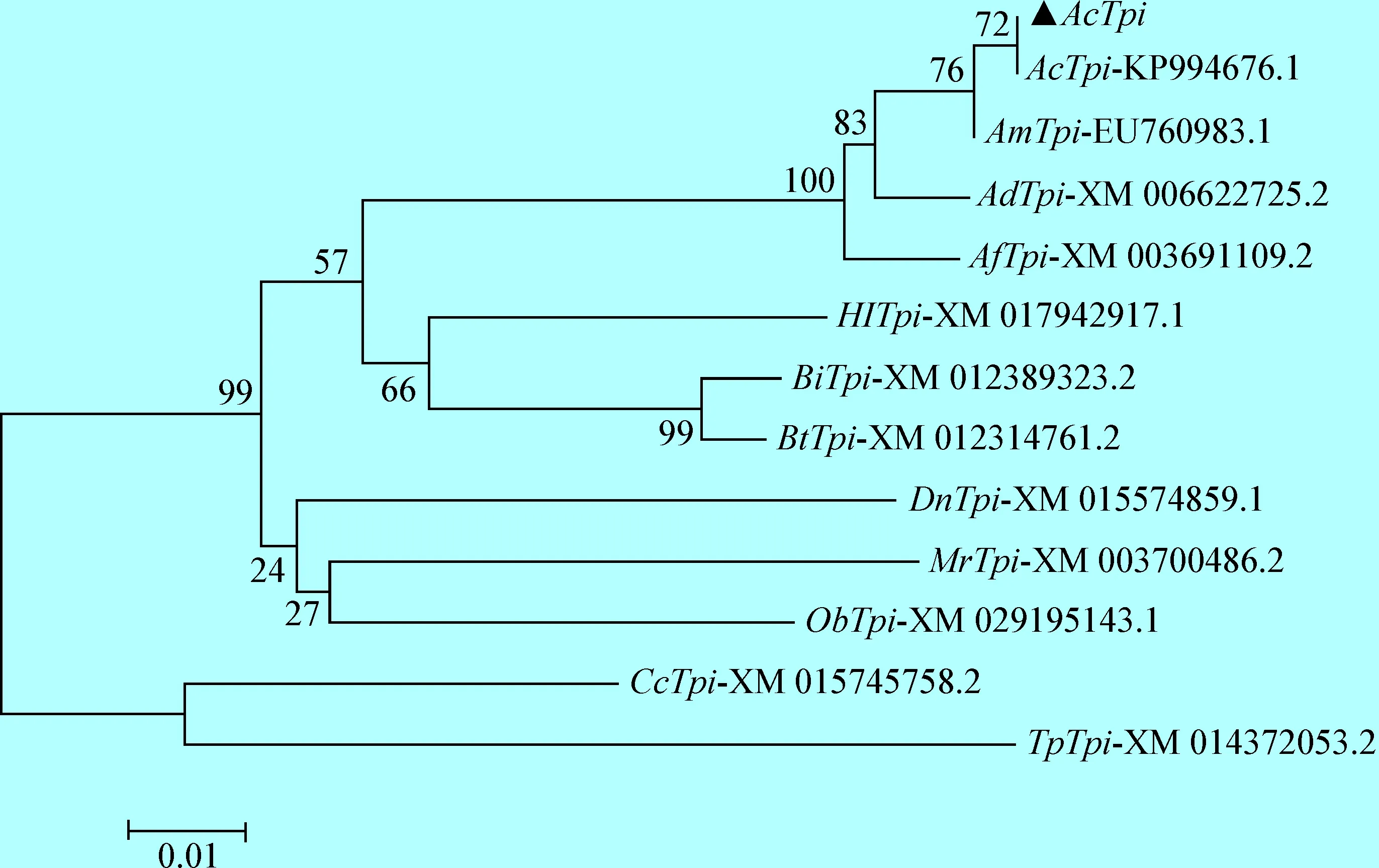
图3 中华蜜蜂与其他物种基于Tpi编码氨基酸序列的分子进化树Fig.3 The phylogenetic tree based on amino acid sequences of Tpi from Apis cerana cerana and other species
2.3AcTpi编码氨基酸理化特性及结构域分析 运用ExPASy 的ProtParam数据库对AcTpi编码蛋白的理化性质预测,推测AcTpi编码蛋白分子式是C1206H1918N328O359S4, 理论分子量为26.88 kDa,理论等电点为7.76,脂肪指数为93.52,主要由22 种氨基酸编码,该蛋白不稳定系数为27.32(<40),提示该蛋白较稳定。对AcTpi编码蛋白的氨基酸保守结构域进行预测分析,结果如封二彩版图4所示,AcTpi属于T细胞免疫球蛋白域黏蛋白(T cell immunoglobulin domain mucin,Tim)超级家族,含有1个保守结构域。

2.4AcTpi编码蛋白亲水性/疏水性、跨膜螺旋结构及修饰结构预测 利用ExPASy ProtScal程序,对AcTpi基因编码产物的亲/疏水性分析,AcTpi疏水性图谱如图5所示,图中纵坐标0值以上为疏水区,其分值越高,疏水性越强;0值以下为亲水区。整个多肽链有2个明显的亲水区,多肽链的第135位Ala(A)和第136位Gly(G)分值最低(-2.411),亲水性最强。第42位的Val(V)分值最高(1.911),疏水性最强;该氨基酸序列内超过半数为亲水性残基,整条多肽链表现为亲水性,平均亲水指数为-0.182。
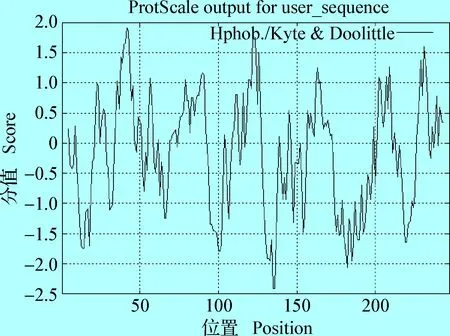
图5 AcTpi编码蛋白亲/疏水性预测Fig.5 The hydrophily/hydrophobicity profile of AcTpi coiding protein
利用在线跨膜区结构预测软件TMHMM 2.0进行AcTpi编码蛋白序列跨膜区分析,结果表明,该蛋白不含跨膜区,均为胞外区。对AcTpi基因信号肽进行预测结果表明,该蛋白没有信号肽区域,不是分泌型蛋白。利用NetPhos3.1 Server 进行潜在磷酸化位点预测,结果显示,阈值0.5 时,AcTpi存在17个潜在的磷酸化位点,其中包括8个苏氨酸(Thr) (位于肽链的第16、48、65、146、171、176、198位和第202位)和9个丝氨酸(Ser)(位于肽链的第18、44、78、95、118、155、192、210位和第234位)。利用软件NetOGlyc 4.0和NetNGlyc 1.0进行潜在O、N糖基化位点预测,结果显示,AcTpi不存在O-糖基化位点;AcTpi存在3个潜在的N-糖基化修饰位点,分别位于第14、57、196位氨基酸残基,概率分别为0.788 4、0.591 8和0.656 7。
2.5AcTpi编码蛋白抗原决定簇及B细胞表位预测 抗原决定簇预测结果表明,该蛋白的平均抗原倾向指数为1.020 3,如封二彩版图6所示,共含有10个抗原决定簇区域,分别位于20~29,32~52,64~70, 86~93,108~127,138~146,156~168,179~185,199~209位及225~243位氨基酸残基。结果表明,AcTpi编码蛋白含有较多的优势抗原表位结构,抗原倾向指数高。
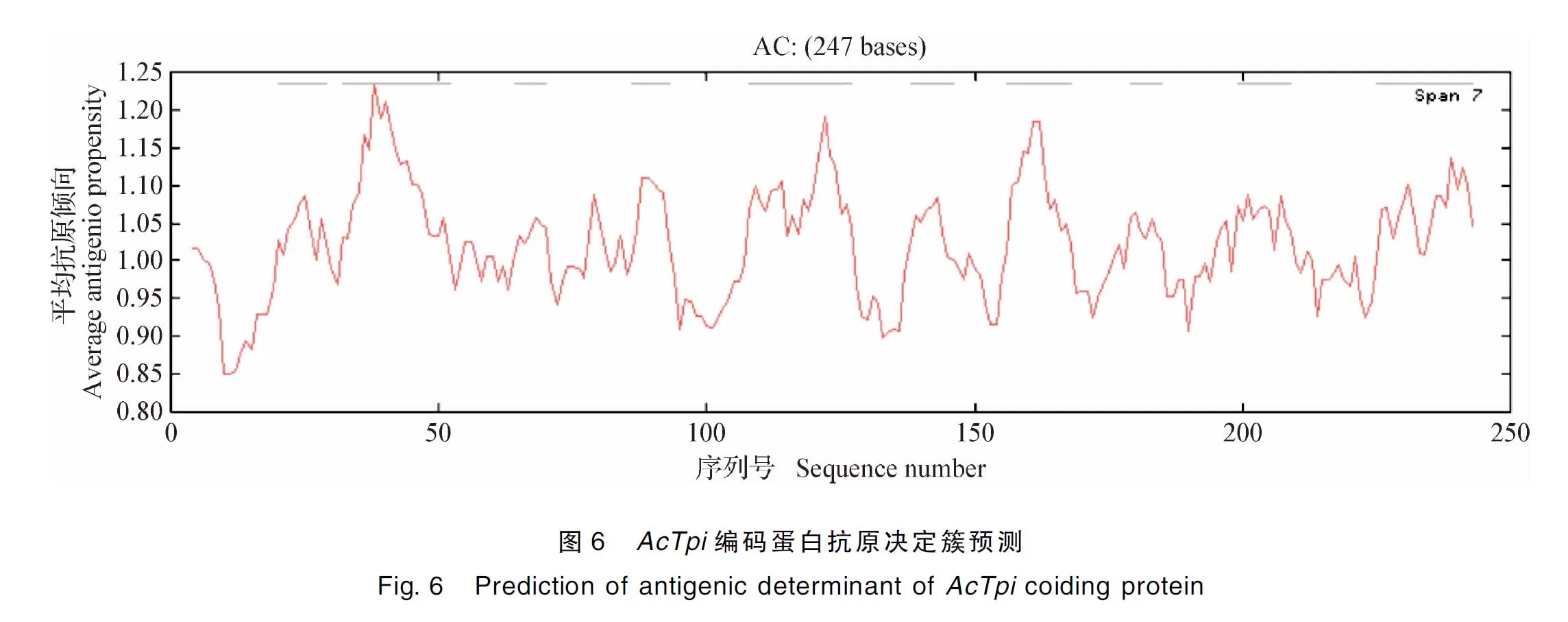
通过在线预测软件ABC pred得到可能形成B细胞线性表位的氨基酸序列区域为182~192、25~35、222~232、202~212、124~134、208~218、166~176、40~50、230~240、132~142、88~98、142~152、74~84、16~26和8~18;使用 IEBD对AcTpi的B细胞表位进行预测,预测的区域为11~20、130~139和210~224。综合两者的预测区域,两者重叠区域可能形成B细胞线性表位的氨基酸序列为20~25、 130~139和210~218。
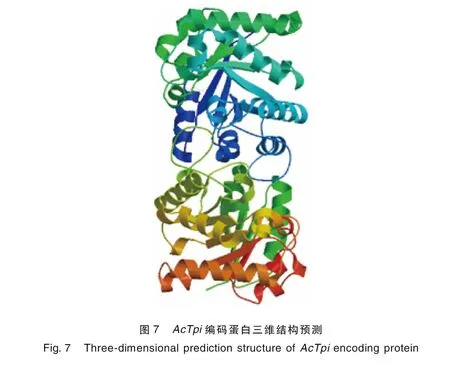
2.6AcTpi蛋白高级结构预测 使用在线预测软件SOP-MA预测AcTpi的二级结构,结果表明,该蛋白二级结构中α-螺旋占45.34%,β-折叠占17.41%,β转角占5.67%,无规则卷曲占31.58%。利用SwissModel数据库预测该蛋白的三维结构,如封二彩版图7。
3 讨论
磷酸丙糖异构酶(Tpi)能够催化磷酸二羟丙酮和D型3-磷酸甘油醛,用于磷酸丙糖异构体之间的可逆转换,在糖酵解和脂肪酸合成等途径中具有非常重要的作用。目前尚未找到替代Tpi酶学活性的酶类,针对Tpi的研究主要集中在物理性质、催化机理、催化过程中能量转换、临床药物或疫苗研发等方面。Tpi作为弓形虫的外分泌蛋白可引起宿主产生强烈的免疫应答[6],具有作为弓形虫感染标志物开发诊断试剂的潜在价值[7]。Tpi是世界卫生组织(WHO)推荐的最具潜力的血吸虫疫苗候选分子之一[8]。Tpi能够触发天然供体对1型细胞因子的免疫应答[9]。此外,Niaz课题组研究表明,Tpi是miR-22和miR-28的新靶点,miR-22/28介导的Tpi的转录后调控可能增加肿瘤细胞糖酵解能力,从而在肿瘤发生中产生重要意义[10]。
同源性比对结果显示,中华蜜蜂与意大利蜜蜂、大蜜蜂和小蜜蜂Tpi编码蛋白的同源性较高,序列同源性高达99.6%、98.4%和97.6%。蛋白质结构域预测为蛋白质组学研究提供重要的信息,同时为深入了解蛋白质功能提供重要依据。本试验克隆得到中华蜜蜂Tpi基因序列,并对其蛋白的理化性质、疏水性、信号肽、保守区结构域以及二级结构进行了预测分析,对深入了解中华蜜蜂Tpi基因及其功能研究具有重要意义。跨膜区预测结果显示,AcTpi氨基酸序列无跨膜区,且氨基酸残基均位于胞外,是一种外膜蛋白。该蛋白不含信号肽,不含跨膜区,极有可能在细胞内参加机体反应。抗原表位又称为抗原决定簇,是抗原分子表面具有特殊结构和免疫活性的化学基团,可刺激机体产生抗体或致敏淋巴细胞。在线软件ABC pred预测Tpi编码蛋白的B细胞表位,保留得分>0.8的结果,可提高预测准确性。抗原决定簇预测结果显示,AcTpi编码蛋白氨基酸序列含有10个潜在的抗原决定簇区域,抗原倾向指数高,提示该蛋白具有良好的免疫原性,易被免疫系统识别并产生有效的免疫反应。二级结构预测显示,AcTpi编码蛋白主要以无规则卷曲为主,存在多个α螺旋和β折叠区域。结果为进一步阐明中华蜜蜂Tpi在糖酵解过程中的作用及其功能的开发应用提供了科学依据。

