猪瘟病毒化学发光竞争ELISA抗体检测试剂盒的应用研究
徐 璐 , 张乾义 , 夏应菊 , 任雪健 , 李 翠 , 邹兴启 , 徐 嫄 , 王 兆 , 赵启祖 , 王 琴
(1.中国兽医药品监察所 国家/OIE猪瘟参考实验室 , 北京 海淀 100081 ; 2. 洛阳莱普生信息科技有限公司 , 河南 洛阳 471000)
猪瘟在我国为优先防治的重大动物疫病之一。虽然在2017年3月,该病已经正式退出国家的强制免疫计划[1],但猪瘟疫苗仍然是我国免疫覆盖率最高的猪用疫苗之一。近年来,市场上不断有猪瘟抗体检测试剂盒面世,但仍以传统的间接或阻断ELISA方法为主[2],试剂盒的操作便捷性和信号灵敏度等方面并未有明显的提高。对于各大中型养猪场及各级动物疫病控制中心来说,猪瘟抗体检测的样本量大,操作复杂,存在检测时间长,劳动强度大等问题。另外,传统ELISA试剂盒多采用TMB底物,信号的线性范围窄,无法准确区分不同抗体效价的血清,大大影响了试剂盒的检测效果。
本课题组采用猪瘟病毒E2蛋白单克隆抗体作为竞争抗体,以化学发光底物作为显色体系,开发了猪瘟病毒化学发光竞争ELISA抗体检测试剂盒(简称:发光试剂盒)。为了评价该试剂盒的临床应用效果,采用本试剂盒和进口试剂盒同时在6个地区进行了临床试验,共检验血清样本2 200份。为了进一步验证试剂盒检测结果的准确性,对田间采集的391份血清样本采用猪瘟抗体检验金标准方法-荧光抗体病毒中和试验(Fluorescent antibody virus neutralisation test,FAVN)进行了定性检测,评价本试剂盒与FAVN的符合率。另外,采用本试剂盒对5头免疫猪的抗体消长规律进行了监测,进一步评价本试剂盒对免疫血清的检测效果。
1 材料与方法
1.1 材料 PK15传代细胞系、猪瘟病毒Thiverval 株由中国兽医药品监察所鉴定、保存并提供;猪瘟病毒E2蛋白单克隆抗体,由中国兽医药品监察所制备并提供;FITC羊抗鼠二抗,购自Sigma公司;发光试剂盒,批号为E160602,由洛阳莱普生信息科技有限公司制备;猪瘟病毒抗体检测试剂盒(简称:进口试剂盒),批号为G261,购自IDEXX公司。
1.2 试验动物 3月龄健康仔猪,未免疫猪瘟疫苗,无猪瘟母源抗体,购自保定山区散养户。
1.3 血清样本 临床血清样本2 200份,分别由6家地市级动物疫病预防控制中心提供,采自山东、河南、山西省和陕西省;田间采集的猪瘟疫苗免疫和非免疫血清,共计391份。
1.4 试验方法
1.4.1 临床血清样本的检测 将6家实验单位提供的2 200份临床血清样本,分别用发光试剂盒和进口试剂盒进行检测,检测步骤按照试剂盒说明书进行,计算2种试剂盒的一致性。
1.4.2 与金标准方法的比较 将田间采集的391份血清,分别采用发光试剂盒和FAVN方法对血清样本进行检测,计算发光试剂盒与FAVN之间的一致性。FAVN试验具体操作步骤参见《陆生动物诊断试剂和疫苗手册》[3]。
1.4.3 统计学方法 选择SPSS统计学软件计算Kappa值,进行一致性分析,对应Kappa 值为:0.0~0.20极低的一致性、0.21~0.40一般的一致性、0.41~0.60 中等的一致性、0.61~0.80 高度的一致性和0.81~1几乎完全一致。
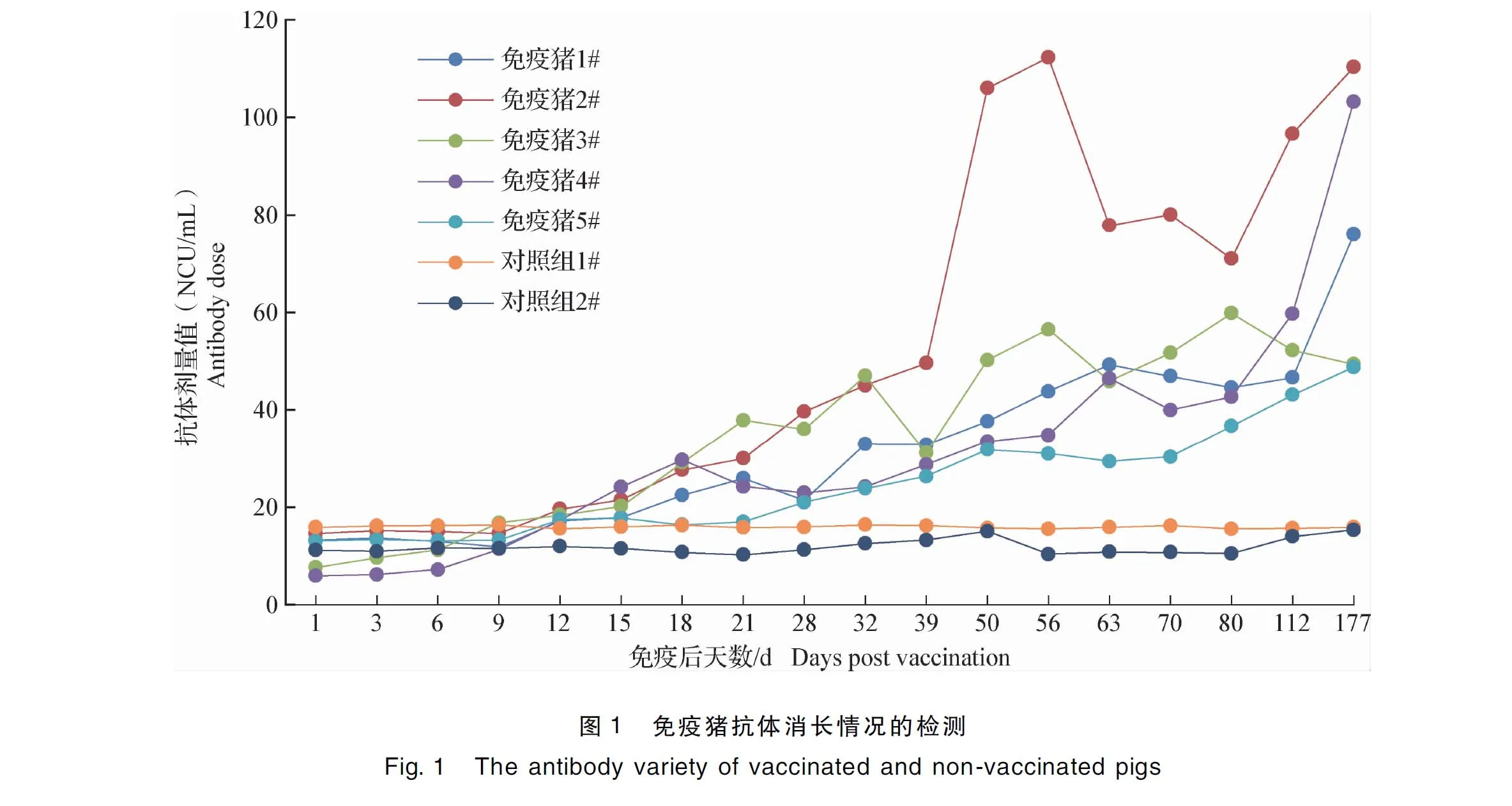
1.4.4 对免疫抗体消长的检测 将试验猪分为2组。第1组5头猪,为免疫组,每头猪免疫1头份猪瘟活疫苗(传代细胞源),批号为0907,广东永顺生物制药有限公司产品;第2组2头猪,为对照组,每头猪接种1 mL生理盐水。分别于免疫之后的第1、3、6、9、12、15、18、21、28、32、39、50、56、63、70、80、112天和第177天采集血清,用发光试剂盒进行检测,观察免疫抗体消长趋势。
2 结果
2.1 对临床血清样本的检测 在临床检测的2 200份猪血清样本中,发光试剂盒检测出1 452份阳性,748份阴性;进口试剂盒检测出1 420份阳性,769份阴性,结果见表1。采用SPSS软件,计算2种试剂盒的Kappa值为0.78,说明发光试剂盒与进口商品化试剂盒具有高度一致性。

表1 发光试剂盒与进口试剂盒的一致性Table 1 The coincidence of CLIA kit with IDEXX kit
2.2 与金标准方法的比较 在391份血清中,包括猪瘟抗体阳性血清191份,阴性血清200份。其中发光试剂盒检测出191份阳性,其中182份与FAVN结果一致;检测出200份阴性,有191份与FAVN结果一致,结果见表2。采用SPSS软件,计算2种方法的Kappa值为0.908,二者结果几乎完全一致,说明该试剂盒的检测结果更接近于金标准方法。

表2 发光试剂盒与FAVN的一致性Table 2 The coincidence of CLIA kit with FAVN
2.3 免疫血清抗体消长规律 从检测结果可以看出,免疫后15 d,4/5的免疫猪抗体转阳,免疫后18 d, 全部免疫猪的抗体转阳。而未免疫对照组直至试验结束均为抗体阴性。从中插彩版图1中可以看出,免疫后177 d,5头免疫猪的猪瘟抗体仍为阳性,且不同个体的抗体水平存在较大差异。
3 讨论
ELISA方法检测到的抗体均为结合抗体,虽然这些抗体能够与抗原发生特异性结合,但不一定会使病原失去感染性。而中和抗体则不同,与病原结合后,能够使病原丧失感染宿主细胞的能力。有研究表明[4],疫苗免疫后的阳性血清对不同猪瘟毒株的中和抗体效价不同。在猪瘟疫苗免疫初期,细胞免疫对攻毒保护起了非常重要的作用。而在免疫的中后期,体液免疫在疫苗保护中起了决定作用。因此中和抗体能够更加准确的反应机体的免疫状况,更适用于免疫效果评价。有研究者对结合抗体和中和抗体效价进行了比较,证明二者的相关性根据方法不同而有所差异[5-6]。
猪瘟疫苗免疫后,能够引起体液免疫反应,使机体产生特异性的抗体。猪瘟抗体检测包括2类,一类为检测结合抗体的酶联免疫吸附试验(ELISA)、正相间接血凝试验(IHA)、抗体胶体金免疫快速检测技术[7]、琼脂扩散试验以及免疫芯片技术等;另一类为检测中和抗体的病毒中和试验。病毒中和试验是检测猪瘟抗体的金标准方法,但该方法的操作复杂,检测时间长,检测成本高,影响因素多,无法推广使用。发光试剂盒通过对单克隆抗体的筛选,选择了1株具有适宜亲和力、且具有中和活性的单克隆抗体作为本试剂盒的竞争抗体,减少了检测步骤,大大缩短检测时间至1 h以内。通过对2 200份临床血清的检测,证明发光试剂盒与进口商品化试剂盒的检测结果具有高度的一致性,说明本试剂盒的敏感性、特异性等关键指标均不低于进口产品。而与金标准方法(FAVN)的比较结果说明本试剂盒的结果与中和抗体效价更为接近。
采用发光试剂盒对免疫后猪血清抗体的消长情况进行检测,证明在免疫后18 d,所有的免疫血清全部转为阳性。而在本课题组之前的研究中,免疫猪血清在免疫后15~28 d可全部转为阳性,与本研究的结果基本一致[8-9],说明本试剂盒的灵敏度不低于现有商品化ELISA试剂盒产品。另外,从结果中可以看出,不同的个体免疫后抗体增长的时间和增长幅度有很大差异,说明个体差异对免疫效果存在很大影响。

