分化抑制因子1在乙型肝炎病毒复制、肝癌细胞增殖和凋亡中的作用及机制研究
陆小琴,杜 锐,赵玉强,牛司强
(1.雅安职业技术学院药学与检验学院,四川 雅安 625000; 2.重庆医科大学附属第一医院医学检验科,重庆 400016)
分化抑制因子1 (inhibitor of differentiation 1, Id1)是一种螺旋-环-螺旋状结构的负性转录因子调控蛋白[1]。Id1可抑制转录因子的DNA结合和转录激活能力,参与调节细胞生长和分化[2-4]。Id1的表达与乙型肝炎病毒 (hepatitis B virus, HBV)相关性肝细胞癌的预后密切相关[5],如Ding等[6]人对96例HBV相关性肝细胞癌的组织样本进行分析发现,64.6%的样本显示Id1过表达,与组织学分级、淋巴结转移呈正相关,而且Id1过表达患者的生存率较低。但是,Id1在HBV相关性肝细胞癌中的作用机制仍缺乏报道,因此本文旨在探讨Id1在HBV复制、肝癌细胞增殖和凋亡中的作用及机制。
1 材料和方法
1.1 实验材料
HepG2.2.15肝癌细胞株(批号:ZQ0551)购自上海中乔新舟生物科技有限公司。
1.2 主要试剂与仪器
MTT、细胞凋亡检测试剂盒(批号:ST316、C1062S)购自上海碧云天生物技术有限公司;逆转录试剂盒、荧光定量PCR试剂盒(批号:D6110 A、DRR820 A)购自日本Takara公司;pGEx-4T-1质粒(批号:CW2198)购自北京康为世纪生物科技有限公司;TRIzol、Lipofectamine 2000转染液(批号:15596018、11668019)购自美国Invitrogen公司;胎牛血清、青链霉素、DMEM培养基(批号:16250086、15140163、11965092)购自美国Gibco公司;G418(批号:G8160)购自北京索莱宝科技有限公司;Pifithrin-α(批号:P4359)购自美国Sigma公司;HBsAg和HBeAg ELISA试剂盒(批号:227712、227699)购自武汉艾美捷科技有限公司;抗Id1抗体(批号:MAB4372)购自美国Chemicon公司;抗HBx抗体、抗Bax抗体、抗BcL-2抗体、抗Cleaved caspase-3抗体、抗GAPDH抗体(批号:ab39716、ab32503、ab32124、ab2302、ab181602)购自英国Abcam公司。
1.3 实验方法
1.3.1 质粒构建与细胞转染
参照于游等[7]的报道设计Id1的干扰序列(siRNA-Id1)和无关序列 (siRNA-Control)(见表1)。使用基因工程的方法将干扰序列和无关序列构建至pGEx-4T-1质粒中。使用Lipofectamine 2000转染液将siRNA-Id1质粒和siRNA-Control质粒转染至HepG2.2.15肝癌细胞株,使用实时定量聚合酶链式反应 (Quantitative real-time polymerase chain reaction, qRT-PCR)和蛋白质免疫印迹试验(Western blot)验证Id1 mRNA和蛋白质表达量的抑制效果。
1.3.2 细胞培养与分组
使用含10%胎牛血清、100 U/mL青链霉素和400 μg/mL G418的DMEM培养基培养HepG2.2.15肝癌细胞。将细胞随机分为4组:对照组(Control group)、siRNA-Control组(siRNA-Control group)、siRNA-Id1组(siRNA-Id1 group)、siRNA-Id1+Pifithrin-α组(siRNA-Id1+Pifithrin-α group)。对照组细胞不进行细胞转染,siRNA-Control组细胞使用siRNA-Control质粒转染,siRNA-Id1组细胞使用siRNA-Id1质粒转染,siRNA-Id1+Pifithrin-α组细胞使用siRNA-Id1质粒转染后加入终浓度为20 μmol/L的Pifithrin-α[8]。孵育48 h后,收集细胞和上清液进行检测。
1.3.3 qRT-PCR
TRIzol试剂盒提取HepG2.2.15细胞中的mRNA,逆转录试剂盒将mRNA逆转录为cDNA,荧光定量PCR试剂盒检测Id1和HBx基因的表达,引物序列(见表2)。目的基因的相对表达量=(实验组的2-ΔCt)/(对照组的2-ΔCt)(ΔCt=目的基因Ct值-内参基因Ct值)[9]。
1.3.4 酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)
ELISA试剂盒检测细胞上清液中HBsAg和HBeAg的含量,酶标仪450 nm波长处测定吸光度值(Optical Density, OD)。
1.3.5 Western blot
细胞裂解后,12000 r/min离心10 min,取上清进行蛋白定量,然后进行聚丙烯酰胺凝胶电泳和转膜,封闭2 h,使用抗Id1抗体 (1∶500)、抗HBx抗体 (1∶1000)、抗Bax抗体 (1∶1000)、抗BcL-2抗体 (1∶1000)、抗Cleaved caspase-3抗体 (1∶1000)、抗GAPDH抗体 (1∶5000),4℃过夜孵育。洗涤后,加入二抗孵育1 h,洗涤后显色,曝光和拍照。使用Image Pro Plus 6.0软件测定灰度值,对照组中目的条带和GAPDH条带的灰度值之比作为1[10]。
1.3.6 MTT试验
将5×103个细胞种植于96孔板,于培养24 h、48 h和72 h后加入10 μL 5 mg/mL的MTT溶液,继续培养4 h,吸弃上清液,加入100 μL的DMSO溶液,室温下振荡混匀5 min,酶标仪在490 nm下测定OD值。
1.3.7 流式细胞术
向105个细胞中加入195 μL的AnnexinⅤ-FITC结合液重悬,加入5 μL的AnnexinⅤ-FITC和10 μL的碘化丙啶,混匀后孵育20 min,流式细胞仪检测。Annexin Ⅴ+PI-细胞为早期凋亡细胞,Annexin Ⅴ+PI+细胞为晚期凋亡细胞,凋亡率=凋亡细胞数/总细胞数×100%。
1.4 统计学方法

2 结果
2.1 siRNA-Id1抑制Id1的表达
siRNA-Id1组细胞中Id1 mRNA和蛋白的表达量低于siRNA-Control组(P<0.05)(见图1和表3)。
2.2 siRNA-Id1抑制HBx的表达
与siRNA-Control组相比较,siRNA-Id1组细胞中HBx mRNA和蛋白的表达量降低(P<0.05);与siRNA-Id1组相比较,siRNA-Id1+Pifithrin-α group组细胞中HBx mRNA和蛋白的表达量升高(P<0.05)(见图2和表4)。
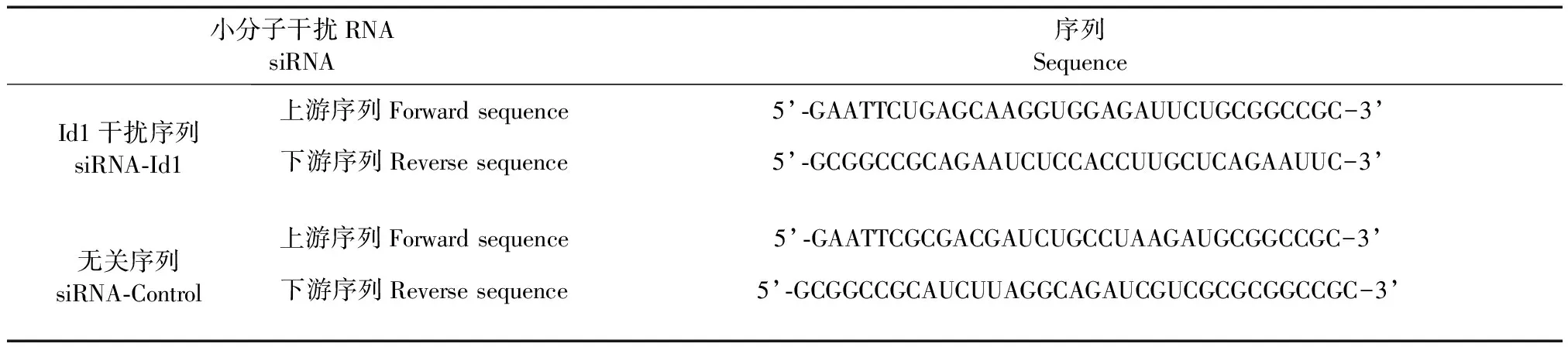
表1 siRNA序列

表2 引物序列
2.3 siRNA-Id1抑制乙型肝炎病毒的复制
与siRNA-Control组相比较,siRNA-Id1组细胞上清液中HBsAg和HBeAg的含量降低(P<0.05);与siRNA-Id1组相比较,siRNA-Id1+Pifithrin-α group组细胞上清液中HBsAg和HBeAg的含量升高(P<0.05)(见表5)。
2.4 siRNA-Id1抑制HepG2.2.15肝癌细胞的增殖
与siRNA-Control组相比较,siRNA-Id1组细胞在培养48 h和72 h时的OD值降低(P<0.05);与siRNA-Id1组相比较,siRNA-Id1+Pifithrin-α group组细胞在培养48 h和72 h时的OD值升高(P<0.05)(见表6)。
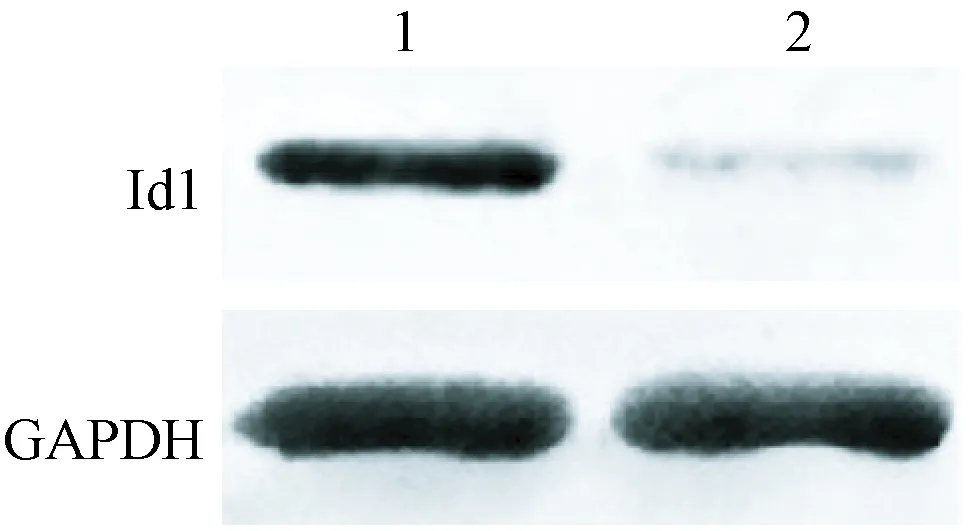
注:1:siRNA-Control组;2:siRNA-Id1组。图1 Western blot检测细胞中Id1蛋白的表达Note. 1, siRNA-Control group; 2, siRNA-Id1 group.Figure 1 Western blot was used to examine the protein expression of Id1

表3 Id1表达的比较(n=10)
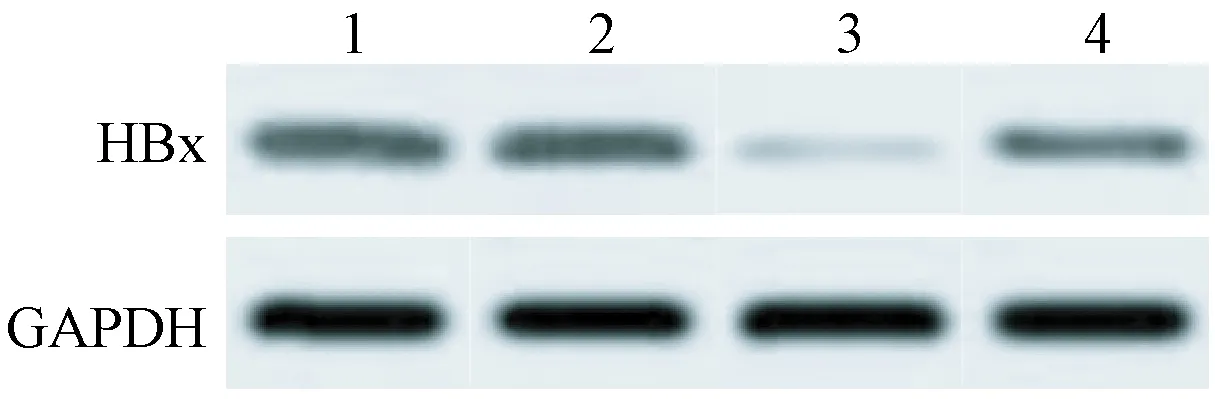
注:1:Control组;2:siRNA-Control组;3:siRNA-Id1组;4:siRNA-Id1+Pifithrin-α组。图2 Western blot检测HBx蛋白的表达Note. 1, Control group; 2, siRNA-Control group; 3, siRNA-Id1 group; 4, siRNA-Id1+Pifithrin-α group.Figure 2 Western blot was used to examine the protein expression of HBx
表4 4组细胞中HBx表达的比较(n=10)
注:与Control组相比,*P<0.05;与siRNA-Control组相比,#P<0.05;与siRNA-Id1组相比,▲P<0.05。
Note. Compared with Control group,*P<0.05. Compared with siRNA-Control group,#P<0.05. Compared with siRNA-Id1 group,▲P<0.05.
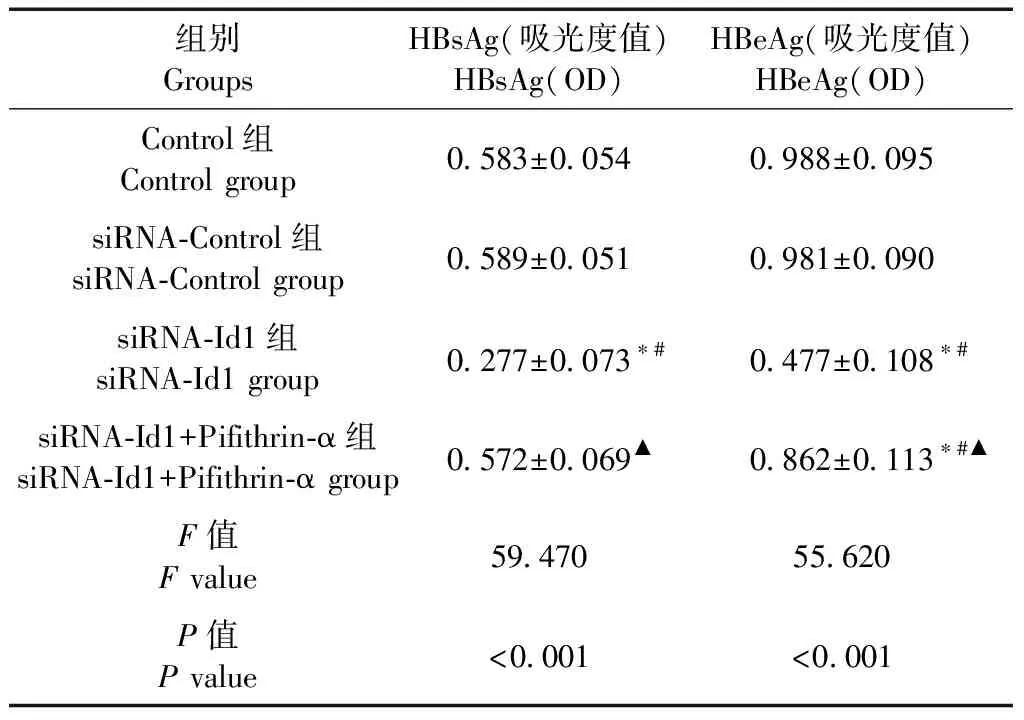
表5 细胞上清液中HBsAg和HBeAg水平的比较(n=10)
注:与Control组相比,*P<0.05;与siRNA-Control组相比,#P<0.05;与siRNA-Id1组相比,▲P<0.05。
Note. Compared with Control group,*P<0.05. Compared with siRNA-Control group,#P<0.05. Compared with siRNA-Id1 group,▲P<0.05.
2.5 siRNA-Id1诱导HepG2.2.15肝癌细胞的凋亡
与siRNA-Control组相比较,siRNA-Id1组细胞的早期细胞凋亡比例和晚期细胞凋亡比例升高(P<0.05);Pifithrin-α可抑制Id1基因沉默后的促凋亡效应(P<0.05)(见图3和表7)。
2.6 siRNA-Id1对凋亡相关蛋白表达的影响
与siRNA-Control组相比较,siRNA-Id1组细胞中Bax和Cleaved caspase-3蛋白的表达量升高,而BcL-2蛋白的表达量降低(P<0.05);Pifithrin-α可部分抑制Id1基因沉默后的生物学效应(P<0.05)(见图4和表8)。

表6 4组细胞增殖的比较(n=10)
注:与Control组相比,*P<0.05;与siRNA-Control组相比,#P<0.05;与siRNA-Id1组相比,▲P<0.05。
Note. Compared with Control group,*P<0.05. Compared with siRNA-Control group,#P<0.05. Compared with siRNA-Id1 group,▲P<0.05.

图3 流式细胞术检测细胞的凋亡Figure 3 Flow cytometry was used to examine cell apoptosis

表7 4组细胞凋亡率的比较(n=10)
注:与Control组相比,*P<0.05;与siRNA-Control组相比,#P<0.05;与siRNA-Id1组相比,▲P<0.05。
Note. Compared with Control group,*P<0.05. Compared with siRNA-Control group,#P<0.05. Compared with siRNA-Id1 group,▲P<0.05.

表8 细胞凋亡相关蛋白表达的比较(n=10)
注:与Control组相比,*P<0.05;与siRNA-Control组相比,#P<0.05;与siRNA-Id1组相比,▲P<0.05。
Note. Compared with Control group,*P<0.05. Compared with siRNA-Control group,#P<0.05. Compared with siRNA-Id1 group,▲P<0.05.
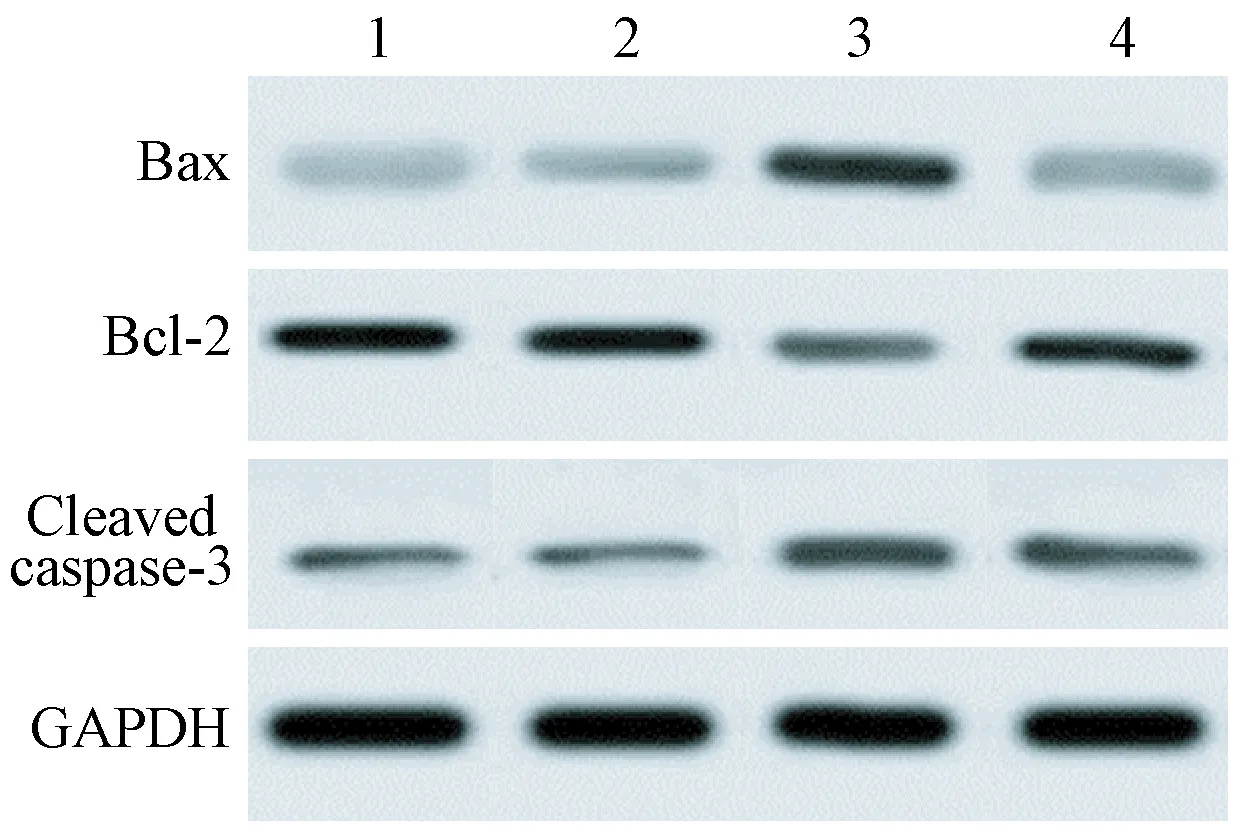
注:1:Control组;2:siRNA-Control组;3:siRNA-Id1组;4:siRNA-Id1+Pifithrin-α组。图4 Western blot检测细胞中Bax、BcL-2、Cleaved caspase-3蛋白的表达Note. 1, Control group; 2, siRNA-Control group; 3, siRNA-Id1 group; 4, siRNA-Id1+Pifithrin-α group.Figure 4 Western blot was used to examine the protein expression of Bax, BcL-2, Cleaved caspase-3
3 结论
Id1是一种DNA结合抑制因子,可与碱性HLH家族成员形成异二聚体,抑制转录因子的DNA结合和转录激活能力[1]。Id1的过表达会导致肝细胞癌预后不良,如邓宏宇等[11]发现Id1在肝细胞肝癌组织标本中表达升高,而且其表达水平与患者的生存时间负相关。尽管已有研究表明Id1可能参与肝癌细胞的病理进展,但是Id1对肝癌细胞增殖、凋亡等生物学功能的影响仍缺乏相关证据,其作用机制尚不清楚,尤其是在HBV相关性肝细胞癌。
HBx蛋白可调节蛋白酶活性、胞浆钙离子信号通路等功能,在促进HBV的有效复制中发挥重要作用,如Keasler等[12]发现在缺乏HBx蛋白的情况下,HBV在HepG2肝癌细胞中的复制水平降低了65%,而且该研究结论在小鼠模型中也得到了证实。此外,Ding等[6]人发现Id1与HBx的表达量呈正相关,双重免疫荧光染色证实Id1与HBx在HBV相关性肝细胞癌组织中共表达,而且HBx可以促进HepG2肝癌细胞表达Id1 mRNA和蛋白。本文结果显示,Id1沉默后HBx mRNA和蛋白的表达量均显著下降,表明Id1不仅受到HBx的调节,还可以反过来调节HBx的表达。HBsAg和HBeAg是评价HBV复制的重要指标,本文也发现Id1沉默后的HepG2.2.15细胞培养上清液中HBsAg和HBeAg的含量低于转染对照组。以上结果表明,抑制Id1的表达可以下调HBx的表达和降低乙型肝炎病毒的复制。
为了进一步探讨Id1对HBV相关性肝癌细胞增殖和凋亡的影响,本文分别对各组HepG2.2.15细胞进行了MTT试验和AnnexinⅤ-FITC标记,结果显示Id1沉默后细胞的增殖受到抑制,而且早期凋亡细胞和晚期凋亡细胞比例均显著升高。此外,与siRNA-Control组相比较,siRNA-Id1组细胞中Bax和Cleaved caspase-3蛋白的表达量升高,而BcL-2蛋白的表达量降低,表明Id1沉默导致的促凋亡效应可能与线粒体凋亡信号通路的激活有关。
p53基因是一种抑癌基因,其缺失和变异在一系列肿瘤的发生发展中起重要作用。p53也在HBV相关性肝细胞癌中发挥重要的病理作用,如Liu等[13]发现p53表达的缺失可激活HGF/c-Met信号通路,导致肝细胞癌的侵袭和转移能力增强。此外,Yu等[14]发现Id1可以促进p53蛋白的降解,与上调MDM2癌基因的表达有关。根据以上研究结论,本文推测Id1对HBV复制、肝癌细胞增殖和凋亡的影响是否与Id1沉默导致p53过表达有关。因此,本文将一种常用的p53抑制剂Pifithrin-α添加至Id1沉默的HepG2.2.15细胞中,结果显示Pifithrin-α可不同程度的抑制siRNA-Id1对HBV复制和细胞增殖的抑制效应以及细胞凋亡的促进效应,表明Id1可能通过调节p53参与上述生物学效应。
综上所述,Id1的特异性小分子干扰RNA可以降低乙型肝炎病毒的复制,抑制肝癌细胞的增殖,诱导肝癌细胞的凋亡,其机制可能与p53的过表达有关。

