超声辅助热水浸提小球藻多糖及抗氧化活性测定
刘 芬,朱顺妮,徐忠斌,王忠铭*
(1.中国科学院 广州能源研究所,广东 广州 510640;2.中国科学院可再生能源重点实验室,广东 广州 510640;3.广东省新能源与可再生能源研究开发与应用重点实验室,广东 广州 510640;4.中国科学院大学,北京 100049)
近年来,微藻因其较高的含油量而受到广泛关注,被认为是最有潜力替代传统化石燃料的生物资源[1]。微藻种类繁多、环境适应能力强、生长周期短、固碳能力强,其中小球藻因其更快的生长速率成为最广泛培养的微藻品种之一[2]。除了油脂可利用外,微藻还富含多糖、蛋白质、维生素等多种营养成分,而实现对这些成分的利用是降低微藻生物能源生产成本,提高微藻利用经济性的关键[3]。近年来,小球藻在伤口愈合、解毒、抗肿瘤、生长刺激和免疫增强等方面的潜在治疗作用被广泛报道,研究表明这些生物活性主要与多糖和蛋白质复合物有关[4-6]。
活性多糖的提取是研究和利用多糖的前提。因多糖是强极性大分子化合物,传统上采用热水浸提法提取,但是该方法耗时长,难以使胞内多糖溶出[7]。稀酸、稀碱溶液浸沉虽然可以在一定程度上提高多糖的提取率,但是可能会破坏多糖的结构,如硫酸酯基结构,影响多糖的生物活性[8-9]。超声辅助提取、微波辅助提取和酶解法等可以有效地提高提取率[10]。超声辅助提取因产热少、耗时短、抽提率高等优点而应用较多[11]。
因此,本研究采用超声辅助热水浸提法提取小球藻多糖,并采用单因素及响应面法优化提取条件,利用傅里叶红外变换(Fourier transform infared spectrometry,FTIR)对最优提取条件下获得的多糖进行结构表征,并测定了其体外抗氧化活性,为小球藻多糖的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
小球藻藻粉:由户外跑道池养;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度97%):东京化成工业株式会社;OH·测定试剂盒:南京建成生物工程研究所;其余试剂均为国产分析纯。
1.2 仪器与设备
VCX800超声仪:美国SONICS &MATERIALS公司;TENSOR27傅里叶变换红外光谱仪:德国BRUKER公司;DF-101S恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;5804R离心机:德国Eppendorf公司。
1.3 方法
1.3.1 小球藻粗多糖的制备
称取一定量小球藻藻粉,以1∶20(g∶mL)料液比加入蒸馏水,按照所需实验条件进行超声破碎、热水浸提多糖,离心(8000r/min、10min)取上清,加入4%三氯乙酸(trichloroacetic acid,TCA),4 ℃静置过夜,离心(5 000 r/min、20 min)取上清加入5倍体积分数为95%乙醇,4℃静置过夜离心(8000r/min、10 min)取沉淀,-80 ℃冻干即获得小球藻粗多糖。
1.3.2 多糖含量测定
取一定量的粗多糖复溶,利用改良的苯酚-硫酸法[12]测定多糖质量浓度,以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,得到的标准曲线回归方程为:y=0.008 1x-0.010 6,相关系数R2=0.996 9。按照标准曲线回归方程计算样品中多糖的含量,多糖得率计算公式如下:
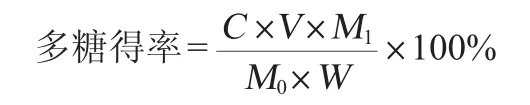
式中:C为复溶液多糖质量浓度,mg/mL;V为复溶液体积,mL;M0为复溶粗多糖质量,g;M1为总粗多糖质量,g;W为原料质量,g。
1.3.3 提取条件优化单因素试验
以多糖得率为评价指标,对影响提取结果的超声时间、提取温度、提取时间3个因素进行单因素试验,固定超声功率均为280 W,超声时间分别为0、10 min、20 min、30 min、40 min、50 min、60 min,提取温度分别为50 ℃、60 ℃、70 ℃、80 ℃、90 ℃、100 ℃,提取时间分别为1 h、2 h、3 h、4 h、5 h。
1.3.4 提取条件优化响应面试验设计
依据单因素试验结果,利用Box-Behnken中心组合设计,以超声时间(A)、提取温度(B)、提取时间(C)为自变量,多糖得率(Y)为响应值,优化提取条件。Box-Behnken试验设计因素与水平见表1。

表1 Box-Behnken试验设计因素水平Table 1 Factors and levels of Box-Behnken experiments design
1.3.5 红外光谱分析
取1 mg左右的小球藻粗多糖样品,以KBr压片,在波数4 000~400 cm-1范围内进行红外光谱扫描。
1.3.6 抗氧化活性试验
(1)DPPH自由基清除率测定[13]
配制不同质量浓度的多糖溶液,2 mL 样品溶液中加入0.1 mmol/L DPPH-乙醇溶液2 mL,混合均匀后于室温下避光反应30 min,于波长517 nm条件下测定吸光度值,以维生素C(vitamin V,VC)为阳性对照。DPPH自由基清除率计算公式如下:

式中:A0为对照吸光度值(乙醇替代样品);A1为样品吸光度值;A2为空白吸光度值(乙醇替代DPPH)。
(2)OH·清除率测定
利用南京建成OH·清除率测定试剂盒检测。OH·清除率计算公式如下:
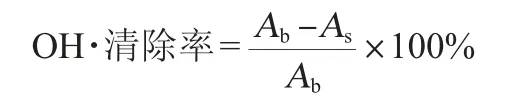
式中:Ab为对照组吸光度值(双蒸水替代样品);As为样品组吸光度值。
2 结果与分析
2.1 多糖提取的单因素试验结果
由图1A可知,小球藻多糖的提取率随着超声时间在0~60 min范围内的延长而升高;当超声时间为50 min时多糖的得率达到最高,为3.34%;之后稍有降低。这是因为超声时间越长,对小球藻的破坏作用越强,有助于小球藻多糖的溶出,但是过长时间的超声会对多糖的结构造成破坏[14],可能会不利于后期多糖的沉出。因此,超声时间50 min为宜。
由图1B可知,小球藻多糖的提取率随着提取温度在50~100 ℃范围内的升高而升高,上升趋势于90 ℃之后趋于平缓。随着提取温度的升高,多糖的溶解度逐渐增大,但是长时间的高温浸提可能会使多糖的糖链发生断裂[15],不利于后期多糖回收。因此,提取温度90 ℃为宜。
由图1C可知,提取时间在1~3 h范围内,小球藻多糖得率呈上升趋势;并在提取时间为时多糖的得率达到最高,为4.02%;当提取时间>3 h之后出现明显下降,这与孙建瑞等[16]的研究结果相同。长时间的浸提有利于多糖的溶出,但是过长提取时间的高温浸提会造成多糖的降解[17],不利于后期的回收。因此,提取时间3 h为宜。
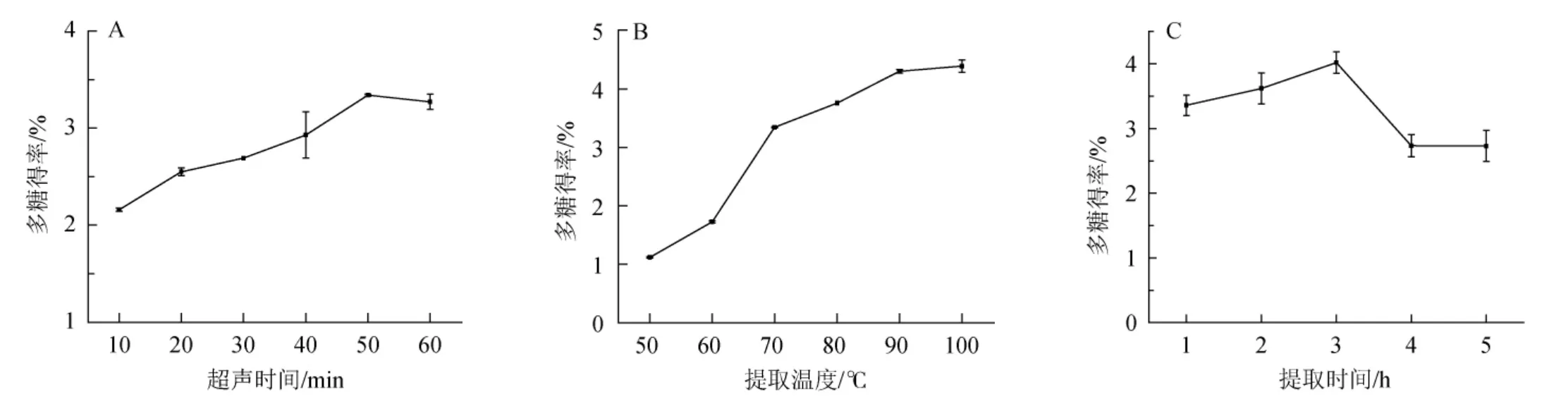
图1 超声时间(A)、提取温度(B)、提取时间(C)对小球藻多糖得率的影响Fig.1 Effects of ultrasonic time (A),extract temperature (B) and time (C) on yield of polysaccharide from Chlorella sp.
2.2 小球藻多糖提取条件优化响应面试验结果
2.2.1 响应面设计及结果
依据单因素试验结果,多糖得率(Y)为响应值,以超声时间(A)、提取温度(B)、提取时间(C)为变量,采用响应面法优化超声辅助水热法提取小球藻多糖条件,试验设计及结果见表2。
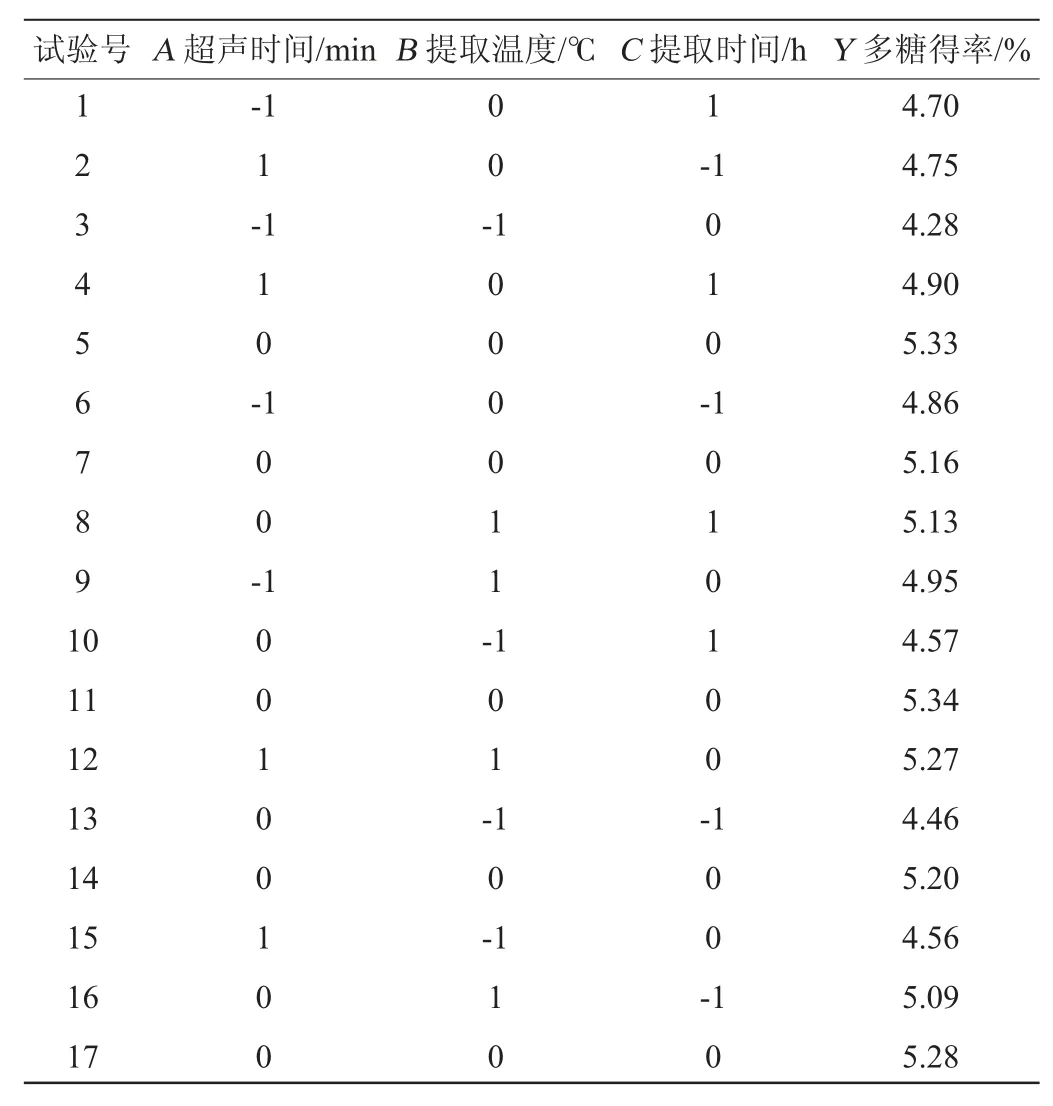
表2 Box-Behnken 试验设计及结果Table 2 Design and results of Box-Behnken experiments
通过对实验数据分析,可得小球藻多糖得率的二次多项式回归方程:
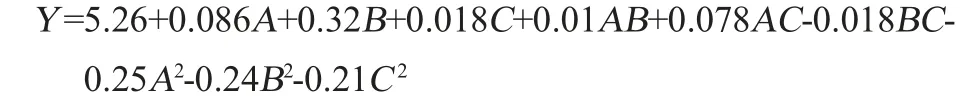
对该模型的方差及显著性进行分析,结果见表3。由表3可知,回归模型的P值=0.000 3<0.01,失拟项P值=0.240 2>0.05,模型极显著,失拟项不显著,说明模型可靠。决定系数R2=0.962 8,表明该模型的拟合度较好,可以很好地反应多糖得率与超声时间、提取温度和提取时间之间的关系。每种因子对小球藻多糖得率的影响程度为提取温度>超声时间>提取时间。
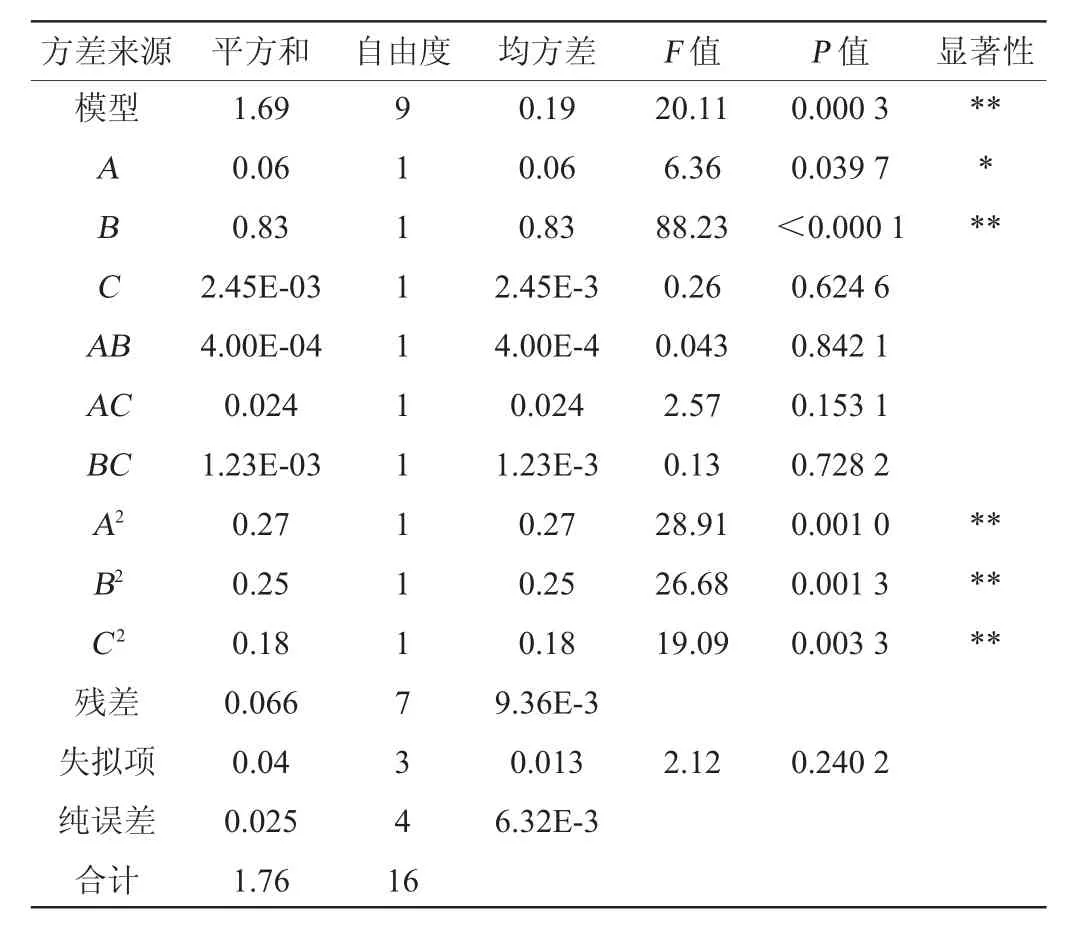
表3 回归方程方差分析Table 3 Variance analysis of regression model
2.2.2 响应面分析
三维响应面和等高曲线是回归函数的图形表示,反映了两个测试变量之间的相互作用以及响应值与各变量试验水平之间的关系。由图2a可知,在提取温度80~100 ℃内,随着超声时间的增加,多糖得率先上升后下降;当超声时间在40~60 min时,随着提取温度的提高,多糖得率总体呈上升趋势。说明提取温度对响应值的影响更为显著,与超声时间的交互作用不显著。由图2b可知,曲面图的陡峭趋势较为平缓,说明超声时间和提取时间对多糖得率的影响较小。超声时间在40~60 min时,随着提取时间的增长,多糖得率先上升后降低;当提取温度80~100 ℃内时,多糖得率同样先升高后降低,超声时间不同,最佳提取温度不同。说明提取时间和超声时间之间有交互作用。由图2c可知,在提取温度80~100 ℃内,随着提取时间的增长,多糖得率先上升后下降;当提取时间在2~4 h时,随着提取温度的提高,多糖得率先上升后趋于平缓。说明提取温度对响应值的影响极显著(P<0.01),与超声时间的交互作用不显著(P>0.05)。
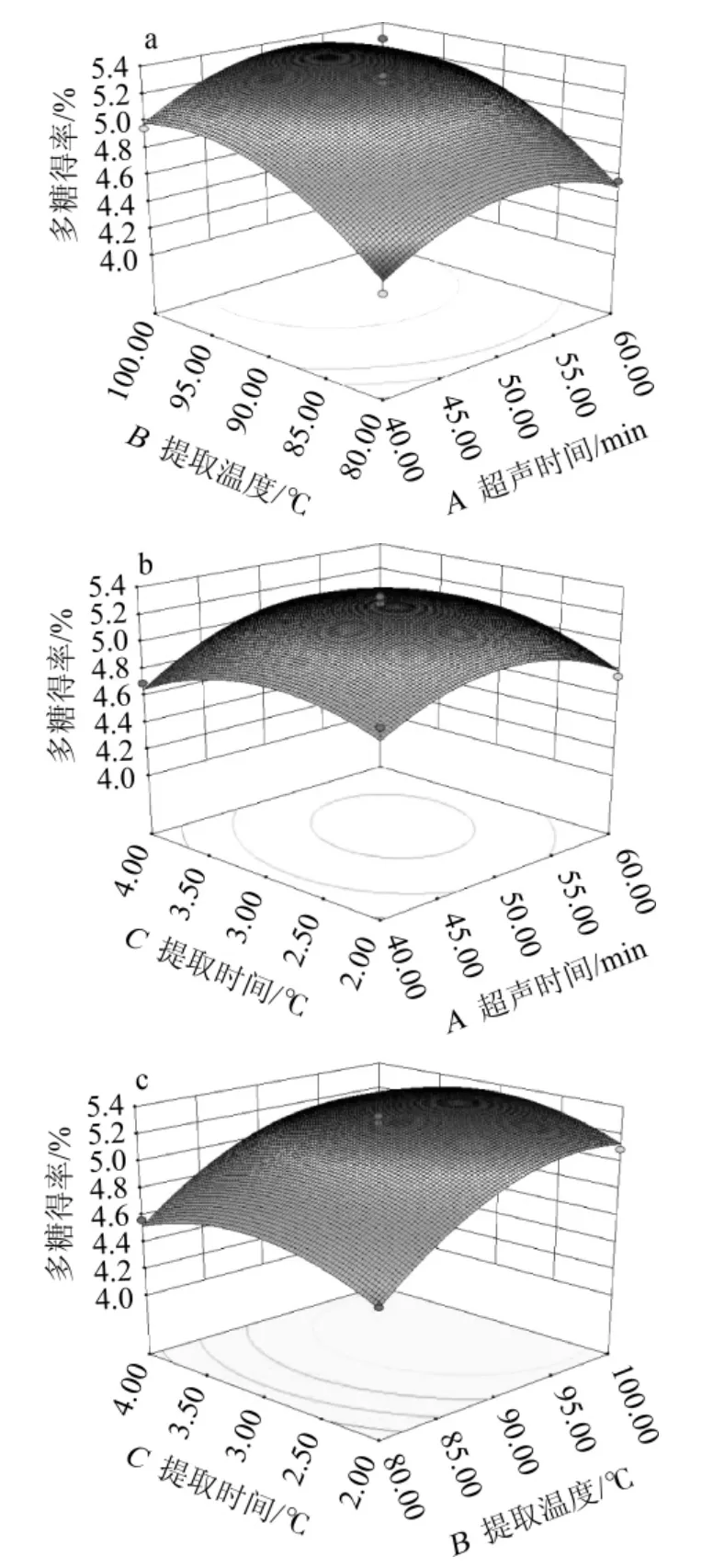
图2 超声时间、提取温度及提取时间对多糖得率影响的响应面和等高线Fig.2 Response surface plots and contour lines of effects of interaction between ultrasonic time,extract temperature and time on polysaccharide yield
2.2.3 最佳提取条件的验证
经软件Design-Expert 8.6分析,超声辅助热水浸提小球藻多糖的最佳条件为超声时间51.90 min,提取温度96.61 ℃,提取时间3.05 h,此条件下多糖得率理论值为5.38%。为方便实验操作,将预测条件调整为超声时间52 min,提取温度97 ℃,提取时间3.0 h,获得多糖得率实际值为5.30%,实际值和预测值的相对误差为1.49%,表明用该回归模型预测小球藻多糖得率是准确可行的。优化后的多糖得率与冻融辅助超声提取法[18](5.92%)及酶辅助提取法[19](5.78%)相近,比传统热水浸提的得率提高了2.46倍。
2.3 小球藻多糖的红外光谱分析
小球藻多糖的红外图谱见图3。因多糖样品为杂多糖,图谱较单一多糖组分更为复杂[20]。由图3可知,波数3394cm-1、2 928 cm-1处的-OH和C-H是多糖的特征吸收峰。1 724 cm-1处附近为C=O振动吸收峰,波数1 667 cm-1和1 419 cm-1处附近为COO-的伸缩振动,表明多糖中含有糖醛酸[21-22]。波数100~1 200 cm-1处附近为C-O-C伸缩振动,表明多糖样品中含有吡喃糖环。波数928 cm-1以及835 cm-1处附近的吸收峰表明,该多糖既有α-糖苷键又有β-糖苷键[23-24]。
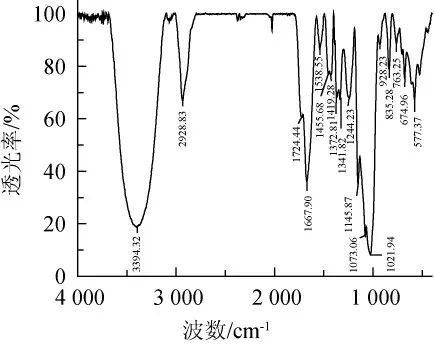
图3 小球藻粗多糖的红外图谱Fig.3 Infrared spectrogram of crude polysaccharide from Chlorella sp.
2.4 小球藻多糖的抗氧化活性
2.4.1 对DPPH自由基的清除能力
DPPH是一种可以稳定存在的氮族自由基,在波长517nm处有最大吸收峰,被抗氧化物还原后消失,被广泛用于评价物质的抗氧化性[25]。由图4可知,小球藻多糖对DPPH自由基的清除能力随着剂量的增大而增强,半抑制浓度(half maximal inhibitory concentration,IC50)值为4.83 mg/mL,优于乙醇分级沉淀的小球藻多糖[13],可能由于未进一步纯化。
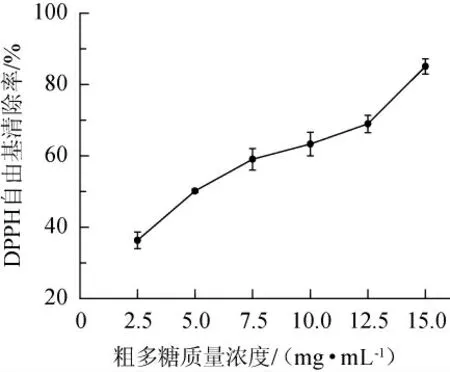
图4 小球藻粗多糖对DPPH自由基的清除能力Fig.4 Scavenging ability of crude polysaccharide from Chlorella sp.on DPPH free radicals
2.4.2 对OH·的清除能力
OH·是生物细胞内反应活性最强的氧族自由基,具有很高的电子还原电势,能与生物体内脂类、蛋白质、核酸等生物大分子产生最强的氧化破坏效应,引起细胞与组织的氧化损伤[27]。由图5可知,小球藻多糖对OH·的清除呈剂量依赖型,最大去除率可达95%,IC50值为0.77 mg/mL,去除能力高于酶辅助提取的小球藻多糖[19]。OH·去除率在达到最大值后趋于平稳状态。
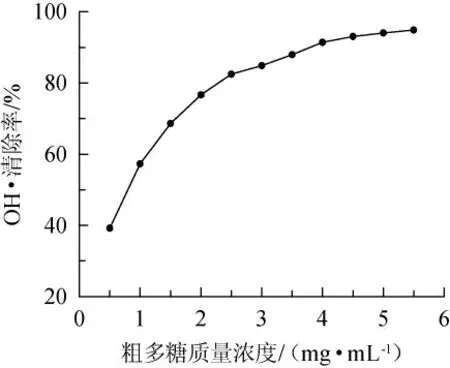
图5 小球藻粗多糖对羟自由基的清除能力Fig.5 Scavenging ability of crude polysaccharide from Chlorella sp.on OH free radicals
3 结论
本试验利用超声辅助热水浸提小球藻多糖,在单因素试验的基础上,采用响应面优化设计得到小球藻多糖的最佳提取工艺为:超声时间52 min,提取温度97 ℃,提取时间3.0 h,多糖得率为5.30%,与预测值5.38%较好吻合。提取的多糖具有多糖的典型特征吸收峰,含有糖醛酸,为吡喃糖,同时表现出对DPPH·及OH·的显著清除作用,是一种潜在的天然抗氧化剂。综上,超声热水辅助浸提小球藻多糖可有效提取小球藻多糖并保留多糖自身活性。提取的小球藻多糖可进一步去杂提纯以提高其有效的活性成分,并用于其他活性测试。

