昌黎产区产酶酵母多样性及其应用潜力分析
何曼,刘畅,朱凤妹,葛超,李军,阎贺静
(河北科技师范学院 食品科技学院,河北 昌黎,066600)
为避免非酿酒酵母(non-Saccharomycescerevisiae, NSC)的不利影响,目前葡萄酒酿造多使用活性干酵母(Saccharomycescerevisiae,SC)作发酵剂。近年来,随着对NSC研究的不断深入,发现许多NSC对葡萄酒的风味和感官具有积极作用,一些非NSC可作为发酵启动菌用于葡萄酒的酿造[1-5]。优选NSC与SC混菌发酵,可增加酒中甘油的含量,同时引起其他重要风味物质种类和含量的显著变化[3,6-7]。因此,选择适宜的NSC和SC混合发酵是改善葡萄酒品质和风味的有效途径[8-9]。研究证实,除代谢生成甘油、高级醇和酯等各种风味物质外,NSC影响葡萄酒结构和风味的另一个重要因素是能够产生丰富的胞外酶,这些酶作用于葡萄汁中相关底物对葡萄酒的组分和风味产生重要影响[9-11]。目前,葡萄酒酿造中广泛使用外源果胶酶以提高过滤通透性,同时利于香气物质和色素的提取[12]。β-葡萄糖苷酶在葡萄酒增香领域的重要作用也已经被许多研究所证明,但黑曲酶来源的糖苷酶专一性较差,作用于色素糖苷具有产生不良气味的风险[13-14]。同时,外源糖苷酶酿造环境耐性低,使用量大,酿造成本高。因此,产酶酵母在酿酒工业具有重要的酿造学意义。
目前,对产酶酵母的研究主要集中于产β-葡萄糖苷酶酵母的开发利用。对葡萄酒产区产酶酵母的多样性、产酶种类及开发利用等相关研究报道较少。昌黎产区是我国著名的葡萄酒产区,酵母资源丰富,已有研究者对昌黎产区酵母多样性进行了研究[15],但对该产区产酶酵母的研究和开发利用的报道还较少。本研究对昌黎产区4个不同地理位置的土壤样品产酶酵母多样性和应用潜力进行分析。
1 材料与方法
1.1 材料
1.1.1 土壤样品采集
土壤样品采自于河北省秦皇岛市昌黎产区嘉泰酒庄、耿氏酒堡、果树研究所和玛蒂尼酒庄的葡萄园,采用5点取样法取样,最后进行混合,用封口袋包装好置于-20 ℃下保藏备用。
1.1.2 主要试剂与仪器设备
活性干酵母为英纳蒂斯红佳酿(菌种为Saccharomycescerevisiae);对硝基苯-β-D-半乳糖吡喃糖苷(pNPG)和果胶均购自Sigam公司,其他试剂均为分析纯。
SPX-250B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;数显立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;PHS-25pH计,上海仪电科学仪器股份有限公司。
1.1.3 培养基
酵母分离和计数培养基(YPD培养基)(g/L):葡萄糖20,酵母浸粉10,蛋白胨20,自然pH,固体培养基加入20的琼脂,121 ℃灭菌20 min。
赖氨酸培养基(g/L):赖氨酸5.6,葡萄糖10,KH2PO40.85,MgSO40.5,琼脂20。
WL培养基(g/L):酵母浸粉4,蛋白胨5,葡萄糖50,琼脂20;储液A:KH2PO45.5 g,KCl 4.25 g,CaCl21.25 g,MgSO41.25 g,定容至400 mL,121 ℃灭菌20 min后4 ℃保存,用时按40 mL/L添加。储液B:FeCl30.25 g,MnSO40.25 g,定容至100 mL,121 ℃灭菌20 min后4 ℃保存,用时按1 mL/L添加。储液C:0.44 g溴甲酚绿溶于10 mL无菌水和10 mL 95%酒精中,用时按1 mL/L添加。
β-葡萄糖苷酶筛选培养基、淀粉酶筛选培养基的配制参照文献[11]。
果胶酶筛选培养基、纤维素酶筛选培养基的配制参照文文献[16]。
模拟葡萄汁培养基的配制参照文献[17]。
1.2 试验方法
1.2.1 土壤样品中产酶酵母的分离和初步鉴定方法
将0.5 g土壤样品加入含玻璃珠的49.5 mL无菌水中,振荡30 min后静置,梯度稀释后取适当稀释度的样品0.1 μL,涂布于含氯霉素的YPD固体培养基(每组3个平行),28 ℃培养48 h后计数。将单菌落分别转接至赖氨酸培养基、产酶筛选培养基和WL培养基,28 ℃下分别培养48 h,可在赖氨酸培养基上生长的酵母为NSC,相反则为SC;转接至产β-葡萄糖苷酶筛选培养基的酵母,喷洒Na2CO3后产黄色光圈的菌落为产β-葡萄糖苷酶的酵母;转接至产果胶酶筛选培养基中的酵母,有透明圈的菌落为产果胶酶的酵母菌;转接至产淀粉酶筛选培养基的酵母,喷洒碘液后观察5 min,出现透明圈的菌落为产淀粉酶的酵母菌;转接至产纤维素酶的筛选培养基中的酵母,有透明圈的菌落为产纤维素酶的酵母。将所有分离的单菌落,转接至WL培养基,28 ℃培养120 h,观察菌落形态、大小和颜色,参照文献报道,对其进行初步鉴定[18-19]。
1.2.2 产酶酵母酿造因子耐受性分析
将保存的酵母菌接入新鲜的YPD液体培养基,28 ℃培养24 h进行活化。活化后按照106CFU/mL的接种量接入以下不同的YPD培养基中,以不接种酵母的空白YPD培养基为对照,28 ℃培养48 h后,测定600 nm处吸光度,考察酵母菌的酿造因子耐受性。初始糖质量浓度为200、300、400、500 g/L的培养基,考察酵母的糖耐受性;SO2初始质量浓度为50、100、150、200 mg/L(SO2的浓度以质量分数为6%的的H2SO3调整)的培养基,考察酵母的SO2耐受性;无水乙醇初始体积分数为9%、12%、15%、18%的培养基,考察酵母的酒精耐受性;柠檬酸初始质量浓度为1(pH 4.0)、5(pH 3.5)、10(pH 3.0)、20 g/L(pH 2.5),考察酵母菌的酸耐受性;不同酵母菌接入YPD培养基,分别在15、20、25、30 ℃培养48 h,考察酵母的温度耐受性。
1.3 数据处理
文中图由origin软件生成。
2 结果与讨论
2.1 昌黎产区4个葡萄园土壤样品产酶酵母的分离
通过1.2.1的方法,从4个土壤样品中共分离到165株酵母菌,其中82株为SC、83株为NSC,产酶酵母为108株,占分离到的酵母总数的65%。由图1可见,产果胶酶的酵母数量最多(84株),产β-葡萄糖苷酶的酵母菌数量最少(13株)。其中55%的产酶酵母能分泌2种以上水解酶,44%的产酶酵母能分泌3种以上水解酶,说明昌黎产区产酶酵母资源丰富。
2.2 四个土壤样品产酶酵母产酶情况分析
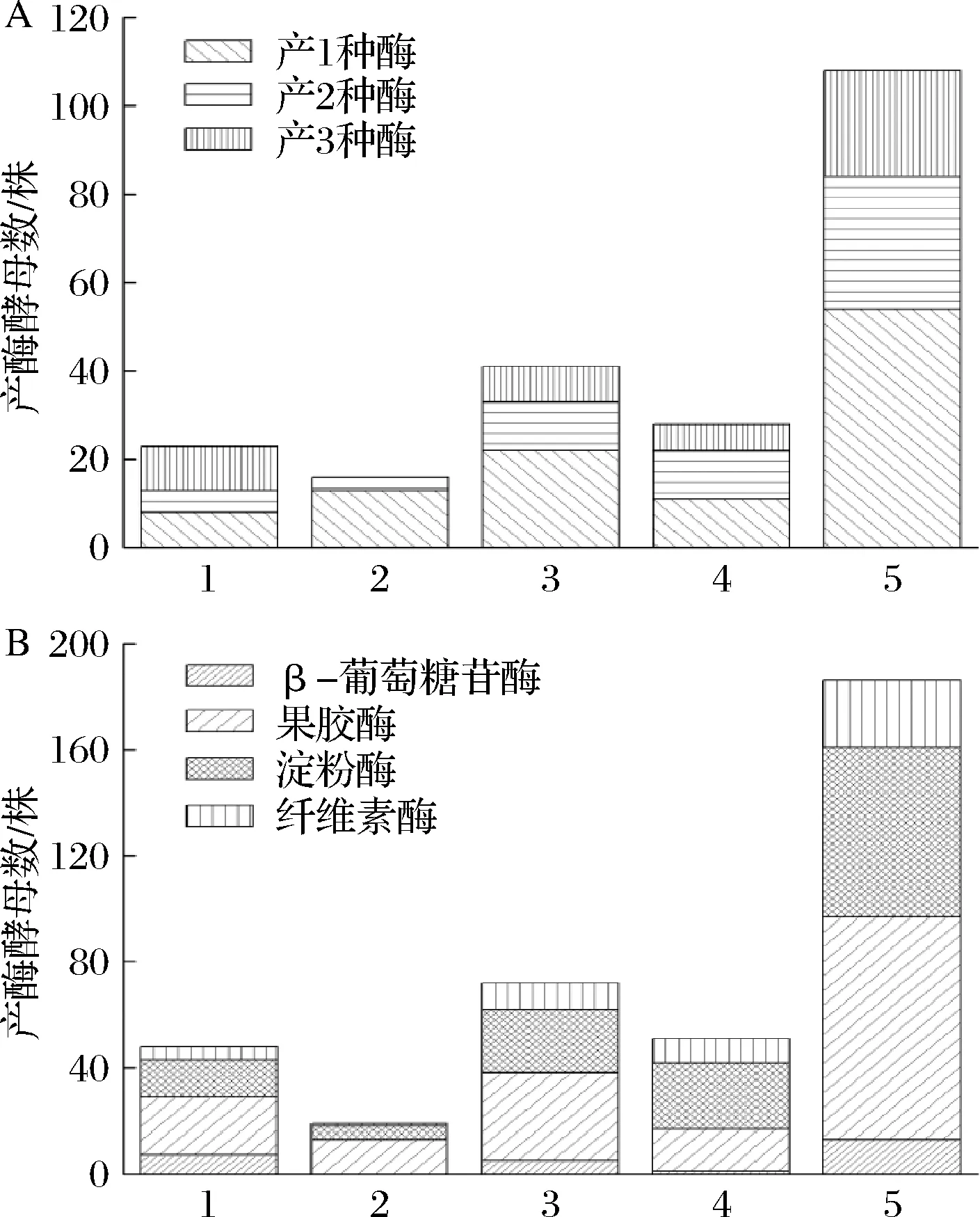
A-4个土壤样品产酶酵母的产酶数量;B-4个土壤样品产酶酵母的产酶种类;1-嘉泰酒庄;2-耿氏酒堡;3-果树研究所;4-玛蒂尼酒庄;5-合计
由表1和表2综合分析可见,4个葡萄园中的产酶酵母,产酶种类以产淀粉酶、纤维素酶和果胶酶为主,产β-葡萄糖苷酶的酵母数量较少。同时产果胶酶和纤维素酶的酵母数量较多(16株),同时产果胶酶和β-葡萄糖苷酶的酵母次之,同时产纤维素酶和β-葡萄糖苷酶的酵母最少,同时产果胶酶、纤维素酶和β-葡萄糖苷酶3种酶的酵母仅有1株,为M09(T.delbrueckii)。果胶酶和纤维素酶在果酒酿造过程中具有提高出汁率,澄清果汁。同时还能提高果皮中花色素苷、香气糖苷及单宁等物质的浸出率,改善果酒的品种和色泽[2-3]。β-葡萄糖苷酶是风味修饰的关键酶,它能水解葡萄酒中香味前体物质(萜烯-葡萄糖苷),释放天然香味浓郁的香气糖苷,对改善葡萄酒的香气有重要作用[20]。因此,同时产果胶酶、纤维素酶和β-葡萄糖苷酶的酵母和同时产其中2种酶的酵母在果酒酿造中具有很重要的酿造学意义。因此,在果酒酿造中应用上述3种酶产生酵母作为发酵剂,可以大大降低商业酿造酶的用量,降低成本,简化工艺,对提高葡萄酒的品质和改善香气具有非常重要的作用。
根据国内外的研究报道,H.uvarum是葡萄园和葡萄酒酿造环境中常见的含量最丰富的NSC[21],本试验分离到的产酶NSC中H.uvarum占12.96%,仅次于P.kluyveri和P.membranaefaciens。H.uvarum在葡萄酒自然发酵过程中主要出现在发酵前期,是其中主要的NSC。因为H.uvarum能够产生大量的乙酸,所以传统的观念认为H.uvarum是一种酸败菌,对葡萄酒的风味带来不利影响。但最近几年的研究发现,如果能够对H.uvarum进行有效的控制,和SC混菌发酵,会对葡萄酒的风味带来积极影响,增加葡萄酒的复杂性[21-22]。另外,还有研究报道,发现H.uvarum具有丰富的酶系,对提高葡萄酒的香气和品质具有积极作用,而且还发现,来源于H.uvarum的β-葡萄糖苷酶往往具有较高的耐性,在酒精发酵结束后仍有活性[23]。
此外,以上分离得到的产酶NSC中,Brettanomyces被认为是一种破败菌,通常对葡萄酒的酿造不利。而P.membranaefaciens、H.anomala、P.kluyveri、Z.bailii、S.pombe等在不同情况下对葡萄酒风味的影响不同。如果进行很好的控制,将会对葡萄酒的风味有积极作用[25]。T.delbrueckii、C.zemplinina、M.pulcherrima,因具有一些比较优良的特性,是近些年来研究较多的NSC,它们其中的一些已被制备成制剂应用于果酒的酿造。文献报道,Hanseniaspora、Debaryomyces、Hansenual及Metschnikowia等,不仅能完全发酵葡萄汁或其他高糖培养基,还能产生具有愉快的香味[24]。C.zemplinina用于高糖果汁的发酵,不仅耐高渗,还能利用果糖发酵,同时高产甘油,降低SC在高糖果汁中乙醇和乙酸的产量,因此可以用于低醇果酒的酿造[23-24]。

表1 产酶酵母产酶种类分析
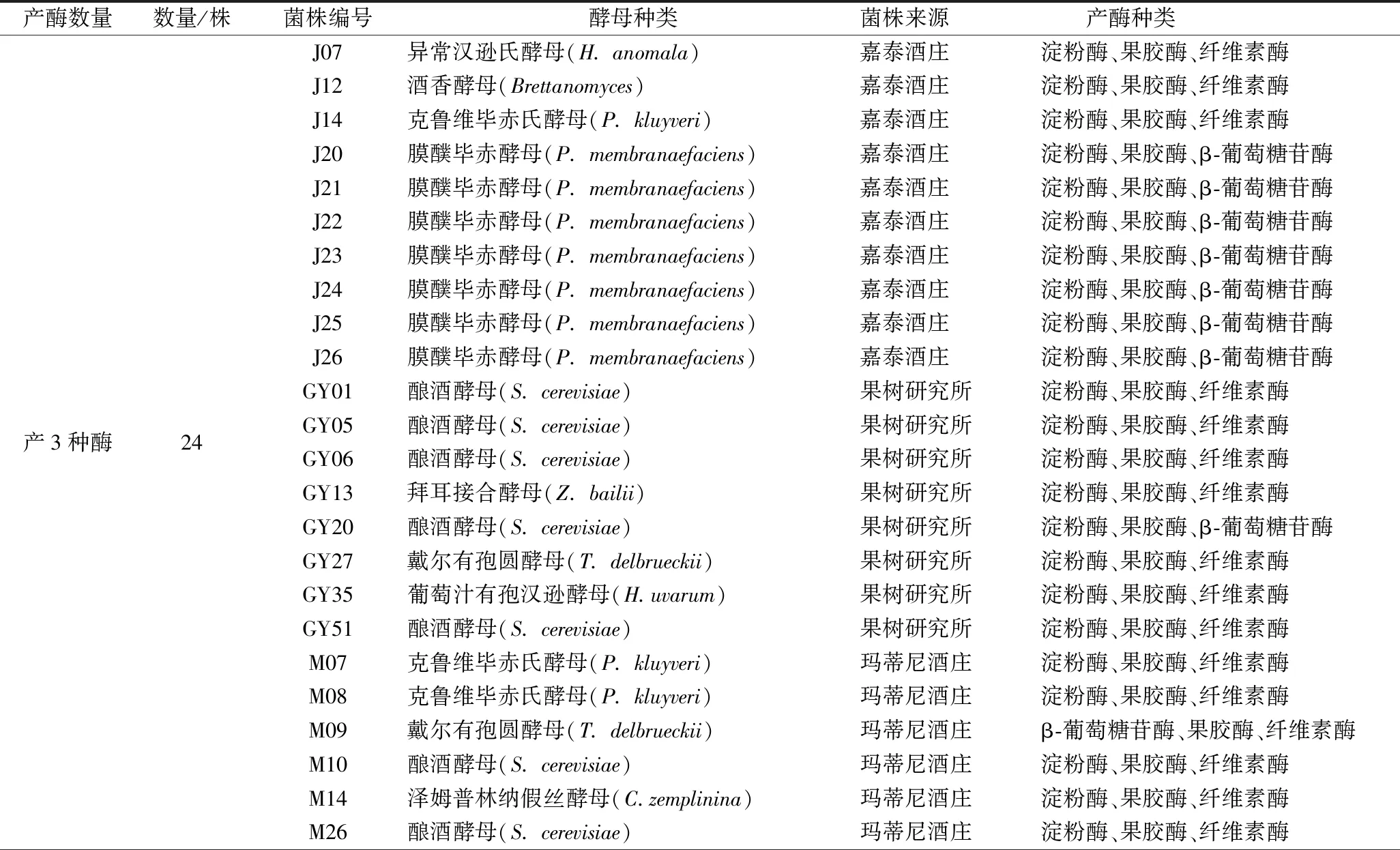
表2 不同酵母产酶基本情况
续表2

产酶数量数量/株菌株编号酵母种类菌株来源产酶种类产2种酶 30J05酒香酵母(S. cerevisiae)嘉泰酒庄淀粉酶、纤维素酶J08酿酒酵母(S. cerevisiae)嘉泰酒庄淀粉酶、果胶酶J11酒香酵母(Brettanomyces)嘉泰酒庄果胶酶、纤维素酶J15戴尔有孢圆酵母(T. delbrueckii)嘉泰酒庄淀粉酶、果胶酶J27膜醭毕赤酵母(P. membranaefaciens)嘉泰酒庄淀粉酶、果胶酶GS01葡萄汁有孢汉逊酵母(H.uvarum)耿氏酒堡淀粉酶、果胶酶GS21栗酒裂殖酵母(S. pombe)耿氏酒堡淀粉酶、果胶酶GS38克鲁维毕赤氏酵母(P. kluyveri)耿氏酒堡淀粉酶、纤维素酶GY19酿酒酵母(S. cerevisiae)果树研究所淀粉酶、果胶酶GY22酿酒酵母(S. cerevisiae)果树研究所淀粉酶、纤维素酶GY23酿酒酵母(S. cerevisiae)果树研究所淀粉酶、果胶酶GY32-果树研究所淀粉酶、果胶酶产2种酶 30GY38克鲁维毕赤氏酵母(P. kluyveri)果树研究所β-葡萄糖苷酶、纤维素酶GY42酿酒酵母(S. cerevisiae)果树研究所淀粉酶、果胶酶GY52酿酒酵母(S. cerevisiae)果树研究所淀粉酶、果胶酶GY53酿酒酵母(S. cerevisiae)果树研究所淀粉酶、果胶酶GY57酿酒酵母(S. cerevisiae)果树研究所淀粉酶、果胶酶GY58酿酒酵母(S. cerevisiae)果树研究所β-葡萄糖苷酶、果胶酶GY62酿酒酵母(S. cerevisiae)果树研究所淀粉酶、果胶酶M01葡萄汁有孢汉逊酵母(H.uvarum)玛蒂尼酒庄淀粉酶、纤维素酶M04戴尔有孢圆酵母(T. delbrueckii)玛蒂尼酒庄淀粉酶、纤维素酶M13酿酒酵母(S. cerevisiae)玛蒂尼酒庄淀粉酶、果胶酶M15美极梅奇酵母(M. pulcherrima)玛蒂尼酒庄淀粉酶、果胶酶M16戴尔有孢圆酵母(T. delbrueckii)玛蒂尼酒庄淀粉酶、果胶酶M20克鲁维毕赤氏酵母(P. kluyveri)玛蒂尼酒庄淀粉酶、果胶酶M22克鲁维毕赤氏酵母(P. kluyveri)玛蒂尼酒庄淀粉酶、纤维素酶M23酿酒酵母(S. cerevisiae)玛蒂尼酒庄淀粉酶、果胶酶M25酿酒酵母(S. cerevisiae)玛蒂尼酒庄淀粉酶、果胶酶M27酿酒酵母(S. cerevisiae)玛蒂尼酒庄淀粉酶、果胶酶M30酿酒酵母(S. cerevisiae)玛蒂尼酒庄淀粉酶、果胶酶
注:“-”表示菌种未进行分类
本试验中,分离得到了1株同时产淀粉酶、纤维素酶和果胶酶的C.zemplinina(表2),将该酵母应用于甜型低醇果酒的发酵,具有非常大的应用潜力,一方面避免了传统低醇果酒生产方法对香气成分的损失,同时该酵母产3种酶,对于提高果酒的品质和香气具有一定的潜力。
酵母分泌的胞外酶,在果酒酿造中具有提高出汁率、澄清度、过滤速度、香气物质释放、色素提取率以及香气糖苷水解等过程[10,25]。β-葡萄糖苷酶在葡萄酒增香领域的重要作用已经被许多研究所证明[26]。α-淀粉酶有利于水果原料中不溶性淀粉的水解和利用。此外,纤维素酶以及木聚糖酶等可以协同果胶酶提高果汁的出汁率。因此,参与葡萄酒酿造的酵母,尤其是NSC內源酶的种类和含量,对于提升葡萄酒的香气和品种非常重要。本实验仅对4种与葡萄酒酿造紧密相关的酶包括果胶酶、纤维素酶、淀粉酶和β-葡萄糖苷酶进行了考查。研究证实葡萄酒相关酵母还能分泌蛋白酶、木聚糖酶、酯酶、脲酶等胞外酶,上述酶对葡萄酒的风味也有一定的影响[9]。本试验并没有涉及这些酶,需要后期进行补充和进一步研究。果胶酶在果酒的酿造中应用最为成熟和广泛。目前的商用酿造酶制剂除果胶酶外,还含有一定比例的纤维素酶、木聚糖酶甚至是β-葡萄糖苷酶,上述酶组分协同作用,既能达到提高果汁出汁率和澄清的目的,也具有一定的呈香作用,是非常高效的酿造酶制剂,但这些酿造用酶多为进口商品,成本高。以上的研究结果表明,分离到的很多产酶酵母具有多种酶组分,既具有果胶酶活性,又具有纤维素酶和β-葡糖苷酶活性。开发这样的酵母作为果酒发酵剂,既能达到提高出汁率、澄清和增香的效果,又减少了酿造酶制剂的使用量,降低了葡萄酒生产成本,具有很重要的酿造学意义。
2.3 产酶酵母酿造因子耐受性分析
酿造环境条件复杂,具有低温、高糖、高酸的特点,同时发酵过程乙醇含量逐渐增高。因此,分离得到的产酶酵母是否具有一定的酿造因子耐受性和发酵能力及增香作用,需要进一步的酿造耐性和特性分析。根据产酶酵母产酶量的高低(数据未给出),本试验选择其中1株高产β-葡萄糖苷酶一种酶的SC和16株产3种酶的酵母,以活性干酵母为对照,进行酿造因子耐受性分析。
2.3.1 产酶酵母糖耐受性分析
综上所述,果农要想实现果树健康的成长,提高果实的质量。果树管理人员需要根据不同种类果树的实际情况,采取科学的修剪方式,加强对果树病虫害的防治工作。此外,在果树病虫害的防治工作当中,要积极的将绿色防治方式融入到实际的防治工作当中。不但可以有效的对病虫害进行防治,而且还有助于环保,进而提高果实的数量及产量。
表3结果表明,酵母菌的活性与培养基的糖浓度呈负相关。当糖浓度过高时,会形成较高的渗透压,导致酵母细胞失水,从而降低酵母的活性,不利于发酵。

表3 产酶酵母的糖耐受性
注:*代表将菌液稀释10倍之后所测得的OD600值
由表3可知,除J21和GY5的耐受性较差,活性干酵母和所测产酶酵母均能耐受200 g/L糖含量;当糖含量>400 g/L时,仅有活性干酵母、GY1(S.cerevisiae)、M9(T.delbrueckii)和J24(P.membranaefaciens)仍具有较高活性。以上结果说明不同种类的酵母以及相同种类的酵母,糖耐受性不同,说明酵母的耐受性存在种属间和种内差异。酿造甜型酒的果汁初始糖含量在300 g/L以上,具有较高糖耐受性的酵母适合于酿造甜型果酒。上述3种产酶酵母都具有一定的高糖耐受性,符合甜型酒酿造的要求。甜型酒酿造时,需要具有高糖耐受性的SC和NSC协同作用,因为SC在高糖环境中会上调醛脱氢酶基因的表达,代谢产生更多的乙酸,影响果酒的口感[33],NSC的作用可以降低糖度从而降低渗透压,能有效地降低SC产生的乙酸的含量[27]。另外,产酶的高糖耐受性酵母应用于甜型果酒的酿造,将会有效增加果酒中的品种香气,具有非常大的应用潜力。据报道T.delbrueckii是一种低乙酸生产菌[28],该菌与SC混菌发酵,可以降低约53%的挥发酸[29]。本试验筛选到的产酶T.delbrueckii(M9),耐高糖,同时可以产生β-葡萄糖苷酶、果胶酶、纤维素酶(表2),因此该菌应用于甜型酒的酿造,既具增香潜力,又能降低挥发酸的含量,是一株极具潜力的甜型果酒酿造用酵母。
2.3.2 产酶酵母SO2耐受性分析
不同微生物对SO2的耐受力不同,其中细菌最为敏感,其次为柠檬型酵母,SC耐受力最强,因而可使用SO2杀菌来选择发酵微生物。在葡萄酒生产过程中,添加SO2可以起到杀死杂菌,防氧化,防止葡萄酒腐败变质的作用。葡萄质量好的情况下,SO2使用量在30~100 mg/L;在葡萄质量相对较差的情况下,使用量不超过80~150 mg/L。所以,能够耐受较高含量SO2的NSC才能进行充分发酵。从表4可以看出,以活性干酵母为对照,这17株产酶酵母耐SO2能力都比较强。

表4 产酶酵母对SO2耐受性
注:(0)表示没有稀释;未标(0)的为稀释5倍的菌液所测得的OD600值
2.3.3 产酶酵母酒精耐受性分析
大多文献报道中证明NSC在发酵前期较为活跃,但发酵过程中随着乙醇含量的增加,其活性逐渐下降。由于混菌发酵有利于果酒风味物质的形成,因此筛选出耐酒精的NSC,对提升果酒品质具有重要意义。酒精浓度过高会抑制酵母菌的生长繁殖及发酵活性。所以,酵母的发酵能力在很大程度上取决于其自身对酒精耐受力的大小。由表5可知,酵母菌的活性与酒精浓度呈负相关。以活性干酵母作为对照,活性干酵母、GY5(S.cerevisiae)、GY1(S.cerevisiae)、J25(P.membranaefaciens)、 GY13(Z.bailii)、 M9(T.delbrueckii)、J23(P.membranaefaciens)、GY44(S.cerevisiae)和 J20(P.membranaefaciens)的酒精耐受性相对较高,能耐受9%的酒精度,其中GY13(Z.bailii)和M9(T.delbrueckii)的耐酒精能力最好,能耐受体积分数为15.000%的酒精。果酒的乙醇体积分数一般在11.000%~12.000%左右,仅从酒精耐受性来看,GY13(Z.bailii)和M9(T.delbrueckii)的耐酒精能力是符合要求的。据文献报道,Z.bailii、S.pombe和P.fermentants以耐酒精能力而著称,经常存在于酒厂环境中,这3种酵母可以利用苹果酸,因此可以作为降酸菌种开发[30]。T.delbrueckii具有较高的发酵力,可以作为果酒发酵的启动菌,同时该种酵母对葡萄酒的感官有积极作用[30]。本试验中分离获得的M9(T.delbrueckii)可以同时分泌β-葡萄糖苷酶、果胶酶和纤维素酶,因此综合考虑产酶特性和酒精耐性,该菌在提高葡萄酒品质和增香方面具有一定的应用潜力。
2.3.4 产酶酵母酒精耐受性分析
酵母菌在pH值为4.5~5.5时,发酵能力最强。pH很低的情况下,酵母的生长会受到抑制,并且NSC与SC混合发酵具有生物降酸的作用,有利于降低果酒的酸涩感。因此酸耐受性较强的NSC具有实际应用价值。

表5 不同酵母菌对酒精的耐受性
由表6可知,pH 3.0时,J24(P.membranaefaciens)和GY1(S.cerevisiae)依旧保持较高的活性,活性干酵母的活性有所下降;pH 2.5时,活性干酵母的活性明显下降,J24(P.membranaefaciens)和GY1(S.cerevisiae)的活性虽有下降,但仍具有较高活性。而糖耐受性和酒精耐受性较高的M9(T.delbrueckii)仅在pH 4.0时具有一定的活性,因此其对酸的耐受性低是其应用于果酒酿造工艺不利的方面。

表6 不同酵母对酸的耐受性
注:(*5)代表将菌液稀释5倍后测得的OD600值;(*10)代表将菌液稀释10倍后测得的OD600值
2.3.5 产酶酵母温度耐受性分析
由表7可见,所测产酶酵母均在20~30 ℃范围内生长情况较好。温度为15 ℃时,各酵母活性均明显下降,但仍有一定活性。因此,所测产酶酵母菌生长温度范围比较宽。果酒酿造的温度一般控制在20~28 ℃,在此温度范围内,NSC的活性都很好。此外,红葡萄酒和白葡萄酒发酵温度不同,有时为了提升葡萄酒的风味或者果酒的风味,会采取低温长时间的发酵策略,所以在低温条件下尤其在10~15 ℃范围内具有较高活性的酵母,例如本试验中的菌株M7(P.kluyveri)、J24(P.membranaefaciens)、J26(P.membranaefaciens)、M9(T.delbrueckii)、GY5(S.cerevisiae)、GY13(Z.bailii)和J21(P.membranaefaciens)在果酒酿造中也具有一定的实际应用潜力。

表7 不同酵母对温度的耐受性
注:*代表将菌液稀释10倍后测得的OD600值
3 结论
本文对昌黎4个葡萄园的土壤样品进行了产酶酵母分离,分析了其产酶酵母多样性和应用潜力,结果表明,昌黎产区产酶酵母资源丰富,富含产果胶酶、纤维素酶等多种酶的酵母。产酶酵母中SC占50%左右,其余NSC共有9类。通过产酶酵母酿造因子耐受性分析,综合产酶情况,认为菌株GY1(S.cerevisiae)、M9 (T.delbrueckii)和J24 (P.membranaefaciens)适合高糖低醇果酒酿造的产酶酵母;菌株GY13(Z.bailii)和M9 (T.delbrueckii)在酒精体积分数为15.000%时具有较强活性,是高酒精度耐受性酵母;菌株J24 (P.membranaefaciens)和GY1(S.cerevisiae)具有高酸耐受性,在pH值为2.5时仍具有较高活性;同时所测产酶酵母温度适用范围较宽,在15~30 ℃范围内均具有较高活性,其中菌株M7(P.kluyveri)、J24(P.membranaefaciens)、J26(P.membranaefaciens)、M9(T.delbrueckii)、GY5(S.cerevisiae)、GY13(Z.bailii)和J21(P.membranaefaciens)7株菌在15 ℃具有较高活性,适用于低温长期的酿造工艺。从以上结果可以看出,M9 (T.delbrueckii)同时产β-葡萄糖苷酶、果胶酶和纤维素酶,除酸耐受性较差外,具有高糖、高酒精度和低温耐受性,综合文献报道和以上结果,认为M9 (T.delbrueckii)在果酒酿造,尤其是高糖低醇果酒酿造工艺中具有很大的应用潜力。但上述酵母能否进一步应用于特定果酒的酿造工艺,以及其酿造特性及对果酒风味的影响,还需要进一步具体的实验数据分析和验证,课题组将针对上述不同特性的酵母进行具体实验,挖掘其葡萄酒增香潜力并开发应用工艺。

