顶温对特香型大曲理化指标及菌群演替的影响
陈可丹,吴晓江,陈延儒,刘婷,万茵,刘成梅,吴酬飞,付桂明*
1(食品科学与技术国家重点实验室(南昌大学),江西 南昌,330047) 2(南昌大学 食品学院,江西 南昌,330047)3(湖州师范学院 生命科学学院,浙江 湖州,313000)
大曲作为主要糖化发酵剂,被誉为酒之母、酒之骨、酒之魂,在白酒酿造过程中起着至关重要的作用[1]。各大名优白酒企业均利用环境微生物自然接种发酵制备大曲,其产区独特的地理气候环境决定了曲块上生长的微生物种类和比例,这些微生物在发酵过程中可通过代谢产生不同挥发性香味成分,从而形成不同的白酒香型。传统大曲制作工艺通常通过室温、水分、通风等环境因素来调节曲温,因此微生物受环境因素影响大,导致大曲发酵过程不稳定,质量不一致,成为制约中国白酒标准化生产的关键难题[2]。
其中,温度是影响大曲理化指标及微生物多样性的重要因素[3]。根据制作顶温的不同,大曲可分为高温(>60 ℃)、中温(50~60 ℃)和低温大曲(<50 ℃)[4]。研究发现,大曲发酵温度和制作工艺不同,可造成中、低、高温大曲之间糖化力、液化力、酯化力、发酵力相差很大[5]。刘延波等[6]对中、高温大曲进行高通量测序,研究发现高温曲中的细菌与中温曲相比,Bacillus(芽孢杆菌属)和Thermoactinomyces(高温放线菌属)显著上升,而Kroppenstedtia和Lactobacillus(乳杆菌属)显著下降。
特香型白酒是江西省独有的名优白酒,风味特点是“浓头酱尾清中间、三香俱备犹不靠”,采用中高温大曲进行酿造,其顶点温度一般在55 ℃左右。特香型大曲生产工艺是以面粉、麦麸为主要原料,其独特之处是添加一定比例的酒糟(15~20%)以提高大曲的酸度及透气性,从而利于耐酸性微生物的生长[7],另外本文高顶温曲加入了豌豆粉,以提高大曲风味层次并防止品温过高导致大曲开裂。目前关于特香型白酒大曲的研究,多集中于大曲理化指标及采用可培养手段对大曲的菌落进行分析,但未见不同顶温对特香型大曲的理化指标及微生物演替的影响报道。因此,本文通过以特香型白酒大曲为研究对象,测定其发酵过程中理化指标及菌群演替的变化规律,揭示顶温对大曲制作过程中理化指标及菌群演替的影响,为提高特香型白酒大曲的质量提供理论研究依据。
1 材料与方法
1.1 材料与试剂
样品:实验所用大曲为江西酒厂在相同环境制作的中顶温曲(BM)及高顶温曲(BH),曲醅规格28 cm×16 cm×7 cm,重量约3.4 kg。
试剂:NaOH、H2SO4、HCl、葡萄糖、3,5-二硝基水杨酸、乙酸钠、I2、KI、可溶性淀粉、三氯乙酸、Na2CO3(分析纯),国药集团化学试剂公司;福林酚(分析纯),北京索莱宝科技有限公司;冰乙酸(分析纯),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
分析电子天平(FA2004),上海舜宇恒平科学仪器有限公司;pH计(FE 28),梅特勒-托利多仪器(上海)有限公司;紫外-可见光分光光度计(SP-756P),上海光谱仪器有限公司
1.3 实验方法
1.3.1 样品采集及处理
在每个曲房的中心和两侧取等量样品,粉碎并混合均匀于4 ℃保藏,部分于-80 ℃保藏用于菌落分析。
1.3.2 大曲理化指标及水解酶系测定
定期用温度计测定大曲品温及室温。参照QB/T4 257—2011《酿酒大曲通用分析方法》[8],采用常压干燥法、电位滴定法分别测定大曲的水分含量及酸度。采用DNS比色法测定大曲中还原糖含量[9]。参照GB/T 23527—2009《蛋白酶制剂》测定酸性蛋白酶酶活力[10]。通过DNS法测定还原糖含量间接计算糖化酶活力[11]。参照沈怡方《白酒生产技术全书》测定酯化力[12]。
1.3.3 大曲菌群结构分析
将大曲样品送至上海派森诺生物科技有限公司,使用MiSeq测序仪进行2×300 bp的双端测序,并进行物种注释及丰度等分析。
2 结果与分析
2.1 大曲固态发酵过程中温度及水分含量的变化
两批大曲的温度变化均为前期逐渐上升达到最高品温,后期缓慢下降至室温的过程,并且室温的变化曲线与品温一致(图1)。BM发酵前期升温速率高于BH,于7 d达到顶温58 ℃,而BH于8 d达到顶温62 ℃。研究表明大曲前期温度上升可能是由于可溶性糖被微生物大量利用,从而大量产热所致[13]。而大曲温度逐渐达到顶温后,导致大曲中部分不耐热微生物生长受到抑制甚至死亡,使大曲菌群结构发生变化[14]。
水分含量变化均随时间的延长而下降,初始含水量在45%左右,最终含水量均保持在11%左右(图2)。发酵过程中由于微生物大量繁殖产热,曲房温度升高,尤其在顶温区,水分被大量蒸发,造成其含量急剧降低。研究表明出房时较低的水分含量有利于降低微生物的生长代谢,使得大曲易于保存[15]。同时,大曲中微生物产热能力下降,导致品温降低,发酵后期大曲的品温与室温基本一致。

a- BH;b- BM

a- BH;b- BM
2.2 Illumina MiSeq测序分析大曲固态发酵过程中微生物群落结构演变
根据OTU划分和分类地位鉴定结果,选取在属分类水平上最大相对丰度排名前20的属,生成物种相对丰度分布柱形图,如图3所示,结果显示2批大曲固态发酵过程中菌群呈现明显动态演变。

a-真菌属;b-细菌属
如图3-a所示,在BH发酵过程中,嗜热子囊菌属(Thermoascus)和假丝酵母属(Candida)为大曲发酵过程的优势菌。Candida与乙酸发酵密切相关,且在酿造中可产生乙酸乙酯等香味物质,其在BH和BM发酵前期为绝对优势菌;但后期其相对丰度均大幅下降,可能与水分或营养物质含量下降,菌丝自溶有关[16]。Thermoascus是酿酒环境的重要酶源产生菌,可促进多糖和蛋白质的降解,有利于大曲产酒生香[17],其在BH和BM发酵过程中相对丰度呈先下降、经顶温区后上升的趋势,发酵后期成为优势菌。Diutina为BH发酵前期优势菌,随温度升高生长受到抑制,可能其为不耐热菌。嗜热真菌属(Thermomyces)为BH和BM发酵后期优势菌,出现于顶温区后,BM中其相对丰度高于BH。曲霉属(Aspergillus)能产生多种蛋白酶及其他分解酶类,对大曲糖化力和生香作用均有影响,在BH发酵末期相对丰度低于BM,可能由于BH发酵过程的顶温超过Aspergillus所耐受最高温度。
从图3-b中可知,糖多孢菌属(Saccharopolyspora)、魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、放线多孢菌属(Actinopolyspora)和肠杆菌(Enterobacter)是BH和BM发酵中的优势菌。Saccharopolyspora能产生酶类和纤维素降解促进因子,是安全的生物资源菌[18],其在BM中的相对丰度高于BH,BM发酵中其相对丰度在中期上升之后下降;BH发酵过程中其在22 d成为绝对优势菌而后下降。Lactobacillus、Weissella、Pediococcus作为乳酸菌,被认为是白酒发酵过程中重要的产风味菌属,可代谢产生乳酸、乙酸等有机酸,为白酒中风味物质的形成提供前体[19]。Weissella在BM发酵前期的相对丰度高于BH。在1~4 d时,BM发酵过程中Pediococcus的相对丰度明显升高,而在BH中其相对丰度仅为1.1~3.6%。进入顶温区之后,Weissella和Pediococcus受热失活,因此相对丰度有一定的降低。Lactobacillus在BH中相对丰度远高于BM。由于乳酸菌具有一定耐热性,在进入顶温区之后,其失活速度低于其他不耐热菌,因此在BH中其相对丰度仍高于BM。同时Enterobacter在BH中相对丰度低于BM,且经过顶温区后均下降,这与Enterobacter耐高温性能较低有关。
2.3 大曲固态发酵过程中酸度及还原糖的变化
如图4所示,BH的酸度在发酵前2 d迅速上升,可能是由于产酸细菌(如Lactobacillus)代谢旺盛(图3-b)[20]。初始酸度BH高于BM,但BH的酸度下降缓慢,说明起始产酸微生物具有一定的耐热性。而BM的酸度下降迅速,可能是由于前期温度上升至超过产酸细菌的耐热温度,与Weissella、Lactobacillus、Pediococcus相对丰度的变化相符(图3)。然而,在发酵7~24 d BH的酸度要高于BM,可能是由于发酵中期较高品温抑制其他微生物生长,且耐热芽孢杆菌(Bacillus)仅在BH此阶段出现,可代谢产生有机酸。后期酸度的下降可能是由于有机酸降解或与醇反应生成酯类等。

a- BH;b- BM
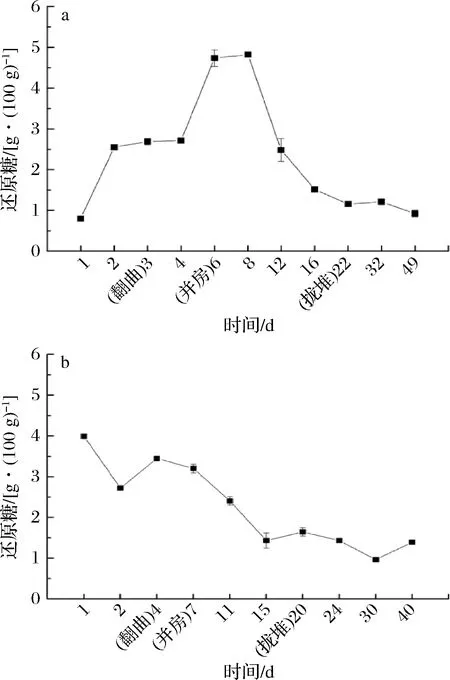
a- BH;b- BM
大曲中还原糖含量均处于动态变化的过程(图5),可能是因为微生物生长以还原糖作为营养物质的同时,代谢产淀粉酶、糖化酶降解原料中的淀粉等物质生成还原糖[21]。初始还原糖含量BH低于BM,且BH在发酵前8 d呈上升趋势,可能是由于仅在BH原料中添加的豌豆粉含有丰富的糖化酶,且从图5可知BH糖化酶活力在4~6 d上升,同时其还原糖含量再次急剧升高。而BM还原糖含量呈下降趋势,可能是由于温度迅速上升,糖化酶活力下降,微生物的消耗速率大于其降解产还原糖的速率。进入顶温区后,BH和BM的还原糖含量急剧下降,可能是糖化酶活力均处于较低水平及微生物生长大量消耗。
2.4 大曲固态发酵过程中酸性蛋白酶活力、糖化力及酯化力的变化
白酒发酵在酸性环境下进行,许多香味物质来自蛋白质的分解产物及美拉德反应,所以酸性蛋白酶对白酒风味的形成具有直接影响[15]。如图6-a、6-b所示,BH酸性蛋白酶活性在1~4 d上升,而BM酸性蛋白酶活力只在1~2 d上升,且BM下降速率要高于BH。这可能是由于大曲发酵前期BH和BM中Lactobacillus和Weissella的丰度均较高(图3-b),产酸能力较高,故保持较高酶活。但随着大曲发酵,产酸细菌逐渐减少,BM中变化尤为明显,从而造成BM中酶活更快地下降。经过顶温区后,大部分微生物生长受到抑制,BH和BM的酸性蛋白酶活力趋于平稳。Aspergillusniger、Monascus和Aspergillusoryzae是代谢产酸性蛋白酶的重要微生物[22]。出房时BM和BH的蛋白酶活力分别控制在33和23 U/g,且BM中Aspergillus的丰度明显高于BH。这些结果说明Aspergillus可能是导致BM发酵后期酸性蛋白酶活性更高的原因。

a- BH;b- BM;c- BH;d- BM;e- BH;f- BM
大曲中糖化力的变化是由小麦本身糖化酶活力的破坏和微生物糖化酶的生成共同作用[23]。如图6-c, 6-d所示,大曲起始较高的糖化酶活力主要来自于大曲原料小麦等,之后在发酵过程被破坏,失活程度大于微生物代谢生成量。BH糖化力在3~6 d急剧上升,可能是由于此阶段还未到高温期,且大曲原料中的淀粉不能被大多数酵母和细菌直接利用,因此需通过丝状真菌产生的α-淀粉酶和葡糖淀粉酶将其水解为可发酵的糖[24],如Monascus在BH此发酵阶段相对丰度从0.1%上升至0.5%,其作为糖化菌能利用各种糖类。BM由于前期温度上升较快及微生物的消耗,糖化酶活力下降,BM在7~15 d高品温区后糖化酶活力下降缓慢,而BH经过8~16 d高品温区后糖化酶活力下降较多,可能由于高品温使霉菌生长代谢受到抑制,产糖化酶的量减少,且糖化酶活性的耐热性不强[25],活力受到抑制。有研究表明,根毛霉(Rhizomucor)和Aspergillus是大曲中淀粉酶、葡糖淀粉酶和纤维素酶的主要生产者[21]。而Rhizomucor和Aspergillus在BM中相对丰度高于BH(图3),因此造成BM发酵后期糖化力高于BH的现象。且BM在发酵后期,还原糖含量有明显的上升,可能与其糖化力较高有关。
酯化力是反应大曲生香能力的重要指标,是指酸和醇结合,脱去1个水分子形成酯的能力[26]。酯化力主要由大曲中霉菌、酵母生成,发酵前期它们大量生长繁殖并启动代谢酯化酶[27],从图6可知,BH和BM在高品温区时,代谢酯化酶达到高峰并催化酯化反应,促进香味物质的积累。研究发现Candida在酱香型大曲中不仅具有醇类发酵的作用,且其丰度也与酯酶的含量呈正相关[28]。Candida是BM和BH发酵前期优势真菌,对特香型大曲的酯化力可产生较大影响。经过高品温区后,随着Candida丰度下降,大曲的酯化力下降。同样,有研究表明,Rhizomucor和Thermomyces在不同大曲中对酯类物质的增加具有重要的作用[2, 28]。而图6-e、6-f显示出房时BM酯化力高于BH,这可能是由于发酵后期BM中Rhizomucor和Thermomyces的相对丰度高于BH(图3-a)。
3 结论
大曲在白酒酿造中具有提供微生物来源,糖化发酵、投粮及生香作用。品温被认为是评估大曲固态发酵过程的关键环境变量之一。Illumina MiSeq测序结果表明,2批大曲发酵过程中优势菌相似但动态变化存在明显差异。同时发现由于顶温的不同,大曲理化指标的变化趋势也存在部分差异。该文通过研究不同顶温对大曲微生物群落及理化指标的影响,有利于酒曲功能微生物的筛选与其在特香型白酒中的高效利用,对提高酒曲生产质量及特香型白酒的酿造控制具有良好的理论指导,在一定程度上推动特香型白酒行业的发展。

