霉菌发酵剂对干发酵香肠的理化指标、氧化程度及风味的影响
蔡嘉铭,王际辉,陶冶,肖珊,刘冰南,王亮
(大连工业大学 生物工程学院,辽宁 大连,116034)
传统干发酵香肠主要以自然发酵为主,存在很多食品安全隐患,具有较大的不可控性。将微生物进行纯培养作为发酵剂用于香肠的发酵,避免了许多不可控性,在很大程度上提高了食品安全性。微生物作为肉制品发酵剂已被广泛应用,其中酵母菌和乳酸菌为最常用发酵剂[1],酵母菌可以促进发酵肉制品颜色及风味的形成,抑制产品酸败,加速发酵香肠中脂肪和蛋白质的降解,缩短发酵时间而提高产品品质[2]。乳酸菌独特的产酸性能可以降低肉制品中的pH,对发酵肉制品中的腐败菌有抑制作用,同时产生乙酸和乳酸等挥发性风味物质,能够改善风味[3]。而霉菌广泛作用于干腌火腿、奶酪、豆酱等食品加工与发酵过程中,起到极强的发酵作用。从干腌火腿中筛选的霉菌通常具有高酶活、抑菌等特点,对于干腌火腿特征性风味物质形成及品质形成等具有较大的作用[4]。另外因霉菌的大量存在起到隔氧的作用, 可防止产品酸败[5]。国外的干发酵香肠,例如意大利色拉米、匈牙利色拉米的制备过程中都要有霉菌参与,可使产品具有特殊的气味与外观[6]。目前国内对于霉菌作为单发酵剂的研究极少,但霉菌对于食品发酵起到的重要作用值得探究与应用。
本文通过将干腌火腿中分离的高酶活无毒霉菌作为发酵剂接种于干发酵香肠中,通过对干发酵香肠理化指标、氧化程度以及风味进行测定,探究霉菌对干发酵香肠的发酵作用。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种
枝孢菌(Cladosporiumcladosporioides)P27从发酵成熟16个月的宣威火腿中筛选得来,具有较高的脂肪酶和蛋白酶活力,而且不产毒素,菌株通过固体培养后洗涤孢子悬液以备使用。
1.1.2 主要实验试剂
三氯乙酸、TBA、EGTA、焦磷酸钠、DNPH、乙酸乙酯、盐酸胍、KH2PO4等,国药化学试剂有限公司;盐酸、乙醇,北京化工厂。
1.2 主要仪器与设备
DNP-9082恒温培养箱,上海精密实验设备有限公司;Agilent 7890A型气相、5975C型质谱联用仪,美国安捷伦科技有限公司; H2050R-1高速冷冻离心机,湖南湘仪实验仪器开发有限公司;U-5100分光光度计,日立公司;TA-XT plus质构仪,美国Stable Micro System公司。
1.3 实验方法
1.3.1 干发酵香肠制作工艺
原料为绞碎的猪肉(肥瘦质量比2∶8)100 g,加入食盐2.8 g、糖1 g、白酒2 g、胡椒粉0.1 g、五香粉0.05 g、花椒粉0.05 g,搅拌均匀后加入枝孢菌孢子悬液,使最终浓度为106CFU/g,空白组不添加孢子悬液。4 ℃下将肉馅腌制10 h,洗涤肠衣后灌肠,25 ℃风干发酵。
1.3.2 干发酵香肠发酵过程中理化指标分析
选取发酵第0、5、10、20、30天干发酵香肠,每次取样4根,用于指标的测定。
1.3.2.1 pH值测定
按照GB 5009.237—2016《食品pH值的测定》规定的方法进行测定[7]。
1.3.2.2 水分活度测定
将干发酵香肠剪碎,铺满测试杯底,用水分活度仪测定其水分活度。
1.3.2.3 细菌总数的测定
在超净台中切取9 g干发酵香肠,用无菌剪刀剪碎加入到90 mL无菌生理盐水中,37 ℃摇瓶30 min得到干发酵香肠悬浊液,将悬浊液进行适当的稀释,吸取1 mL稀释液于PCA固体培养基中涂布,48 h后计数[8]。
1.3.2.4 质构的测定
将质构仪进行校正,设置参数,将香肠样品放于平台中心位置开始测定。测定参数如下:测前速度为2 mm/s,测试速度为1 mm/s,位移为10 mm,测试后速度为1 mm/s,负载类型为auto-5 g,下压距离为样品高度的50%,高度校正返回距离为30 mm,返回速度为15 mm/s,接触力为5 g,探头类型为P/50,数据收集率为200 pps,环境温度为室温。
1.3.3 干发酵香肠发酵过程中脂肪氧化程度的测定(TBARS)
参考MARCOS等[9]方法。将2.5 g剪碎的肉样加入20 mL超纯水,用IKA均浆器在均质3 min。取预冷的5 mL 250 g/L TCA溶液加入均质液中,在10 000×g、4 ℃条件下离心15 min,吸取上清液3.5 mL,加入1.5 mL 0.6%的TBA溶液,在4 ℃条件下搅拌15 min,之后在(70±2)℃条件下水浴30 min,冷却后在532 nm波长处测定吸光度。2.5 mL超纯水加1 mL 250 g/L TCA溶液和1.5 mL 6.0 g/L TBA溶液作空白。采用TEP作为标准液,通过标准曲线计算得到样品中丙二醛的含量。
1.3.4 干发酵香肠发酵过程中蛋白质氧化的测定
1.3.4.1 蛋白质含量的测定
根据GB 5009.5—2016《食品中蛋白质的测定》测定肉样的蛋白质浓度(c)[10]。
1.3.4.2 羰基含量的测定
参考LUND等[11]的方法对肉样进行处理,得到样品的吸光度和相应空白的吸光度,按公式(1)计算羰基含量:

(1)
式中:A1,样品的吸光度;A0,空白的吸光度;c,蛋白质质量浓度,mg/mL。
1.3.5 挥发性物质的测定
通过固相微萃取结合气质联用技术对挥发性物质进行分析,利用DVE/CAR/PDMS材质萃取头萃取风味物质,在250 ℃进样口解析5 min。采用石英毛细柱(100 m×0.25 mm×0.2 μm);升温程序:初始温度40 ℃保持3 min,以3 ℃/min升至180 ℃,然后以10 ℃/min升至250 ℃。进样方式:不分流进样。质谱条件:离子源温度:230 ℃;接口温度:230 ℃;电离方式EI;电子能量70 eV;质量扫描范围:40~300 amu。挥发性化合物的鉴定:将挥发性化合物的质谱信息与N1ST11质谱数据库中标准化合物的质谱信息进行对比,以85%以上的匹配度确定化合物的名称[12]。
1.4 数据处理与分析
每个样品至少重复测定3次,采用Excel 2010进行数据处理,结果表示为平均数±标准偏差,用Origin 2017绘图,通过SPSS 17.0软件对数据进行方差显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 干发酵香肠发酵过程中理化指标的变化
在发酵的第0、5、10、20、30天取样,测定干发酵香肠的理化指标。由表1所示,随着发酵时间的增加,pH和水分活度逐步下降,空白组与接菌组香肠的pH及水分活度差异不显著,接菌组的水分活度略低于空白组。
由表1可知,随着发酵时间的增加,细菌总数呈现直线上升的趋势,而接菌组干发酵香肠在每个阶段中细菌总数均少于空白组,说明枝孢菌作为优势菌群可能会产生某些活性物质抑制了杂菌的生长,从而减缓了干发酵香肠的腐败过程。
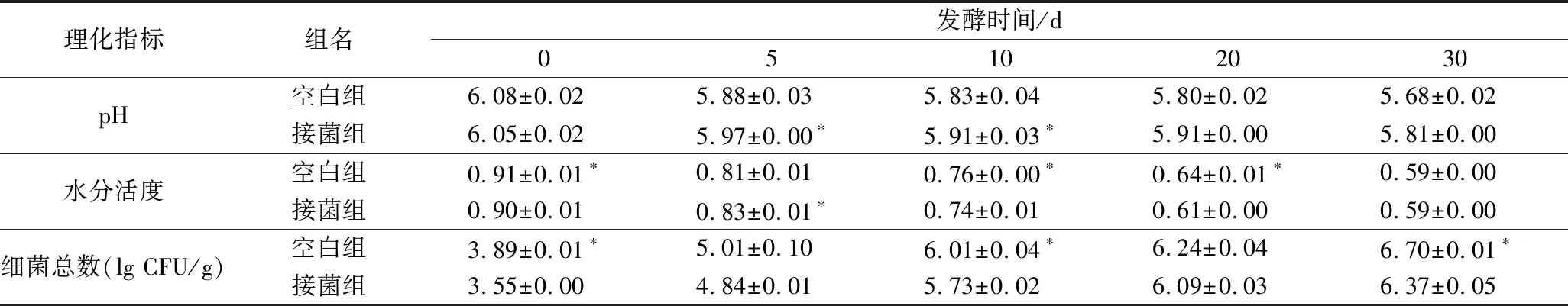
表1 不同发酵阶段空白组与接菌组干发酵香肠的理化指标变化
注:数据为均值±标准差;在相同指标同一列中,在右上方标记“*”表示差异显著(P<0.05)(下同)
2.2 干发酵香肠发酵过程中质构的变化
目前,发酵香肠生产中的一个重要问题是产品口感较干导致香肠难以咀嚼,因此发酵香肠的硬度、弹性和咀嚼性等作为考核指标,综合评价发酵香肠的品质[13]。
由表2可知,随着发酵时间的延长空白组的硬度、咀嚼性和胶着性呈先增高后降低的趋势,接菌组硬度、咀嚼性和胶着性呈上升趋势,两组的弹性值呈现先增高后降低的趋势,这是因为发酵时间增加导致香肠水分蒸发,香肠变干,同时微生物的作用使香肠的质构发生明显地变化。

表2 不同发酵阶段空白组与接菌组干发酵香肠质构的变化
发酵前期,枝孢菌在生长阶段,各指标差异不显著。发酵后期,空白组香肠的硬度、咀嚼性、胶着性显著高于接菌组,而弹性略低于接菌组香肠,两组的黏聚性与回复性差异不显著。综合而言,空白组香肠肉质过硬且难以咀嚼,而枝孢菌作为发酵剂使干发酵香肠硬度与咀嚼度降低,弹性增高,从而提高口感,因此接入枝孢菌作为发酵剂可在一定程度上改善干发酵香肠的质构。
2.3 干发酵香肠发酵过程中脂肪氧化程度的变化
采用硫代巴比妥酸反应法(thiobarbituric acid ractive substance, TBARS)值测定原理是根据食品中不饱和脂肪酸氧化分解而产生丙二醛,利用丙二醛含量对脂肪氧化的程度进行评价[14]。脂质氧化是干发酵香肠在发酵过程中形成特征风味的主要途径,脂质氢过氧化物进一步氧化或降解产生的挥发性化合物是形成风味的主要物质,但过度氧化的脂质易于产生酸败味和哈喇味等不愉快的气味。因此,控制脂质氧化程度对于产品的风味形成至关重要[15]。
由图1可以看出,随着发酵时间的延长,丙二醛含量逐步增加,这是由于发酵时间越长,香肠的脂肪氧化程度增强,生成了大量的挥发性成分,因此导致丙二醛含量增加[16]。其次,在每个发酵阶段接菌组的丙二醛含量显著低于空白组,说明枝孢菌P27可以减缓香肠的脂肪氧化,起到一定的抗氧化作用。
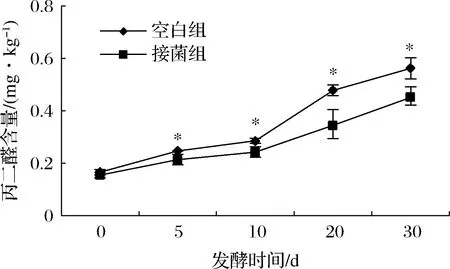
图1 不同发酵阶段空白组与接菌组干发酵香肠的脂肪氧化程度
2.4 干发酵香肠发酵过程中蛋白质氧化程度的变化
蛋白质氧化的主要产物之一为羰基化合物,可利用羰基含量表示蛋白质氧化的程度,羰基含量越高,蛋白质氧化程度越高[17]。发酵过程中蛋白质氧化反应的发生会影响肉制品的品质,同时一些必需氨基酸被氧化破坏后导致肉制品营养价值降低,羰基化合物与非氧化赖氨酸的游离氨基反应形成亚胺键,导致聚集体的形成,降低蛋白质消化率[18]。
由图2可以看出,随着发酵时间的延长,羰基含量呈现逐渐上升的趋势,在每一个发酵阶段,接菌组的蛋白质氧化程度均低于空白组,枝孢菌P27减缓了香肠的蛋白质氧化,发酵中后期作用更加显著。蛋白质氧化的变化趋势与脂肪氧化的变化趋势相一致,说明枝孢菌具有一定的抗氧化功能,可以减缓香肠的氧化程度。

图2 不同发酵阶段空白组与接菌组干发酵香肠的蛋白质氧化程度
2.5 干发酵香肠挥发性物质的变化
发酵香肠的风味物质主要包括醛类、酮类、酯类、酸类和萜类等[19],这些物质混合形成香肠的特有风味,它们主要来源于香肠制作过程中所添加的香料及香肠发酵过程中碳水化合物代谢、蛋白质水解、脂肪水解和氧化过程[20]。本文通过气质联用仪分析发酵30 d后干发酵香肠挥发性物质的组成及变化情况,接菌组与空白组共检测到23种化合物,主要的风味化合物为醇类、酯类、醛类、酚类和萜类。
发酵肉制品中酯类化合物的产生与底物(醇类与酸类)水平以及微生物的酯酶活性有关[21],酯类具有水果香味和花香,并且它们的香气阈值较低,对干发酵香肠的整体风味起到极其重要的作用[22]。由表3可知,酯类物质含量最高,共包括11种物质,接菌组干发酵香肠酯类物质含量明显高于未接菌组。乙酯类化合物在酯类化合物中最为丰富,如乙酸乙酯、丁酸乙酯和己酸乙酯等,都是源于微生物的酯化作用[23]。乙酸乙酯呈现清香、微带果香的酒香,丁酸乙酯和3-甲基丁酸乙酯具有甜果香,有菠萝、香蕉、苹果芳香,己酸乙酯具有曲香、菠萝香型的香气,可用于配制烟草香精以及曲酒调香[24-25]。接菌组产生特有酯类风味物质为苯丙酸乙酯和2-甲基丁酸乙酯,而3-苯丙酸乙酯会呈现甜的水果或蜂蜜的花香香气,2-甲基丁酸乙酯为水果型香精,两者均已规定为可使用的食品用香料[26]。空白组产生的辛酸乙酯具有酒香,可能来源于制作中添加的白酒物质,也可能来源于自然菌群发酵。
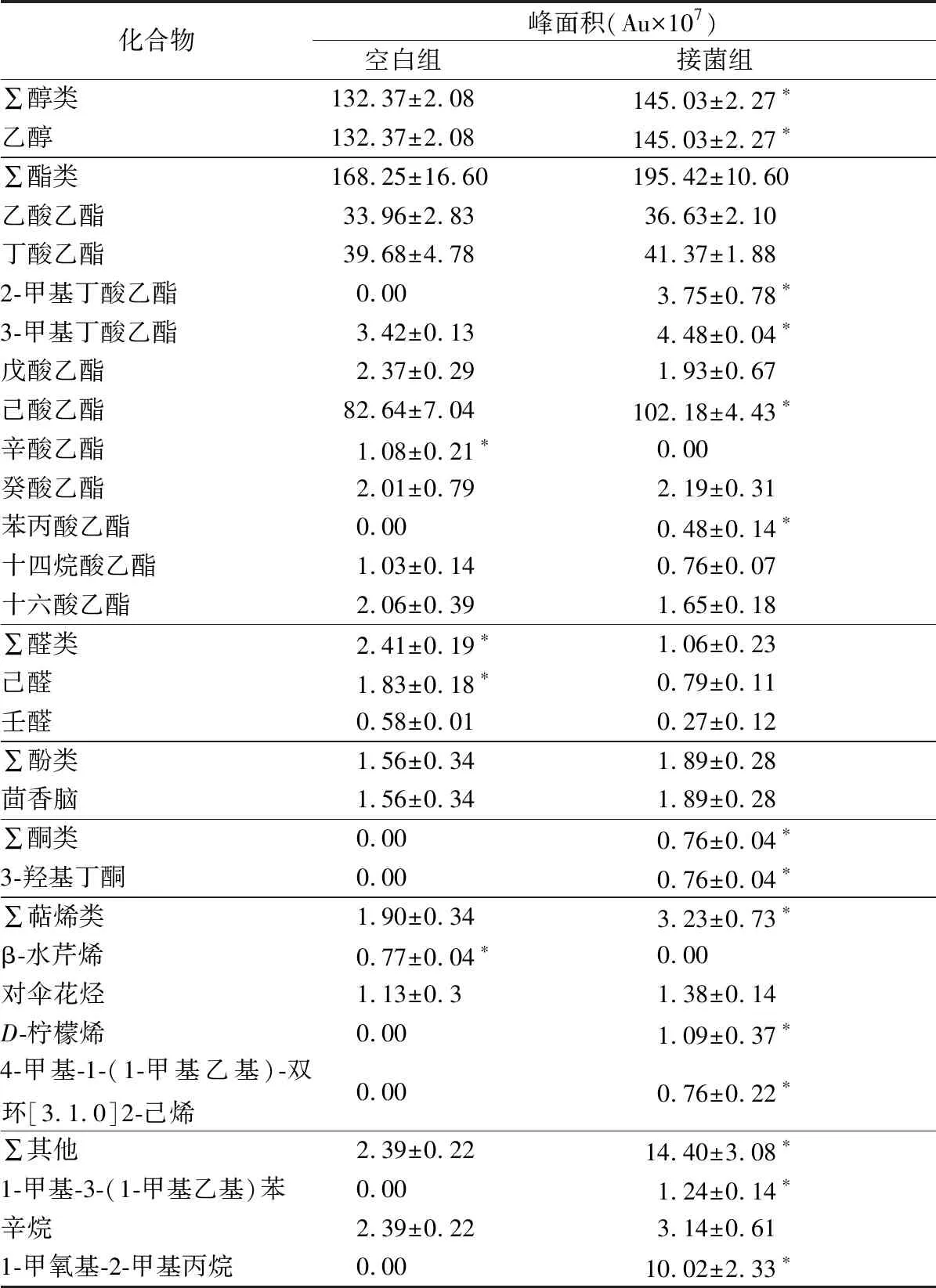
表3 发酵30 d的空白组与接菌组干发酵香肠的风味物质含量
醇类物质主要来源为香肠配料中的白酒,尽管研究认为醇类物质对香肠的风味贡献较小[27],但它在微生物的作用下可以产生酯类物质[28],因此醇类也是必不可少的风味物质。
醛类化合物是肉制品风味成分中十分重要的风味物质,主要来源于脂肪氧化,其风味阈值较低,对肉制品的风味贡献较大[29],但过度的脂肪氧化容易产生不愉快气味。由于接菌组的氧化程度低于空白组,通过表3中可看出枝孢菌降低了干发酵香肠中醛类物质的含量。
在接菌组干发酵香肠中检测到的少量萜类化合物如β-水芹烯、对伞花烃和D-柠檬烯,均在食品香料领域有所应用[30]。此外,接菌组检测到多种独特的风味物质,其中3-羟基丁酮具有特有的奶油香味,自然存在于玉米、奶酪和肉制品中,多用于干酪、咖啡、坚果的香味增强剂,同时也可用于配制奶油、乳品、酸乳和草莓型香精等[31]。
总体而言,枝孢菌使干发酵香肠中“有益”风味物质含量增高,并且产生了特有的风味物质使干发酵香肠风味更丰富,提高干发酵香肠的风味品质。
3 结论
接种枝孢菌后抑制了干发酵香肠杂菌的生长,改善了香肠的质构,且可显著降低干发酵香肠脂肪和蛋白质氧化的程度。干发酵香肠的主要挥发性风味物质为酯类和醇类,接菌后增加了干发酵香肠酯类、醇类和烷类物质等含量,使得干发酵香肠的风味物质更加丰富。综上所述,枝孢菌的接入起到了防腐抗氧化的作用,可以在一定程度上丰富香肠的风味,未来可作为发酵剂用于干发酵香肠的生产中。

