高浓度糖皮质激素对垂体-肾上腺轴的影响
邓 琼, 梁 辉, 张建文, 朱婉蓉, 杜 野, 应 晶
(南方医科大学 附属深圳市龙华区人民医院,广东 深圳 518109)
糖皮质激素由肾上腺皮质分泌,生理作用广泛,可调节物质、水盐代谢,影响器官系统的功能作用,增强应激抵抗力,同时,糖皮质激素在药理剂量下还具有抗炎、抗休克和免疫抑制作用[1-4]。大脑皮层接受应激信号后激活下丘脑-垂体-肾上腺轴。首先,下丘脑分泌血管升压素(Arg-Vasopressin,AVP)和促肾上腺皮质激素释放激素(Corticotropin releasing hormone,CRH)进入垂体的门静脉循坏,AVP与CRH通过结合垂体促肾上腺皮质激素(Adreno-Cortico-Tropic-Hormone,ACTH)细胞膜上的受体,激活相应的信号通路,刺激细胞分泌ACTH。最后,ACTH作用于肾上腺皮质部分,促进糖皮质激素的合成和分泌。糖皮质激素通过与细胞内的受体(Glucocorticoid Receptor,GR)结合发挥作用,对机体适应应激和维持正常的代谢活性极其重要[5]。糖皮质激素的分泌遵循昼夜节律,在睡眠或安静时分泌水平低一些。在昼夜节律下,糖皮质激素还遵循1h/脉冲的超日节律[6]。应激时糖皮质激素分泌快速上升至应激水平,回落的时间取决于刺激的强度和维持的时间。在应激条件下糖皮质激素分泌快速增加的这种模式的对于机体适应应激和维持内环境的稳态极其重要,这种模式受到影响将会引起代谢,行为,繁殖,免疫和心脑血管等系统的紊乱。
2010年Lightman等提出糖皮质激素对CRH刺激引起的ACTH分泌的快速抑制作用是介导糖皮质激素分泌超日节律的生成机制的一部分[7,8]。早在1990年,Engler等研究发现,断开羊的下丘脑和垂体并不影响皮质醇分泌的超日节律[9]。最近,Lightman等研究发现持续给大鼠灌注低剂量的CRH诱导皮质酮的脉冲式分泌[10]。这些研究结果表明了垂体可直接调控肾上腺分泌糖皮质激素,不受下丘脑的控制。
库欣综合症,也称为皮质醇增多症,最早由Harvey Cushing医生于1912年报道。库欣综合征是内分泌学中的经典综合征,这种疾病多是由垂体皮质营养腺瘤过度分泌ACTH导致皮质醇分泌过多引起的[11]。它是一种罕见的疾病,如果没有有效的治疗,会导致高死亡率和发病率。内源性的糖皮质激素浓度过高大部分是由于分泌ACTH的垂体促肾上腺皮质激素腺瘤,也有较少是由于异位ACTH分泌的神经内分泌肿瘤或ACTH非依赖性肾上腺皮质醇分泌过多[12]。过高的糖皮质激素对糖皮质激素的分泌和生理功能的影响,以及具体的机制仍然不是十分明确。鉴于此,我们设计实验,通过体外培养垂体细胞,建立灌注系统模拟体内垂体生理环境,研究不同浓度糖皮质激素条件对糖皮质激素快速反馈的作用,并阐明和补充糖皮质激素快速反馈的分子机制。本研究对了解慢性应激和高循环糖皮质激素引起的疾病中HPA轴的调节作用具有重要意义,也有助于进一步阐明糖皮质激素反馈的分子机制,并为临床治疗库欣综合征提供理论依据。
1 材料与方法
1.1 材料与试剂
本研究中所用的实验动物雄性Sprague Dawley(SD)大鼠来源于广东省医学实验动物中心(佛山,广东)。本研究项目经深圳市龙华区人民医院动物伦理委员会审核批准。细胞培养试剂和材料分别购自Gibco(Thermo Fisher,USA)和Corning(NY,USA),原代垂体细胞分离培养的试剂购自Sigma Aldrich(USA)。
1.2 垂体细胞的分离培养
垂体细胞的分离培养方法沿袭于已发表的论文[13,14]。简而言之,研究所用雄性SD大鼠(250±25g),到达SPF级饲养间后自由采食,稳定饲养5天以上。实验大鼠以CO2麻醉昏迷,断颈法处死后立即打开颅腔取垂体组织。将组织在PBS清洗两次,清除血块后将组织剪成大小为1mm3的小块。PBS清洗一次后,加胰蛋白酶在37℃水浴锅中来回震荡15min,加DNase置于冰上以沉降组织块,去除上清液后加胰蛋白酶抑制剂37℃水浴锅中来回震荡10min终止消化,而后分别以2mM和1mM EDTA溶液孵育洗涤组织。用吸管将组织转移至15ml的离心管中,来回反复轻轻吹打至混浊,置于冰中1min后吸上清液至80目细胞筛过滤,反复重复吹打细胞,直至将组织块消化完全。1000rpm离心10min收集细胞,重悬细胞后将以细胞培养基将细胞稀释至1.5×106个/ml,加入Cytodex珠子。37℃,5%CO2细胞培养箱中稳定培养2h,后加入马血清及双抗。
1.3 垂体细胞灌注
将稳定培养48~72h的垂体细胞转移至灌注系统中,以37℃预热的含0.1%BSA的无血清培养基将细胞平衡2h或6h,设置转速为0.25ml/min,每5min收集的1.25ml培养液作为一个样品。在CRH给药刺激前,收集6个样品作为基础水平参照。将细胞灌注液转换成含激素(CRH、皮质酮或抑制剂)的培养液,并标注给药的时间区间和对应的样品管号。以ACTH化学发光ELISA试剂盒(Phoenix Pharmaceutical,INC.CEK-001-21)测定样品中ACTH的浓度。
1.4 蛋白免疫印迹
小鼠垂体瘤细胞系AtT20购自ATCC Global Bio-resource Center(ATCC,编号为CRL-1795)。细胞培养基为DMEM(GlutaMAX-1,Gibco),添加10%胎牛血清,MEM非必需氨基酸和双抗。细胞培养板预先以多聚赖氨酸包被。细胞长满培养板的80%~85%时更换活性木炭剥离血清培养基过夜,次日换0.1%BSA培养2h或6h,以皮质酮刺激30min,收集细胞,按照试剂盒说明书提取细胞膜、细胞质和细胞核蛋白。检测GR的抗体来源于Santa Cruz Biotechnology(H-300,1∶1000),各组分蛋白的持家蛋白分别为GAPDH(细胞质,V-18,Santa Cruz Biotechnology,1∶1000),Pan Cadherin(细胞膜,Abcam,1∶5000)和HDAC1(细胞核,C-19,Santa Cruz Biotechnology,1∶1000)。
1.5 数据统计分析
采用软件SigmaPlot 15.0进行数据统计分析,数据以平均值±标准差表示,组间差异性检验采用One way ANOVA分析。显著性差异设置为P<0.05。
2 结果
2.1 CRH刺激对ACTH分泌的作用
为研究糖皮质激素的反馈作用,我们需建立稳定的ACTH分泌体系。与已发表文献所描述一致[12],如图1A所示,垂体细胞接受浓度递增(30pM,100pM,300pM,1nM,3nM)的5min CRH脉冲刺激,30pM和100pM CRH刺激引起ACTH分泌的显著增加。更高浓度的CRH则促进ACTH的分泌量更大幅度地提高,这些数据显示CRH以剂量依赖的方式刺激ACTH的分泌。
细胞在受持续的CRH刺激之前接受5min的CRH脉冲刺激。100pM CRH给药刺激快速引起ACTH分泌增加,当持续给药刺激后,ACTH分泌随时间推进出现了逐渐下降的趋势(图1B)。10pM CRH刺激则不能引起ACTH分泌的升高(图1C)。30pM的CRH能够诱导持续稳定的ACTH分泌(图1D)。因此,我们采用30pM CRH建立垂体细胞ACTH稳定分泌体系。
2.2 皮质酮在2小时和6小时平衡灌注后对CRH刺激引起的ACTH分泌的作用
灌注系统中的垂体细胞接受CRH刺激前以含0.3%BSA的M199培养基预先孵育2h或6h。孵育2h后,100nM的皮质酮似乎有抑制ACTH分泌的趋势,统计结果显示,与皮质酮添加前的ACTH分泌均值相比,100nM皮质酮无法显著抑制ACTH分泌(n=3,P>0.05),更高浓度的皮质酮,1μM对CRH刺激引起ACTH稳定分泌产生了显著的抑制(图2B)。数据统计结果表明ACTH的分泌在添加1μM的皮质酮25min后才开始出现显著性的抑制(n=3,P<0.05)。

图1 垂体细胞灌注系统中不同剂量CRH对ACTH分泌的作用Figure 1 CRH-stimulated ACTH secretion in Pituitary Cell PerfusionA.ACTH对不同剂量CRH给药刺激的反应;B.100pM CRH对ACTH分泌的影响;C.10pM CRH对ACTH分泌的影响;D.30pM CRH刺激引起ACTH稳定分泌黑色实心长条状(图B,C和D)代表CRH给药刺激的时间区间A.Effect of different doses of CRH on ACTH secretion;B.ACTH secretion stimulated by 100pM CRH;C.ACTH secretion stimulated by 10pM CRH;D.30pM CRH induced constant ACTH secretion.The long black solid bars in figure B,C and D represent the period of CRH administration.

图2 皮质酮对CRH刺激引起的ACTH分泌的影响Figure 2 The inhibitory effect of corticosterone on ACTH secretion after 2h preincubationA.100nM皮质酮;B.1μM皮质酮黑色实心长条状代表CRH给药刺激的时间区间,虚线空心长条状代表皮质酮给药刺激的时间区间,对照组取皮质酮给药刺激前CRH刺激引起的ACTH分泌值A.100nM corticosterone; B.1μM corticosteroneThe long black solid bars represent the period of CRH administration,and the dotted hollow strips represent corticosterone infusion.The control was set as the ACTH secretion by CRH prior corticosterone administration.
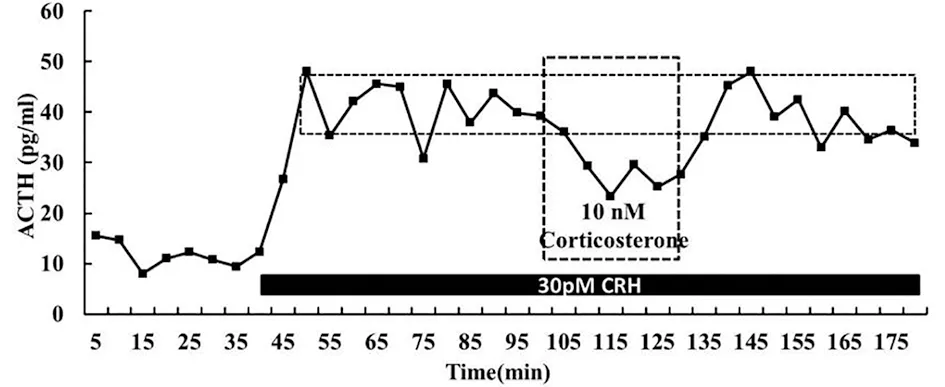
图3 6h清除后基础水平的皮质酮(10nM)对CRH刺激引起的ACTH分泌的影响Figure 3 The inhibitory effect of corticosterone on ACTH secretion stimulated by CRH following 6h clearance.10nM corticosterone rapidly prevented CRH-stimulated ACTH secretion.黑色实心长条状代表CRH给药刺激的时间区间,虚线空心长条状代表皮质酮给药刺激的时间区间The long black solid bars represent the period of CRH administration,and the dotted hollow strips represent corticosterone infusion.
与之对应的是,孵育6h后,10nM皮质酮能抑制CRH刺激引起的ACTH分泌(图3)。在预先孵育6h后,皮质酮给药刺激5min后显著抑制ACTH分泌(n=5,P<0.05),终止给药刺激5min后ACTH分泌恢复至给药前分泌水平(n=5,P<0.05)。以上研究结果表明,糖皮质激素的快速反馈敏感程度与给药刺激前的无血清培养液孵育时间有极强的相关性。
2.3 预孵育2h或6h的细胞中GR的表达水平
采用放射免疫学法测定预孵育2h或6h后细胞培养液中的糖皮质激素浓度(细胞在皮质酮(30分钟,10nM)给药以无血清培养基孵育2h或6h),并以蛋白免疫印迹检测GR的表达。结果显示,孵育2h后培养基中的皮质醇含量为19.3nM,而6h后为7.2nM。蛋白免疫印迹结果显示,基础生理水平下6h组细胞的细胞膜蛋白中GR的表达与2h组相比要稍低一些(图4A),且皮质酮刺激引起了细胞膜蛋白中GR表达的显著增加(P<0.05,图4B),在2h组中未见显著变化。细胞核蛋白中两组GR的表达水平以及在皮质酮刺激后的改变趋势基本一致(图4C)。
2.4 皮质酮的抑制作用是非基因组作用
为进一步确定皮质酮的抑制作用是非基因组作用,在垂体细胞灌注系统中添加转录抑制剂放线菌酮D和蛋白翻译抑制剂嘌呤霉素,研究二者对皮质酮快速抑制作用的影响。
研究结果显示(图5),放线菌酮D给药组和嘌呤霉素给药组与对照组相比,两组的ACTH分泌模式均未出现明显改变,放线菌酮D及嘌呤霉素对皮质酮的CRH刺激引起的ACTH分泌的抑制作用没有显著性影响。这些数据表明,皮质酮对ACTH分泌的抑制作用是非基因组作用。

图4 预孵育2h或6h后皮质酮对GR表达水平的影响Figure 4 The effect of corticosterone on GR expression after 2h or 6h pre-incubation.Cells were incubated with serum free medium for 2h or 6h as indicated prior 30 min corticosterone(10nM)administrationA.蛋白免疫印迹检测在基础生理条件下和皮质酮刺激后细胞膜和细胞核中的GR的表达水平;B.细胞膜蛋白组分统计数据;C.细胞核蛋白组分数据统计数据来源于三次重复实验,数据以平均值±SEM表示。Con,Control,对照组;CORT,10nM皮质酮刺激30分钟。*,P<0.05;**,P<0.01A.Representative blots show GR association in membrane and nucleus in cells at basal condition and corticosterone-stimulated cell fractions,with 2h or 6h pre-incubation;B.Statistical date of the membrane fraction;C.Statistical date of the nucleusStatistical data were collected from three repeated experiments,panel.Data were expressed as Mean±SEM.Con,Control;CORT,10nM corticosterone,30min.*,P<0.05;**,P<0.01.

图5 抑制剂放线菌素D和嘌呤霉素对皮质酮快速反馈和ACTH前体POMC转录的作用Figure 5 The inhibitory effect of Actinomycin D and puromycin on ACTH secretion and ACTH precursor POMC hnRNA transcriptionA.放线菌素D不能阻止皮质酮对ACTH分泌的抑制作用;B.放线菌素D抑制垂体细胞中POMC hnRNA的转录;C.嘌呤霉素不能阻止皮质酮对ACTH分泌的抑制作用黑色实心长条状代表CRH给药刺激的时间区间,虚线空心长条状分别代表放线菌素D(嘌呤霉素)和皮质酮给药刺激的时间区间。放线菌素D给药浓度为0.3μg/ml,嘌呤霉素为10μg/ml。A.Actinomycin D is not able to prevent the inhibitory effect of corticosterone on CRH-stimulated ACTH secretion.B.Actinomycin D decreased the transcription of POMC hnRNA;C.Puromycin could not prevent the inhibitory effect of corticosterone-induced ACTH secretion.The long black solid bars represent the period of CRH administration,and the dotted hollow strips represent corticosterone and actinomycin D/puromycin infusion,respectively.Actinmycin D:0.3μg/ml,Puromycin:10μg/ml.
3 讨论
在垂体细胞灌注系统中,CRH刺激引起ACTH水平升高。然而,垂体门静脉循环中CRH的最低值(10pM)并不能引起ACTH分泌的升高;100pM CRH快速诱导ACTH分泌升高,持续刺激后,ACTH水平降低,提示受体可能脱敏;30pM CRH诱导稳定的ACTH分泌,因此该浓度被用于建立稳定的ACTH分泌体系用于研究糖皮质激素的快速反馈。剂量反应实验中,ACTH的水平随着CRH浓度的增加而升高,表明细胞灌注系统运行良好。
细胞经无血清培养基预孵育2h,10nM和100nM的皮质酮并不能抑制ACTH分泌。应激水平的皮质酮(1μM)显着降低ACTH分泌水平。这些数据表明,只有应激水平皮质酮的才能抑制垂体细胞的ACTH分泌,这是与体内生理条件是不一致的。我们推测,有可能是培养条件,如糖皮质激素的存在,影响皮质酮反应的敏感性。有研究表明,地塞米松治疗ACTH腺瘤细胞比非腺瘤性垂体细胞,引起的ACTH分泌和POMC mRNA水平的抑制作用要更小一些[15]。
RIP结果显示经过2h孵育后细胞培养液中的皮质醇浓度为19.3nM,延长至6h时浓度为7.3nM。这也就意味着垂体细胞在灌注时仍处于高浓度的糖皮质激素环境,高浓度的糖皮质激素环境可能影响ACTH细胞中糖皮质激素的快速反馈。为了清除和摆脱培养液中的糖皮质激素,我们尝试更换含活性炭剥离血清的培养基孵育细胞过夜,但是细胞是黏附在Cytodex beads上一起培养的,这给换液带来了一定的难度,同时,也降低了细胞的活性。更换含活性炭剥离血清的培养基后,第二天观察细胞发现,与Cytodex Beads黏附的细胞数目减少,细胞活性降低,转入灌注系统后同样数目的细胞ACTH分泌水平降低。究其原因,我们猜测一方面是在换液的过程中机械的损伤导致垂体细胞与磁珠的解离,另一方面可能是应激作用,垂体细胞并不适应活性炭剥离血清的培养基。
在进一步的研究中,我们比较了2h和6h无血清培养基孵育后小鼠垂体瘤细胞系AtT20细胞中GR的表达和定位情况。研究结果显示,与孵育2h相比,6h后AtT20细胞中细胞膜和细胞核在对照组的GR表达水平相对要更低一些。而皮质酮处理30min后,6h的细胞膜蛋白GR表达水平变化差异显著,2h组无显著差异;两组的细胞核的GR含量变化并无显著性差异。这一结果与我们之前发表的文章中提到的GR的膜转运可能参与糖皮质激素的快速抑制作用高度一致[13]。有研究统计,皮质醇增多症患者GR mRNA水平降低或者基因杂合性丢失,GR在库欣综合征的发生和临床表现中起重要作用[16]。
经过6h预孵育后,10nM的皮质酮能够抑制ACTH的分泌,表明了糖皮质激素反馈的敏感性取决于在给予皮质酮之前,垂体细胞环境的类固醇浓度。这一结果对于慢性应激和高循环糖皮质激素引起的紊乱的HPA调节具有重要的意义。细胞接受重复皮质酮刺激可引起ACTH脉冲式分泌。这一实验结果与之前Lightman提出的垂体-肾上腺的前馈/反馈机制是介导糖皮质激素分泌的昼夜节律分子机制的一部分是一致的,也在一定程度上反驳了Abou-Samra[17]和Widmaier[18]所提出的关于下丘脑可能是糖皮质激素快速反馈中心这一假说。
糖皮质激素对CRH刺激的ACTH的快速抑制作用的动力学表明这种作用是非基因组作用。0.3μg/ml转录抑制剂-放线菌素D,在有效剂量时未能阻止皮质酮的抑制作用,表明糖皮质激素对ACTH分泌的抑制作用是非基因组的,不受转录因子的调节。嘌呤霉素是蛋白质合成的抑制剂,同样对皮质酮的快速反馈无显著作用,暗示这一快速反馈与蛋白质合成无直接关联。垂体ACTH细胞中糖皮质激素的快速反馈是前馈/反馈机制的一部分,介导糖皮质激素分泌的昼夜节律,不受下丘脑CRH分泌脉冲的影响。
总而言之,我们采用了垂体细胞灌注系统,模拟了体内生理环境,以30pM CRH建立了稳定的ACTH分泌体系,培养体系中残留的糖皮质激素降低糖皮质激素反馈的敏感性,并且糖皮质激素反馈由细胞膜上的GR介导,不被转录抑制剂或蛋白翻译抑制剂阻断。本研究进一步丰富了糖皮质激素作用的分子机制,有助于揭示皮质醇增多症的病因,并为临床诊治提供一定的参考。

