高脂饮食上调大鼠慢性炎症水平导致勃起功能障碍发生风险增高*
冯家新 齐 涛 黄展森 李 浩 朱 佩王 博 马 帅 陈 颖 杨文涛 陈 俊**
1. 广西壮族自治区南宁市 广西中医药大学(广西南宁 530023)
2. 中山大学附属第三医院不育与性医学科(广东广州 510631)
3. 广州医科大学附属第三医院泌尿外科(广东广州 510150)
4. 广西中医药大学附属瑞康医院男性科(广西南宁 530012)
前 言
勃起功能障碍(erectile dysfunction,ED)指的是阴茎不能达到和(或)维持足够完成阴道内性交的勃起以获得满意的性生活[1]。 肥胖是一种由于长时间能量摄入与消耗失衡,导致脂肪过多积累而引起的疾病[2]。 在过去的40 年里,全球肥胖发生率大幅上升,从1975 年到2016 年,男性的肥胖率从3%上升到11%,女性的肥胖率从6%上升到15%[3]。肥胖与心血管疾病[4]、高血压[5]、2型糖尿病[6]和高脂血症[7]等相关,而ED 与这些疾病密切相关也已被证实[8]。据报道,肥胖男性中ED 的发生率高达79%[9],其腹围每增加1cm,患ED 的风险则上升3%[10]。 Besiroglu H 等人通过回顾性研究发现代谢综合征患者比正常人罹患ED 的风险增加2.6 倍[11]。 肥胖的产生主要受饮食因素影响, 特别是高脂饮食(high-fat diet,HFD)[4]。 控制饮食和减重,在一定程度上可以恢复肥胖相关性ED (obesity-associated erectile dysfunction,OAED)患者的勃起功能[9,10,12]。
阴茎海绵体组织受氧化应激[13]、炎症[14]和机械损伤[15]等影响,都会使血液不能充分地流向勃起组织而导致ED。 HFD 能够诱导肥胖,导致脂肪组织自然杀伤细胞的大量积累、增殖和激活,从而导致机体处于慢性炎症水平[16],炎性损伤引起的内皮功能障碍并导致心血管疾病已被大量研究证实[8,17],其中促炎因子和粘附分子的高表达导致血管内皮细胞屏障功能被破坏是引起这些疾病产生的主要因素之一[18,19]。 在OAED 大鼠中,阴茎海绵体内的炎性病变与ED 的关系研究甚少。
因此,本研究试图通过建立HFD 大鼠模型,监测其代谢、肝脏和阴茎组织病理学等指标,用最大海绵体内压(max intracavernous pressure,Max ICP)和 平 均 动脉压(mean arterial pressure,MAP)的比值评价其勃起功能, 同时检测其海绵体组织中磷脂酰肌醇3- 激酶(phosphatidylinositol 3-kinase,PI3K)、 丝氨酸/ 苏氨酸激酶(protein kinase B,AKT)、核因子κB(nuclear factor-kappa B,NF-κB)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)和白介素-6(interleukin-6,IL-6)等炎症通路相关蛋白的表达情况,探讨HFD 对大鼠勃起功能的影响,以期寻找治疗OAED 可能的靶点,为后期深入研究打下基础。
材料和方法
一、材料与试剂
1.实验动物
20 只雄性SD 大鼠,10 月龄左右,体重在500-700g之间,购于中山大学实验动物中心(SCXK [粤] 2016-0029)。 本研究所有实验方案获得广东省微生物研究所实验动物中心伦理批准(SYXK[粤]2016-0156)。
2.饲料和试剂
高脂饲料配方(猪油15%,蔗糖20%,胆固醇1.2%,酪蛋白10%,磷酸氢钙0.6%,石粉0.4%,胆酸钠0.2%,预混料0.4%,基础饲料52.2%),总胆固醇(total cholesterol,TCH)(A111-1-1)、 甘 油 三 酯(triglyceride,TG)(A110-1-1)、 低密度脂蛋白 (low density lipoprotein,LDL)(A113-1-1)、高密度脂蛋白(high density lipoprotein,HDL)(A112-1-1)试剂盒购自南京建成生物工程研究所;苏木素(G1004)、伊红(G1001)、Anti-IL-6 Rabbit pAb (GB11117) 购自武汉赛维尔生物科技有限公司;Masson's 三 色 染 色 试 剂 (G1340)、BCA 试 剂 盒(PC0020)购自索莱宝科技有限公司;Anti-PI3K P85 Alpha Mouse mAb (60225-1-Ig)、Anti-AKT Mouse mAb(60203-2-Ig) 购自武汉三鹰生物技术有限公司;Anti-NF-kB p65 Rabbit pAb (ab16502)、Anti-TNF Alpha Rabbit pAb(ab9739)、Anti-IL-6 Rabbit pAb(ab6672)购自美国Abcam 公司;RIPA 裂解液(89901)购自赛默飞世尔科技有限公司;甘油醛-3- 磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH,Rabbit mAb,2118L)购自美国CST 公司。
3.主要仪器
生理试验记录仪(BL-420S,成都泰盟软件有限公司),血糖检测仪(鱼跃580),自动染色机(Gem iniAS,赛默飞世尔科技有限公司)。
二、方法
1.实验动物分组
20 只大鼠随机平分为2 组,对照组(n=10,喂食常规饲料)和模型组(n=10,喂食高脂饲料)。 所有大鼠均自由饮水、饮食,每周监测体重和饲料用量1 次,持续4个月。
2.HFD 模型建立和海绵体测压
连续喂养4 个月后,禁食1 夜,第二天尾静脉针刺取血,记录空腹血糖值(fasting blood-glucose,FBG)。 采用3%戊巴比妥钠(40mg/kg)麻醉固定,腹部解剖出盆神经节,电刺激盆神经节的分支海绵体神经,诱导阴茎勃起。 参照Justin D.等人的实验[20],用BL-420S 生理记录仪记录ICP 和MAP 的变化(结合本实验所使用仪器的实际情况, 将电刺激参数设置为: 电压5.0V, 频率20Hz、波宽0.2ms)。而后腹主动脉取血,离心后取血清,储存于-80℃,备用。
3.组织病理学观察
留取并修剪肝脏和中段阴茎组织, 生理盐水清洗并吸干多余水分,置于10%福尔马林缓冲液中固定。其余阴茎组织先用液氮猝灭,后转移到-80℃冰箱保存,备用。经福尔马林固定后组织,切片,常规石蜡切片脱蜡后,按标准程序对肝脏和阴茎组织进行H&E 染色[21];Masson's 三色染色按说明书进行。 显微镜下观察和拍摄切片。
4.免疫组织化学染色
阴茎组织石蜡切片常规方法脱蜡后, 按免疫组化标准方案进行[22]。 使用的一抗包括:Anti-IL-6 Rabbit pAb(1:500),Anti-TNF Alpha Rabbit pAb(1:500),二抗为:抗兔二抗(G1215,1:50,武汉赛维尔生物科技有限公司)。 Image-Pro Plus 6.0 软件用于阳性颗粒的半定量分析,用积分光密度(integral optical density,IOD)表示。
5.Western blot
修剪阴茎海绵体组织,加入适量RIPA 裂解液提取组织蛋白,按BCA 试剂盒的说明检测蛋白浓度,100℃条件下使蛋白变性。 SDS-PAGE 电泳分离蛋白质,并将其转移到PVDF 膜上。 用含5%脱脂奶粉的TBST 溶液封闭, 一抗4℃过夜。 一抗包括:Anti-PI3K P85 A lpha Mouse mAb(1:5000),Anti-AKT Mouse mAb(1:5000),Anti-NF-kB p65 Rabbit pAb (1:1000),Anti-TNF A lpha Rabbit pAb(1:2000),Anti-IL-6 Rabbit pAb(1:2000)和GAPDH(14C10)Rabbit m Ab(1:1000),二抗包括:山羊抗兔IgG (H+L) HRP(S0001,1:5000,Affinity)、山羊抗小鼠IgG(H+L)HRP(S0002,1:5000,Affinity)。 增强化学发光法显影。Image J 软件分析,目的蛋白与内参灰度值的比值代表目的蛋白的相对表达量。
6.统计学方法
结 果
一、HFD 大鼠代谢参数比较
两组大鼠空腹血糖变化无明显差异。 模型组大鼠的体重增量、TCH、TG 和LDL 等水平均高于对照组,HDL 水平则低于对照组(n=6,P<0.05),见表1 和图1,提示HDF 能够导致大鼠体重和血脂水平升高。

图1 HFD 大鼠代谢参数统计分析
二、HFD 大鼠勃起功能降低
电刺激大鼠海绵体神经后,记录MAP 与ICP 变化趋势(图2A);计算Max ICP 和MAP 的比值,对照组SD 大鼠Max ICP/MAP=0.8404±0.0346, 模型组SD 大鼠 Max ICP/MAP=0.4162 ±0.0365。 模 型 组 Max ICP/MAP 值明显低于对照组(n=6,P<0.001,图2B)。以上结果提示4 个月的HFD 能够导致大鼠勃起功能下降。
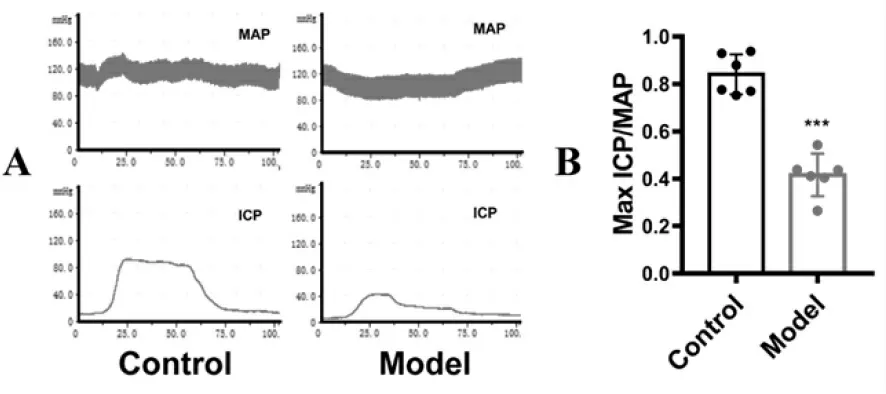
图2 HFD 大鼠勃起功能降低
三、HFD 大鼠肝脏和阴茎组织学形态变化
经过HFD 喂养4 个月后,H&E 染色结果显示:与对照组相比,模型组大鼠肝组织中出现大量脂滴空泡,细胞核被挤向边缘(如图3A 箭头所指);海绵体平滑肌细胞(cavernosum smooth muscle cells,CSMCs)排布 欠规则,肌纤维间隙增宽(如图3B 箭头a 所指),内皮细胞(endothelial cells,ECs)萎缩,连续性中断(如图3B 箭头b 所指)。 Masson's 三色染色显示海绵体组织平滑肌染成红色,胶原纤维染成蓝色。 对照组大鼠平滑肌含量丰富,胶原纤维较少;而模型组平滑肌含量较少,胶原纤维较多(图3C)。提示4 个月的HFD 能够导致大鼠肝脏脂肪堆积,海绵体组织出现病理学改变。

图3 HFD 大鼠肝脏和阴茎组织学形态变化
四、HFD 大鼠阴茎促炎因子表达增多
IHC 结果显示, 模型组TNF-α (134.10±12.49)和IL-6(127.90±10.13)的表达量较对照组TNF-α(62.71±1.98)和IL-6(68.01±2.88)明 显 增 高(n=3,P<0.01,图4A,图4B),说明HFD 促进大鼠海绵体组织中TNF-α和IL-6 表达水平升高。

图4 HFD 大鼠阴茎炎症因子表达水平
五、PI3K-AKT 通路在HFD 大鼠勃起功能障碍发病中可能起重要作用
Western blot 结果显示HFD 大鼠海绵体组织中,PI3K/GAPDH(0.88±0.07)、AKT/GAPDH(1.527±0.01)、NF-κB/GAPDH(0.68±0.05)、TNF-α/GAPDH(0.53±0.02)和IL-6/GAPDH (0.14±0.01) 的表达水平, 较对照组PI3K/GAPDH(0.64±0.03)、AKT/GAPDH(1.30±0.04)、NF-κB/GAPDH(0.52±0.02)、TNF-α/GAPDH(0.25±0.07)和IL-6/GAPDH(0.090±0.002)的表达水平均明显增高(n=3,P<0.05,图5A),经标准化后如图5B。 提示HFD可能通过激活PI3K/AKT, 上调NF-κB、TNF-α 和IL-6等的表达水平,促进大鼠勃起功能障碍的发生。

图5 PI3K-AKT 通路可能参与HFD 大鼠的勃起功能障碍的发生
讨 论
本研究通过构建HFD 大鼠模型,发现与对照组相比,HFD 大鼠血脂水平显著升高,Max ICP/MAP 值降低, 阴茎海绵体组织出现明显的病理学改变。 PI3K、AKT、NF-κB、TNF-α 和IL-6 等蛋白在HFD 大鼠海绵体组织中的表达水平显著高于对照组。 HFD 使阴茎海绵体组织无法得到充分的血流灌注, 从而导致大鼠勃起功能下降,可能是由于CSMCs 和ECs 出现炎性损伤所致。
长期的HFD 容易导致机体肥胖[23]。据报道,肥胖和慢性低度炎症有关。HFD 所引发的病理生理过程中,往往伴随着肝脏Kupffer 细胞TNF-α 和IL-6 等细胞因子的分泌增多;TNF-α 和IL-6 是脂肪细胞肥大产生的主要炎症因子[24]。炎症因子的大量产生可导致肥胖病人血液中TNF-α 和IL-6 水平升高[25-27],容易引起许多疾病的发生和进展,诸如动脉粥样硬化,糖尿病和非酒精性脂肪肝等[18,28],而ED 被认为与这些疾病密切相关[8]。 同时TNF-α 和IL-6 在ED 患者血液中表达异常已有报道[29],可诱导内皮细胞中的炎症基因转录并抑制内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)表达[30];TNF-α 直接注入小鼠的海绵体可抑制eNOS 和神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)基因表达[31]。 eNOS 和nNOS 是勃起过程中的重要信号分子,其产生减少与ED 的发生相关[32]。 另外,CSMCs 和ECs 是阴茎勃起组织的重要成分,CSMCs 和ECs 出现萎缩、纤维化和凋亡等,会导致海绵体组织充血异常而引起ED[33,34]。 我们的研究发现:与对照组相比,HFD 喂养4 个月的大鼠阴茎CSMCs 排布欠规则,肌纤维间隙增宽,ECs 萎缩,连续性中断;其肌纤维含量减少, 胶原纤维含量增加;TNF-α 和IL-6 在CSMCs 和ECs 中表达增高(P<0.01),以上结果说明炎症因子的过度表达可能会导致CSMCs 炎性损伤, 舒缩功能受限,和ECs 通透性增加进而加重血管炎性病变, 从而导致HFD 大鼠勃起功能下降。 该结果与Salomon 等人[35]的报道相符。
通过免疫组化实验观察到HFD 大鼠阴茎海绵体组织中炎症因子水平增加后, 我们对上游潜在的炎症相关通路进行了蛋白水平的验证(图5)。 PI3K 蛋白家族在增殖、凋亡和分化等多种细胞功能中发挥作用[36,37],PI3K/AKT/NF-κB 通路在炎症调控中起到的作用也被逐渐发现[38]。 实验结果发现PI3K、AKT、NF-κB 在HFD大鼠海绵体组织内表达水平较对照组均增高(P<0.05),因此我们猜测海绵体组织内TNF-α 和IL-6 等炎症因子表达增加可能与PI3K、AKT、NF-κB 的表达增加有相关性,可能是大鼠勃起功能下降的重要原因。PI3K 能激活AKT, 促进NF-κB 抑制蛋白的磷酸化降解,使NF-κB 激活,通过核转位,促进炎性细胞因子的表达,如:IL-1,IL-6,TNF-α 等[39]。观察到的该现象与之前糖尿病相关性ED 中PI3K/AKT 通路的激活导致氧化应激水平升高从而引起ED 的研究相似[40]。 该部分研究结果是对阴茎炎症改变的进一步验证和潜在机制推测,这些机制的研究为进一步机制研究和干预靶点的选择提供了一定的理论依据。
虽然本研究观察到HFD 大鼠PI3K、AKT、NF-κB、TNF-α 和IL-6 等促炎因子表达水平增高可能是引起勃起功能下降的原因, 但PI3K/AKT/NF-κB 通路与很多细胞功能的调节都有关。 能否通过激活PI3K/AKT/NF-κB 通路导致海绵体组织炎症因子的过表达, 从而引起ED;或者通过抑制PI3K/AKT/NF-κB 的激活减少海绵体组织中炎症因子的产生, 从而改善勃起功能将是下一步需要深入研究的方向和探讨的靶点。
综上,HFD 可能是通过激活PI3K/AKT 通路,上调NF-κB 的表达,引起TNF-α 和IL-6 等炎症因子水平增高,致使CSMCs 和ECs 出现炎性损伤,引起其结构和功能障碍,最终大鼠导致勃起功能下降。

