RXFP2 在己烯雌酚染毒小鼠睾丸引带细胞中的作用机制研究*
段守兴 蒋学武 张冰娜 肖文峰 谢新泉 张 镟** 李建宏**
1. 汕头大学医学院第二附属医院小儿外科(广东汕头 515041);
2. 南方医科大学附属深圳坪山妇幼保健院小儿外科(广东深圳 518122);
3. 汕头大学医学院第一附属医院小儿外科;
4. 汕头大学医学院第二附属医院转化医学研究中心
随着社会的进步与发展,工业化程度不断提高,人类在征服改造自然取得辉煌成就的同时, 由此导致环境污染与生态失衡对人类健康, 尤其是生殖健康造成严重的影响[1-4],这可能与孕期暴露环境雌激素(environmental estrogens,EEs)密切相关[5-7]。 环境雌激素对人类雄性生殖健康的影响主要表现在男性先天性畸形如隐睾、尿道下裂、性别发育异常(DSD)等以及成年后生殖、性功能异常,生殖系肿瘤等[8-10]。 睾丸作为生殖系统的核心器官, 它影响或诱导整个雄性生殖系统的发育,使得深入研究睾丸正常下降发育的影响因素尤为重要。
睾丸的正常发育需经历两个正常的下降阶段,在睾丸下降第一阶段(经腹下降期),睾丸引带特征性地表现细胞增殖、分化、迁移、收缩及激素代谢等功能[11]。目前公认在睾丸下降发育第一阶段起关键作用的调控因子——胰岛素样因子3(Insulin-Like Factor 3,INSL3)能刺激睾丸引带增生,控制其生长发育[12-14]。INSL3 通过与其特异受体松弛素家族肽受体2(Relaxin fam ily peptide receptor 2,RXFP2)结合形成INSL3-RXFP2 配体受体复合物发挥生物学作用[15,16]。 既往研究发现EEs 可不同程度的抑制胚胎期睾丸Leydig 细胞生成INSL3,从而影响睾丸下降发育, 并推测这个过程是进一步影响睾丸引带的形态及功能间接实现的[17]。 但EEs 对睾丸引带发育影响的确切作用机制却并不十分清楚。 目前EEs 对INSL3 影响方面的研究已有不少报道[13,18],但对其特异性受体RXFP2 是否有直接影响的报道尚缺乏。
为了明确EEs 影响睾丸引带发育是否与RXFP2 直接相关。 本研究利用经典EEs 己烯雌酚(diethylstilbestrol,DES)进行染毒,观察DES 对培养的小鼠睾丸引带细胞形态、增殖性和RXFP2 的影响,探讨RXFP2 在外源性雌激素影响小鼠睾丸引带发育中的可能作用机制,为阐明EEs 的生殖毒性作用机制提供新的理论依据。
材料与方法
一、材料
(一)实验动物
8~10 周龄昆明小鼠购自并饲养于汕头大学医学院实验动物中心(SPF 级别)。按雌雄比例2∶1 合笼,怀孕生产后取新生仔鼠用于实验。
(二)主要试剂
DES(美国Sigma 公司);高糖不含酚红的DMEM(德国Applichem 公司);不含雌激素的胎牛血清(以色列Biological 公司); DMSO (中国上海生工);CCK-8(日本Dojindo 公司);台盼蓝(美国Sigma 公司);DAPI(中国碧云天公司); 山羊抗小鼠RXFP2 多克隆抗体(美国Santa Cruz 公司);异硫氰酸荧光素(FITC)一兔抗山羊IgG(中国武汉博士德生物工程有限公司)。
(三)主要仪器
手术放大镜(中国天津医学光学仪器厂);手术显微器械(中国上海金钟手术器械厂);倒置显微镜(德国Leica 公司);荧光显微镜(德国Leica 公司);ELx800 酶标仪(美国Bio-Tek 公司);凝胶成像系统(美国UVP 公司)。
二、方法
(一)小鼠睾丸引带细胞的培养及分组
脱颈椎处死新生小鼠, 在3 倍手术放大镜下取出小鼠睾丸引带组织。 将引带组织放入含Ⅰ型胶原酶(1mg/m L)的DMEM 培养液中,37 ℃持续振荡消化1h 后,加入3~4 倍含无雌激素血清的培养液终止消化作用; 静置后取上清液, 用25μm 孔径过滤器过滤,以1 000 r/m in 离心滤液5 m in(离心半径为15 cm),弃上清。 细胞沉淀加入含无雌激素胎牛血清(体积分数为10%)的DMEM 培养液,吹打成单细胞悬液,接种于25 m L 培养瓶中, 置于5% CO2、37 ℃饱和湿度孵育箱中静置培养。 传代细胞随机分为正常组、溶剂对照组和实验组(DES 0.01、0.10、1.00、10.00 μg/m L 4 个剂量组)。
(二)小鼠睾丸引带细胞计数及存活率的检测
对细胞传代时的细胞悬液进行计数。 用酒精冲洗计数板后,把盖片覆在计算板上,取少许混匀的细胞悬液加入计数板和盖片间的间隙中, 置相差显微镜下观察,可见细胞均匀分散于各处。 计算四角大格内的细胞数,压中线者只计左侧和上方者,右方和下方不计算在内。 然后按下式计算:细胞悬液浓度(细胞个数/m L)≈(4 个大方格细胞总数/4)×10 000×稀释倍数。
用台盼蓝染细胞时,活细胞拒染,死细胞可摄取染料变蓝。 利用细胞这种特性,我们使用台盼蓝对传代的细胞悬液进行细胞活性检测。 取混匀的细胞悬液和0.2%台盼蓝(9∶1)充分混合,置2~3m in。 取10μl 细胞悬液后加入至计数板与盖片间的间隙中。 置倒置显微镜下观察,凡着色的细胞均为不健康的或已死细胞,活细胞不着色。 计算四角大格内的细胞数(同细胞计数)然后按下式计算: 细胞活性(%)≈[活细胞数/(活细胞数+死细胞数)]×100%
(三)CCK-8 法细胞增殖抑制检测
将制备好的细胞悬液种于96 孔板中(边缘一圈不接种),每组设9 个平行孔,重复3 次。 实验组加入不同剂 量 的DES (终 浓 度 分 别 为0.01、0.10、1.00、10.00 μg/m L)各1 μl,溶剂对照组加入DMSO1 μl,正常组不加任何药物。 加药后48 h 进行CCK-8 的检测。 每孔加入10 μl 的CCK-8 后,避光置于37 ℃培养箱中孵育1 h。使用酶标仪双波长(检测波长为450 nm 和630 nm)测定每孔的吸光度值,以代表细胞的增殖性。
(四)细胞免疫荧光检测
选择传代1~2 d、长满单层、形态良好的细胞,去除培养基,分别加入终浓度为0 (溶剂对照)、0.01、0.10、1.00、10.00 μg/m l 含DES 的培养液1 μl, 并设正常对照(不加任何药物)。 继续培养48 h 后,将获取的细胞盖玻片用PBS 轻洗,4%多聚甲醛固定15 min,PBS 轻洗3 遍,1%BSA 覆盖片刻, 滴加浓度为1∶100 的山羊抗小鼠RXFP2 多克隆抗体(一抗),置湿盒内4℃过夜,再用PBS 轻轻洗涤3 遍后,滴加1∶500 FITC- 兔抗山羊IgG(二抗),在室温中孵育60m in ,PBS 轻轻洗涤3 遍,加入DAPI 染核5 min。 甘油封片,荧光显微镜下观察,拍片。
(五)Western Blot 分析
取各组睾丸引带细胞加入RIPA 蛋白酶裂解后取上清液获取蛋白, 取一定的蛋白量进行SDS-PAGE 电泳,硝酸纤维素膜转膜,脱脂奶粉封闭,一抗山羊抗小鼠RXFP2 多克隆抗体(1∶100)在4℃冰箱内过夜孵育,二抗(HRP 一兔抗山羊IgG 1:500) 室温下孵育1~2 h后,进行化学发光反应,显影,定影。 最后将胶片进行扫描或拍照, 用Image-pro 软件分析目标条带光密度值。以测定蛋白灰度值与内参蛋白灰度值的比值表示其蛋白相对表达水平,实验重复3 次,取其平均值。
三、统计学分析
所有数据均以x±s 表示,应用SPSS17.0 统计软件分析,样本率采用卡方检验,多组比较采用方差齐性检验和单因素方差分析(One-Way ANOVA),组间两两比较时,采用两独立样本t 检验。以P<0.05 为差异有统计学意义。
结 果
一、DES 对小鼠睾丸引带细胞形态的影响
正常组与溶剂对照组培养的小鼠睾丸引带细胞大部分为成纤维样细胞,有少数的上皮样细胞。 胞体呈梭形或不规则三角形,胞质有突起(图1 A,B)。 实验组细胞随DES 剂量增加明显受抑制,细胞生长缓慢,突起回缩,相互间隙增大(图1 C,D,E,F)。 DES 剂量越高,细胞越失去成纤维细胞的形态,细胞浆收缩,胞体呈不规则类椭圆型(图1 F)。

图1 DES 对小鼠睾丸引带细胞形态的影响
二、DES 对小鼠睾丸引带细胞增殖性的影响
正常细胞传代后仍呈成纤维细胞型生长, 同源性好,存活率可达90%。各实验组随DES 剂量增加细胞数及细胞生存率均下降(P<0.001)(图2 A)。正常组细胞呈持续性增殖,溶剂对照组无明显差异。 实验组与正常组对比均有不同程度的增殖抑制(P<0.05 或P<0.001),以DES 10 μg/m l 组抑制最明显(P<0.001)(图2 B)。 表明DES 对睾丸引带细胞增殖性有抑制作用,并存在剂量-效应关系。
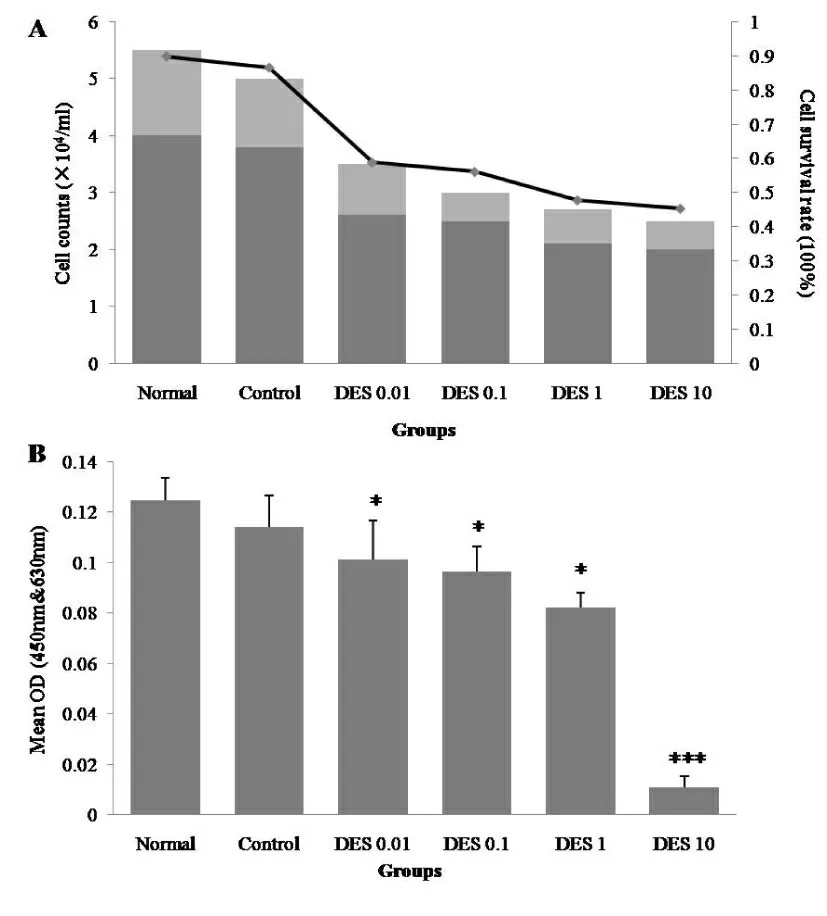
图2 DES 对小鼠睾丸引带细胞生长及增殖情况的影响
三、RXFP2 的亚细胞定位及DES 对小鼠睾丸引带细胞RXFP2 表达的影响
我们使用细胞免疫荧光方法显示RXFP2 表达于细胞膜上,荧光强度较高(图3)。 通过Western Blot 结果发现正常组和溶剂对照组小鼠睾丸引带细胞上的RXFP2 表达无明显差异(P>0.05),各实验组中RXFP2表达明显降低(P<0.001)(图4)。
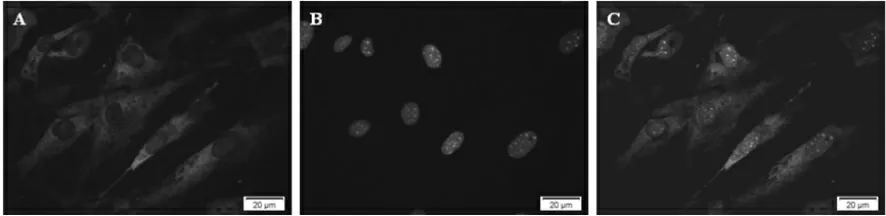
图3 免疫荧光对RXFP2 的亚细胞定位
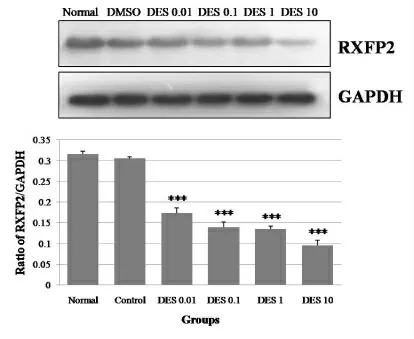
图4 Western Blot 检测DES对小鼠睾丸引带中RXFP2 表达的影响
讨 论
环境雌激素又称外源性雌激素, 是人体外化学物质中具有雌激素样活性, 并可破坏人体内分泌平衡引起一系列临床后果的物质, 广泛存在于自然界和人们的日常生活中[6,19]。无论动物实验还是流行病学方面的研究都显示EEs 能引起多种泌尿生殖系统异常/畸形[20,21]。美国国家环境卫生科学研究所 (National Institute of Environmental Health Sciences)的实验室将DES 作为用来研究EEs 效应的参考雌激素[22]。 因此, 本研究选择DES 作为我们研究EEs 生殖毒性的干预手段。
小鼠睾丸下降第一阶段(经腹下降期)发生于胎鼠期,睾丸引带在此阶段特征性地表现细胞增殖、分化、迁移、收缩及激素代谢等功能,引带细胞收缩活性与引带形态变化相互协调[23]。我们对培养的小鼠睾丸引带细胞进行单一的干预因素作用, 发现DES 可致小鼠睾丸引带细胞形态异常、结构紊乱,随着DES 剂量的增加,细胞失去原有形态,并与剂量有关。提示DES 对小鼠睾丸引带细胞有显著的细胞毒性作用, 可以抑制小鼠睾丸引带细胞的生长与发育。
睾丸下降发育是一项非常复杂的系统工程, 要经历两个下降过程, 涉及很多影响或调控睾丸下降发育的因素[24,25]。目前已比较明确的是INSL3 在睾丸下降的第一阶段起着决定性作用,INSL3 与RXFP2 结合形成受体配体复合物INSL3-RXFP2 发挥生物学效应[15,16]。我们确定了DES 对小鼠睾丸引带发育的影响, 但具体的作用机制仍不清楚[26]。
通过本研究,我们发现RXFP2 高表达于睾丸引带中,并主要分布在细胞膜上。 DES 作用后RXFP2 蛋白表 达 降 低,DES 剂 量 越 大,RXFP2 表 达 越 低。 由 于RXFP2 是睾丸下降发育第一阶段关键调控因素INSL3的特异性受体,且两者需形成INSL3-RXFP2 复合物方可发挥生物学效应[15,16]。 RXFP2 表达量的降低将使得INSL3 减少了发挥生物效应的媒介,减少了相互结合,从而使睾丸经腹下降期受阻[27]。因此,我们推测DES 对睾丸引带细胞形态及增殖性的影响可能是通过RXFP2起作用,提示RXFP2 可能介导了DES 影响睾丸引带发育的过程。
综上所述, 通过本研究我们验证了DES 可引起小鼠睾丸引带细胞形态与增殖异常, 并进一步检测了DES 可以降低睾丸引带中RXFP2 的表达。 提示DES对睾丸引带的影响可能是通过RXFP2 信号系统介导的, 为更全面地研究外源性雌激素影响生殖系统发育的可能途径提供理论基础。

