寻常型银屑病炎性标志物与动脉硬化的相关性分析
胡 佳,杨莉佳,秦 娴,董 赟
1南京医科大学附属无锡第二人民医院皮肤科,2心血管内科,江苏 无锡 214002;3南京中医药大学无锡附属医院病理科,江苏 无锡 214071
近年对银屑病这一临床难题的研究已不再只聚焦于皮肤局部,共患病研究中有学者发现银屑病患者心肌梗死、肺栓塞、脑血管病等发生率较其他皮肤病高1.2倍。流行病学调查显示银屑病患者心血管事件发生率偏高,是银屑病患者死亡的主要原因[1]。参照动脉粥样硬化发病的“损伤⁃反应”假说[2],银屑病的炎症状态应是引起患者发生心血管病理改变的核心环节。因此,本研究收集本院寻常型银屑病住院患者资料,选取了具有代表性的炎性标志物超敏感C 反应蛋白(high⁃sensitivity C⁃reac⁃tive protein,hs⁃CRP)、白细胞介素⁃6(interleukin⁃6,IL⁃6)及可溶性细胞间黏附分子1(soluble intercellular adhesion molecule⁃1,sICAM⁃1),测定其血清浓度,与反映心血管动脉硬化早期状态的肱动脉血流介导的舒张(flow⁃mediated dilation,FMD)值以及颈动脉内膜中层厚度(intima⁃media thickness,IMT)进行相关性分析,旨在探讨银屑病的炎症反应与心血管动脉硬化发生发展间的关系。
1 对象和方法
1.1 对象
入选标准:2018 年6 月—2019 年2 月在无锡市第二人民医院住院的寻常型银屑病患者57 例为研究组,男43例,女14例,年龄(49.90±8.10)岁(22~68岁);门诊健康体检者57例为对照组,男42例,女15例,年龄(48.97±7.41)岁(24~64 岁)。两组年龄、性别具可比性。排除标准:已有明确心脑血管疾病病史者、代谢综合征、肝肾功能不全、吸烟酗酒、传染病活动期及癌症患者。本研究经院伦理委员会批准,并知情同意。
1.2 方法
1.2.1 炎性标志物测定
采受试者外周静脉血,离心后提取上清液存于-20 ℃冰箱。用ELISA 法、上海恪敏生物提供的试剂盒测定血清hs⁃CRP、IL⁃6、sICAM⁃1浓度。
1.2.2 肱动脉FMD功能测试
嘱受试者提前1 d避免摄入脂餐、烟酒、咖啡等刺激类饮食。血管内皮功能检测仪固定于受试者右臂(UNEXEF38G,日本),先测量安静血压,在右上臂肘关节上方3~5 cm 肱动脉内中膜测得基础内径值。固定检测探头再加压50 mmHg,维持5 min 后放气,测出放气后2 min 以内最大内径值。计算并记录FMD 值=(最大内径-基础内径)÷基础内径×100%。FMD<5%判为异常。
1.2.3 颈动脉IMT测定
选定同1 名资深超声科医师用10 MHz 探头(GE Vivid 7,美国)纵切测量两侧颈动脉内中膜最大值,6 次测量后计算平均值并记录。颈动脉IMT≥1.0 mm为内膜增厚(即内膜厚度异常)。
1.3 统计学方法
符合正态分布的定量指标以均数±标准差()表示,组间比较用t检验。计数资料用百分率表示,比较用χ2检验。相关性分析用Spearman 法。使用SPSS22.0统计软件,P≤0.05为差异有统计学意义。
2 结果
2.1 两组间血清炎性标志物比较
研究组患者血清hs⁃CRP、IL⁃6、sICAM⁃1含量均高于对照组,差异均具有统计学意义(表1)。
2.2 研究组中炎性标志物之间的关联性分析
经Spearman相关性分析,研究组血清hs⁃CRP与IL⁃6、sICAM⁃1 均呈正相关(r值分别为0.338 和0.523,P值分别<0.05和<0.01)。
表1 银屑病患者研究组与健康对照组炎性标志物、肱动脉FMD和颈动脉IMT测定结果 (±s)
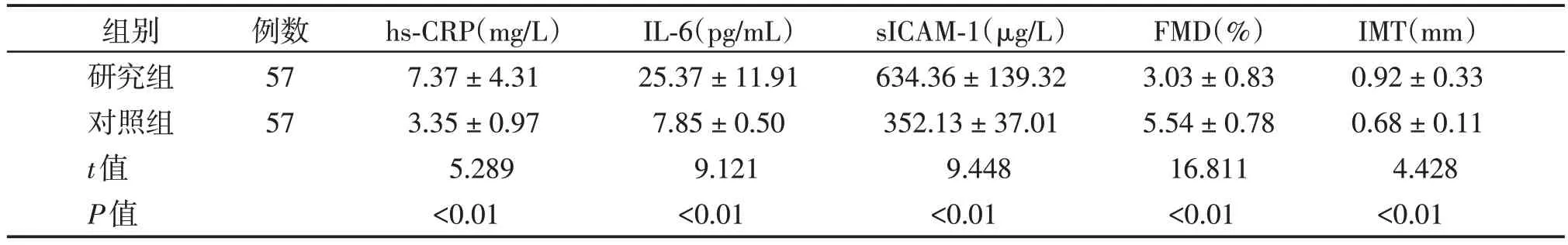
表1 银屑病患者研究组与健康对照组炎性标志物、肱动脉FMD和颈动脉IMT测定结果 (±s)
2.3 研究组与对照组间肱动脉FMD、颈动脉IMT异常率分析
研究组中14 例(24.56%)FMD 值异常,对照组中5 例(8.77%)FMD 值异常,研究组异常率也显著高于对照组(χ2=5.12,P<0.05)。研究组中有11 例(19.30%)被判为颈动脉IMT 异常,对照组有3 例(5.26%)达到IMT 异常,研究组异常率显著高于对照组(χ2=5.21,P<0.05)。
2.4 研究组中炎性标志物与肱动脉FMD 值、颈动脉IMT的关联性分析
经Spearman法进行相关性分析,研究组FMD值与hs⁃CRP、IL⁃6、sICAM⁃1水平呈负相关(r值分别为-0.297、-0.463、-0.312,P值分别<0.05、<0.01、<0.05)。研究组颈动脉IMT与hs⁃CRP、IL⁃6、sICAM⁃1 水平呈正相关(r值分别为0.451、0.433、0.306,P值分别<0.01、<0.01、<0.05)。
3 讨论
学界仍有部分观点认为银屑病与心脑血管疾病存在某些共同易感基因,从而导致了银屑病患者动脉硬化的高发病率[3]。但在其他免疫性疾病研究中,如强直性脊柱炎、系统性红斑狼疮患者中同样出现相较健康人群更高的动脉粥样硬化罹患率。甚至在一些慢性感染性疾病如慢性牙周炎、幽门螺杆菌感染中也看到更显著的动脉粥样硬化发生率,上述现象都不能用基因的观点解释,而炎症贯穿了动脉硬化发生、发展的始终。
银屑病皮损的组织切片中可见表皮Munro小脓肿(实质为大量中性粒细胞聚集),真皮毛细血管周边单一核细胞浸润,均提示局部炎症反应活化。银屑病皮损真皮内部分树突状细胞激活迁移,至哨位淋巴结抗原呈递至T 细胞[4],后者随血迁移并释放出多种炎性细胞因子。这些炎性细胞因子在循环内浓度逐渐提升,血管的损伤开始于界面位置的内皮细胞。我们推测银屑病患者因存在持续炎症反应状态,故心血管系统出现明显疾病症状以前,微观上已存在血管顺应性降低乃至血管内膜增厚的病理生理状态。
CRP 被认作是全身急性炎症反应的非特异指标,而在中度、重度寻常型银屑病中,CRP 的升高与疾病严重程度显著相关,治疗有效则可见CRP水平下降[5]。通过改进检测手段,hs⁃CRP 比普通CRP更灵敏稳定,临床上多使用其评估患者发生心血管事件的危险程度,并协助判断急性心肌梗死患者的预后等。CRP 主要产生激活补体途径、诱导黏附分子等作用,造成细胞毒效应损伤内皮细胞,损伤的结果致使内皮细胞对扩血管物质反应减弱、动脉内膜厚度增厚[6]等。
IL⁃6为前炎性细胞因子,升高较CRP早,又可刺激CRP 生成。IL⁃6 通过触发Ras/Raf/MEK/ERK、PI3K/AKt 及JAK/STAT 途径促进炎症反应。在此基础上,IL⁃6还可改变淋巴细胞流变学特征,使之易于附着在血管内壁,增强血管腔内的阻力[7],并引起血管内皮损伤。
ICAM⁃1隶属于黏附分子超家族,也是一种促炎因子,sICAM⁃1是从血管内皮细胞脱落后的ICAM⁃1可溶解形式,故在已有损伤的血管内皮细胞上丰富表达。ICAM 浓度升高,一方面使得淋巴细胞与内皮细胞间黏附加深,另一方面有助于淋巴细胞渗入血管内皮下。淋巴细胞在内皮组织下增聚后,微血管管内空间缩小,局部微循环发生障碍。活化淋巴细胞释出氧自由基等加剧血管内皮损伤,致血管壁微观结构改变[8]。
本文观察到研究组银屑病患者血清中炎性标志物hs⁃CRP、IL⁃6以及sICAM⁃1三者浓度均有不同程度的升高,与对照组差异有统计学意义,表明银屑病患者处于系统性炎症反应中。研究组患者3个炎性标志物间都呈正相关性,证明三者在炎症级联放大中的作用。
现有的无创检测手段并不能直观检查出心脑血管系统的早期变化,但冠脉造影、血管成像技术不适合对无临床表现的患者做筛查。本研究中,选择FMD、颈部IMT 临床操作相对便捷,仍不失参考价值。FMD因准确、可再现性的特点成为最常用的血管内皮功能替代检测策略。肱动脉与冠状动脉内皮功能的变化情况接近,因此肱动脉可作为观察心脏冠状动脉情况的窗口[9]。颈动脉IMT不仅能观察到颈部血管内壁的形态改变,而且能反映全身动脉硬化程度。研究显示,无冠脉病变者颈部IMT 值更低,颈动脉斑块与颈动脉IMT 结合考察具有较高的心血管事件预测能力。在本研究中,银屑病患者组肱动脉FMD 降低、颈动脉IMT 增厚,从侧面反映这些患者心脑血管系统存在血管内皮功能障碍、血管顺应性降低以及血管内膜增厚的早期病理状态,该类异常发生率与对照组相比具有显著性差异。在进一步相关性分析中,研究组FMD 值、颈动脉IMT 值分别与血清炎性标志物均呈负相关与正相关。由于本研究在对象选择时,已经除外了明确心脑血管疾病病史,同时也剔除了代谢综合征、烟酒等动脉硬化独立危险因素,因此能显示银屑病患者炎症反应状态与病理性改变的发生发展相关。
本研究以寻常型银屑病住院患者作为观察对象,因此不能除外部分银屑病患者急性进展期中皮损发生细菌感染引起一过性的炎症标志物升高。对此,参考国外学者的大样本队列研究[10]发现,重度寻常型银屑病患者心血管事件发生率较健康者增加约40%,同比关节病型银屑病患者发生率则增加20%,说明无论是否存在皮肤细菌感染,均不影响炎症与心血管事件发生的关联性。本文未能阐明一过性感染性炎症或持续存在的非感染性炎症二者之中孰为引发心血管事件的更关键因素,也未引入性别因素、银屑病病程、银屑病皮损面积和严重程度等变量分层分析,这些都有待在今后的研究中继续扩大样本深入分析。
综上所述,本研究提示需进一步关注银屑病患者伴发心脑血管疾病的可能,即使未出现显著临床症状,也要争取早期发现预兆,必要时跨学科诊治,以期最大程度改善银屑病患者的生活质量、降低病死率。

